血小板微粒通过激活单核细胞HIF-1α促进血管生成的作用*
贝俊杰, 雷灵亮, 赵 芬, 孙 诚, 农耀明, 洪绍彩, 赵丽霞
(1武警广西总队医院心内科, 广西 南宁 530003; 2广州市第一人民医院心内科, 广东 广州 510180)
血小板不仅具有止血功能,在免疫反应、炎症和血管生成等方面也发挥重要的病理生理作用[1]。血小板被激活或发生凋亡时会释放血小板微粒(platelet microparticles,PMP),PMP表达和携带多种生物活性分子,可直接激活或传递信号至靶细胞,导致其表型和功能发生变化[2]。在冠心病和缺血性卒中等动脉粥样硬化(atherosclerosis,AS)疾病中,循环中PMP及血小板-单核细胞聚集体的数量明显增多,并且与心血管不良事件的发生呈正相关[3-4]。急性心血管事件通常由斑块破裂所引发,炎症细胞特别是单核巨噬细胞在其中扮演了重要的角色,其通过吞噬脂质、释放炎症介质和促血管生成因子,导致氧化应激、炎症聚集和新生血管形成,最终造成斑块不稳定[5]。我们前期研究发现,PMP可以结合并激活单核细胞,促进其产生致炎症效应[6],但PMP激活单核细胞是否促进血管生成尚不完全清楚。本研究旨在探讨PMP通过单核细胞发挥促血管生成的作用及机制,为防治AS血管生成提供新的思路和实验依据。
材 料 和 方 法
1 细胞和动物
人急性单核细胞性白血病THP-1细胞和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自中科院上海细胞库。C57BL/6雄鼠(6~8周龄)购自陆军军医大学实验动物中心,许可证编号为SYXK(渝)2017-0002。
2 主要试剂
抗CD41a-PE单克隆抗体和Annexin V-APC染料购自BD;流式荧光校准微珠购自BangsLabs;BCA蛋白浓度测定试剂盒购自碧云天;ADP购自Sigma;RNAiso Plus、PrimeScriptTMRT试剂盒和SYBR® Premix Ex TaqTMII均购自TaKaRa;血管内皮生长因子(vascular endothelial growth factor,VEGF)ELISA试剂盒购自武汉博士德;抗P-选择素(P-selectin)中和性抗体和同型对照抗体购自R&D;NE-PER®胞核及胞质蛋白提取试剂购自Thermo;TransAM低氧诱导因子1α(hypoxia-inducible factor-1α, HIF-1α)转录因子活性检测试剂盒购自Active Motif;Matrigel基质胶和Transwell迁移小室均购自Corning;VEGF购自PeproTech;黑毛霉素(chetomin)购自Alexis Biochemicals。
3 主要方法
3.1缓冲液配制 CGS缓冲液(120 mmol/L NaCl, 13 mmol/L Na3C6H5O7·2H2O, 30 mmol/L dextrose, pH 7.0);Tyrode’s缓冲液(137 mmol/L NaCl, 2.8 mmol/L KCl, 12 mmol/L NaHCO3, 1 mmol/L MgCl2, 0.4 mmol/L Na2HPO4, 0.1% BSA, 10 mmol/L HEPES, 5.5 mmol/L glucose, pH 7.4);ACD抗凝剂(21 mmol/L C6H8O7·H2O, 85 mmol/L Na3C6H5O7·2H2O, 83 mmol/L C6H12O6)。经0.22 μm滤膜过滤备用。
3.2血液采集和血小板分离 人外周血取自我院18~30岁的正常献血者,参与研究的献血者均已签订科研知情同意书,并经医院伦理委员会批准同意。血液标本用19G针头采集,ACD抗凝,1 h内用于血小板的分离。将ACD抗凝血置于离心管中,110×g离心15 min去除红细胞及白细胞,获得富血小板血浆(platelet-rich plasma,PRP);吸取PRP转移至新的离心管中,710×g离心15 min,获得血小板沉淀,弃去乏血小板血浆;加入CGS缓冲液洗涤血小板,共3次;洗涤后的血小板沉淀重悬于Tyrode’s缓冲液(含1 mmol/L CaCl2)中,调整血小板浓度至3×1011/L。
3.3PMP的制备和定量 将调整浓度的血小板悬液置入37 ℃恒温箱中,与ADP(20 μmol/L)孵育15 min,激活血小板产生PMP;将激活后的血小板悬液经710 ×g离心15 min,沉淀未被激活的血小板;吸取富含PMP的上清液转移至新的离心管中,经0.8 μm滤膜过滤进一步去除残留的血小板;25 000×g离心60 min沉淀PMP,吸取上清作为后续实验的阴性对照,用Tyrode’s缓冲液重悬PMP,直接用于后续实验,或速冻于-80 ℃并避免反复冻融。
向Tyrode’s缓冲液加入荧光校准微珠(含直径0.2、0.5和0.8 μm),调节FACSVerseTM流式细胞仪,使之能同时分辨上述3种大小的微珠(表明适合进行PMP检测),固定并保存相关参数用于检测。将待测PMP分成3管,并加入相应的抗体或染料:a管,CD41a-PE+Annexin V-APC;b管,Iso-PE+Annexin V-APC;c管,CD41a-PE+Annexin V-APC(不含结合缓冲液)。4 ℃避光孵育30 min;向a管加入直径为1和6 μm的荧光校准微珠。流式细胞术分析:PE及APC双阳性且≤1 μm的事件(events)被定义为PMP,选用6 μm的微珠作为计数参照,按公式PMP(events/μL)=PMP events×beads concentration/beads events计算待测PMP的浓度。
3.4基质胶栓实验 将基质胶预冷融化,按照实验分组,分别将Tyrode’s缓冲液、PMP(5×105)、PMP+chetomin(50 nmol/L)及VEGF(50 μg/L)与400 μL基质胶混匀备用。将准备好的基质胶分别注射到C57BL/6雄鼠(6~8周龄)的右腹部皮下组织,2周后颈椎脱臼法处死小鼠;取出基质胶用0.9%的生理盐水漂洗3次,置于体视显微镜下观察拍照;基质胶多聚甲醛固定、石蜡包埋,5 μm切片后行HE染色,显微镜下观察并采集图片。
3.5细胞培养 THP-1细胞(培养基组成:88% RPMI-1640基础培养基,10%胎牛血清,2 mmol/L L-谷氨酰胺溶液,1%青霉素/链霉素溶液和10 mg/L多粘菌素B)和HUVECs(培养基组成:89% DMEM高糖培养基,10%胎牛血清和1%青霉素/链霉素溶液)复苏后培养于37 ℃、5% CO2浓度的细胞培养箱中,培养3~8代后用于实验。
3.6PMP与THP-1细胞结合 收集培养的THP-1细胞,离心后用含10%胎牛血清的RPMI-1640培养基重悬,调整浓度为2×108/L。取500 μL细胞悬液分别加入500 μL PMP上清液(对照)、3×105PMP(PMP∶cell=3∶1)和1×106PMP(PMP∶cell=10∶1),根据需要同时加入P-selectin中和性抗体(1 mg/L),在常氧(20% O2、5% CO2)或低氧(1% O2、5% CO2和94% N2)条件下,37 ℃培养12 h或24 h。
3.7RT-qPCR法检测目的基因的mRNA表达 收集处理后的细胞悬液,离心后吸取细胞上清液备用。细胞沉淀用RNAiso Plus裂解,经氯仿抽提、异丙醇沉淀、75%乙醇洗涤、室温干燥后,用无核酸酶的水溶解RNA沉淀,NanoDrop 2000分光光度计测定RNA的浓度及纯度,选取合格标本进行后续实验。采用PrimeScriptTMRT reagent Kit试剂盒及PCR仪进行逆转录,按说明书步骤操作。qPCR所用引物由Invitrogen公司合成(序列见表1),采用SYBR® Premix Ex TaqTMII配制反应体系,利用CFX96TMReal-Time System进行PCR,用软件计算基因的Ct值,以GAPDH作为内参照,计算目的基因的表达量。
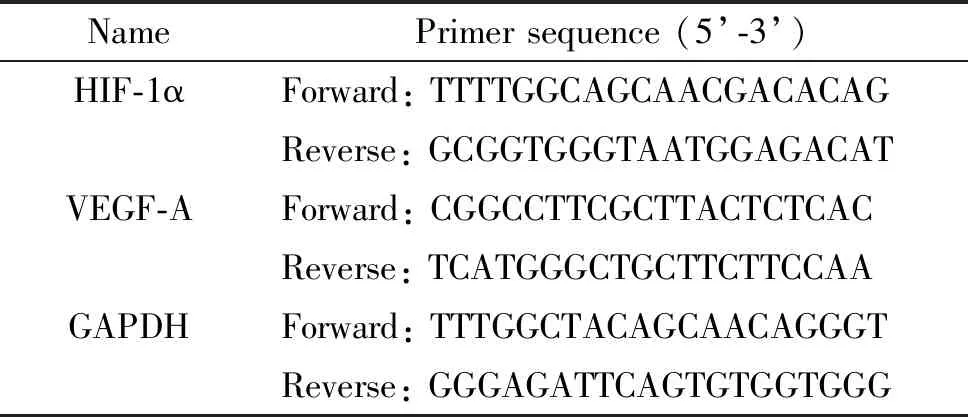
表1 RT-qPCR引物序列
3.8ELISA实验 取收集好的细胞上清液,按试剂盒说明书检测VEGF的分泌水平。
3.9核蛋白的提取及定量 收集处理后的THP-1细胞沉淀,按蛋白提取试剂盒说明书在冰上进行操作,获得细胞核蛋白,以BCA法定量,直接用于后续实验,或速冻于-80 ℃并避免反复冻融。
3.10HIF-1α转录活性实验 取THP-1细胞核蛋白提取物,按试剂盒说明书检测HIF-1α的转录活性。
3.11基质胶管腔形成实验 将预冷融化的基质胶包被于24孔板中,避免产生气泡,包被后的孔板置于37 ℃培养箱中聚合30~60 min。将饥饿24 h的HUVECs按每孔1×104接种于基质胶上,待HUVECs贴壁后将Transwell迁移小室置于孔板之上,构建体外单核细胞-内皮细胞共培养系统。按照实验分组,分别向上室加入培养基、THP-1细胞(每孔5×104)、PMP(每孔5×105)、THP-1细胞+PMP、chetomin(50 nmol/L)、THP-1细胞+PMP+chetomin和VEGF(50 μg/L)。共培养12 h后,移去Transwell小室,显微镜下选择上下左右中5个视野观察各孔的管腔形成情况并拍照。每次实验设立3个复孔。
4 统计学处理
采用GraphPad Prism 6.0软件进行统计分析。数据用均数±标准误(mean±SEM)表示,多组间比较使用单因素方差分析(one-way ANOVA),以P<0.05为差异具有统计学意义。
结 果
1 PMP诱导体内血管生成
基质胶栓大体观察发现,含有PMP和VEGF(阳性对照)的基质胶表面新生血管明显,分枝丰富;而含PMP上清液(阴性对照)的基质胶几乎透明,没有新生血管存在,与前2组相比显著减少(P<0.01),见图1A。基质胶栓切片后镜下观察,PMP和VEGF组可见体积较大或数量较多的管腔结构,且有大量红细胞浸润,而PMP上清液组未见管腔结构,见图1B。HIF-1α参与调控多种血管生成相关基因的转录,采用chetomin(干扰HIF-1与其转录辅激活因子p300的相互作用)选择性抑制HIF-1α的活性导致PMP组的新生血管明显减少,见图1。
2 PMP促进THP-1细胞释放VEGF
PMP可以直接诱导内皮细胞形成血管,也可能通过刺激炎症细胞释放促血管生成物质间接促进血管生成[7]。单核细胞是主要的炎症细胞之一,在炎症反应与血管生成中发挥重要作用。常氧条件下,PMP可促进THP-1细胞释放VEGF,效应呈PMP剂量依赖性和时间依赖性(P<0.01),见图2A。HIF-1α存在于单核细胞中,可被缺氧激活,动脉发生粥样硬化时内膜下的单核细胞处于缺氧状态,因此我们模拟缺氧环境进行实验,结果显示,PMP在缺氧条件下能够进一步诱导THP-1细胞释放VEGF,与常氧条件下产生的效应趋势一致(P<0.05),见图2B。
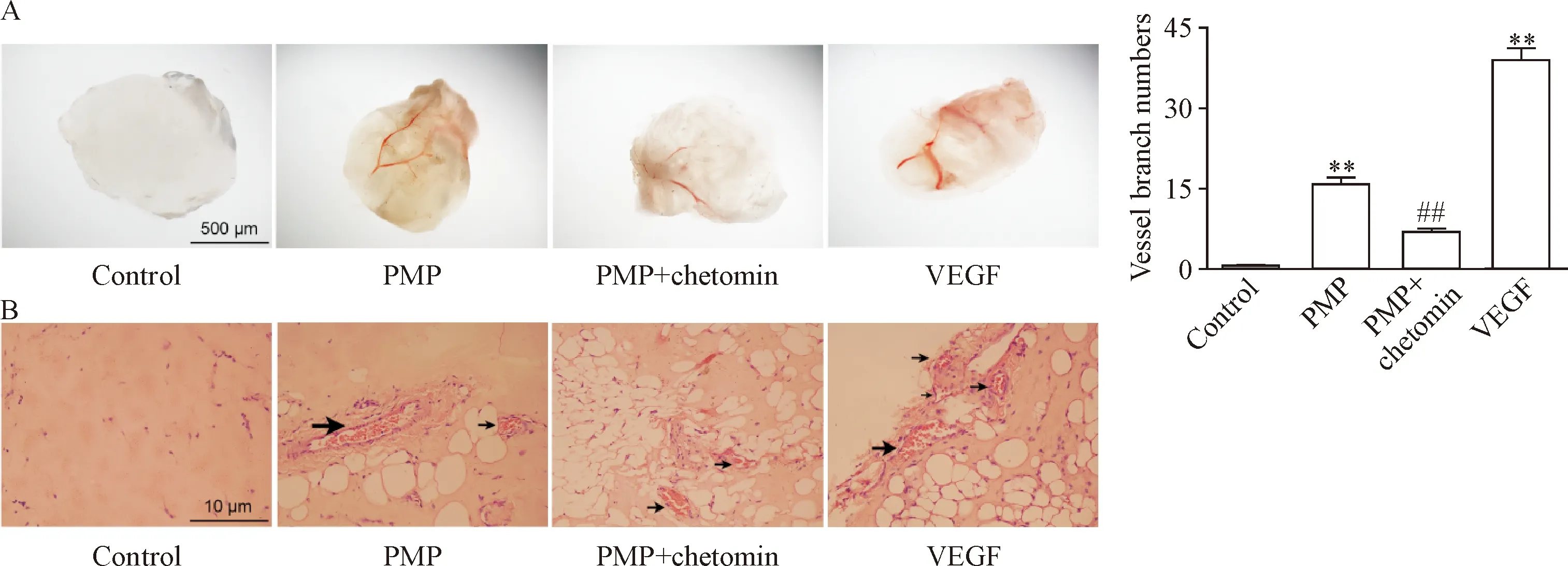
Figure 1. PMP induced angiogenesisinvivomediated by HIF-1α. A: the photographs of each Matrigel plug under a stereo microscope (×8) and the numbers of new vessel branches that formed in the Matrigel plugs; B: paraffin-embedded implantation plug sections were stained with hematoxylin and eosin, and new vessel formation (black arrows) was observed (×200). Mean±SEM.n=6.**P<0.01vscontrol group;##P<0.01vsPMP group.
图1 PMP诱导体内血管生成
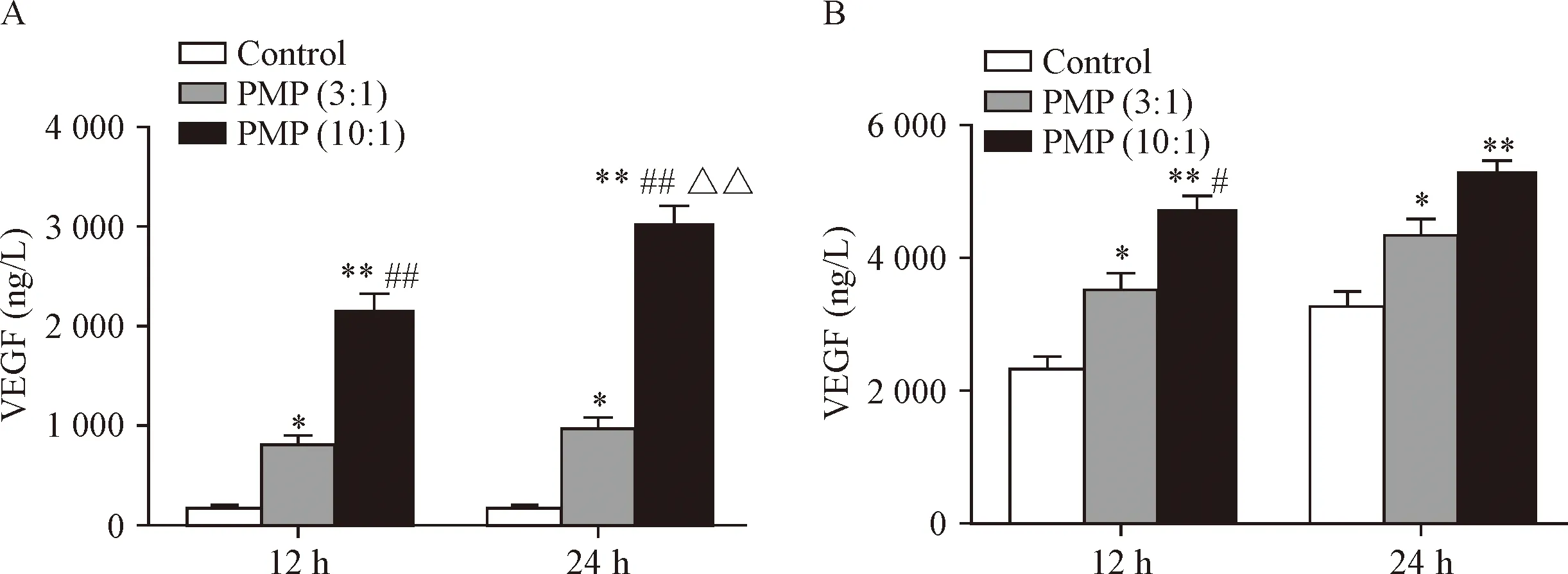
Figure 2. PMP provoked the release of VEGF in the THP-1 cells in a time- and dose-dependent manner under normoxia (A) and hypoxia (B) conditions. The THP-1 cells were treated with PMP supernatant (control) and PMP (ratio of PMP to cell was 3∶1 or 10∶1) for indicated time. The VEGF levels in the supernatants of THP-1 cells were detected by ELISA. Mean±SEM.n=3.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsPMP (3∶1) group;△△P<0.01vs12 h group.
图2 PMP促进THP-1细胞释放VEGF
3 PMP上调THP-1细胞VEGF和HIF-1α的mRNA表达
在基因表达方面,常氧条件下PMP与THP-1细胞作用12 h,可上调THP-1细胞VEGF及其上游转录基因HIF-1α的mRNA的表达,效应呈PMP剂量依赖性(P<0.01),见图3A。在缺氧条件下,PMP也能够促进THP-1细胞VEGF和HIF-1α的mRNA表达(P<0.05),见图3B。
4 PMP激活THP-1细胞HIF-1α促进VEGF的生成
常氧条件下,PMP与THP-1细胞共孵育12 h,THP-1细胞HIF-1α的转录活性明显增强,采用P-选择素中和性抗体(Psel Ab)阻碍PMP与THP-1细胞的结合,该活性明显下降(P<0.05),见图4A。相应的,Psel Ab可明显抑制PMP激活THP-1细胞释放和表达VEGF(P<0.05),见图4B、C。另一方面,使用chetomin抑制HIF-1α的转录活性,THP-1细胞VEGF的释放和mRNA表达也明显减少(P<0.05),见图4D、E。这些结果提示,PMP与THP-1细胞的结合可导致HIF-1α激活,进而启动下游基因VEGF,促进其蛋白表达。
Figure 3. PMP up-regulated mRNA expression of VEGF and HIF-1α in the THP-1 cells in a dose-dependent manner. The THP-1 cells were treated with PMP supernatant (control) and PMP (ratio of PMP to cell was 3∶1 or 10∶1) for 12 h. A: normoxia; B: hypoxia. Mean±SEM.n=4.*P<0.05,**P<0.01vscontrol group;##P<0.01vsPMP (3∶1) group.
图3 PMP上调THP-1细胞VEGF和HIF-1α的mRNA表达
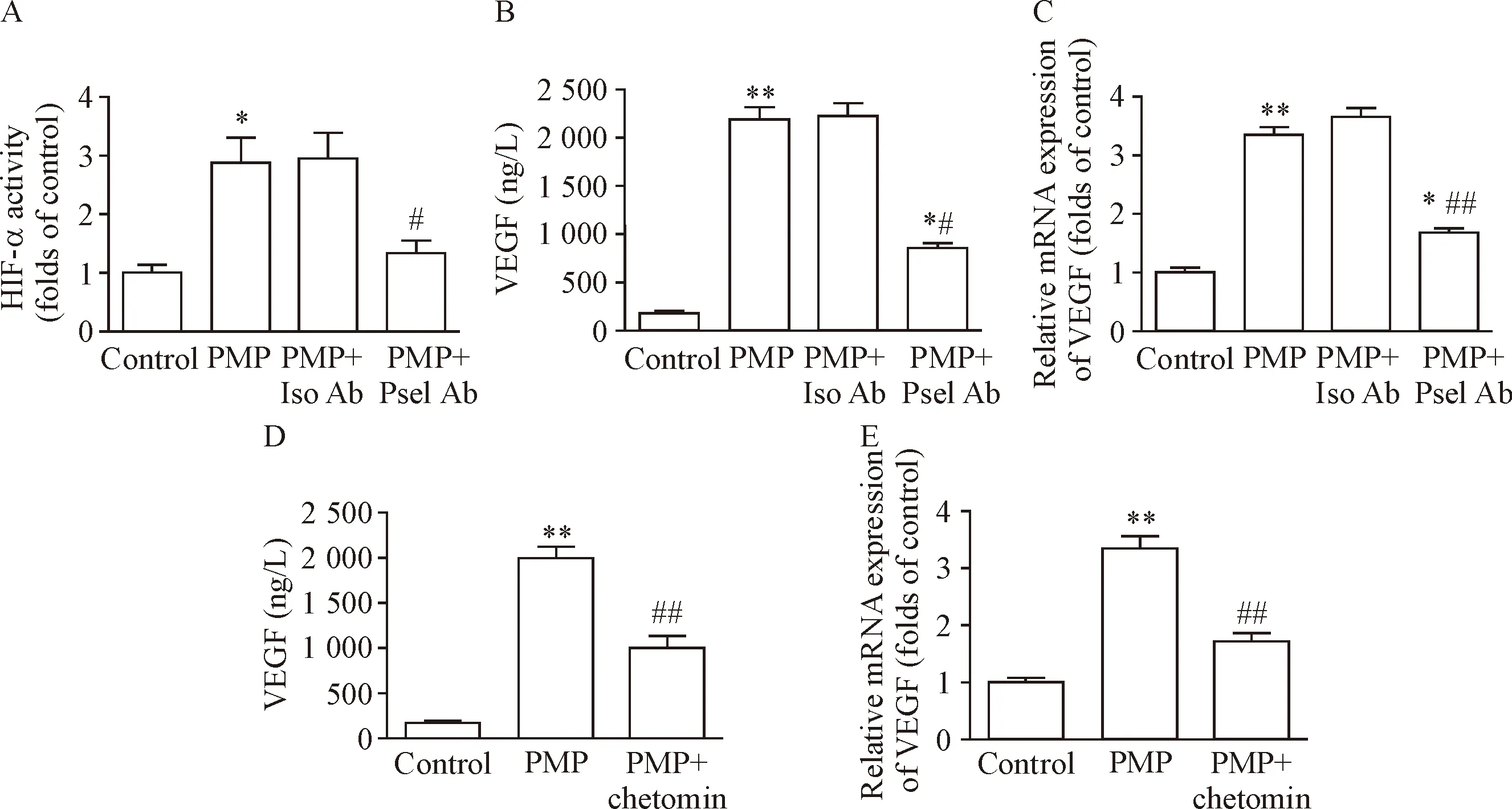
Figure 4. HIF-1α regulated PMP-induced VEGF production in the THP-1 cells. A~C: THP-1 cells were treated with PMP in the presence of P-selectin neutralizing antibody under normoxia condition for 12 h. Transcriptional activity of HIF-1α was tested by TransAM HIF-1α Kit. VEGF at protein and mRNA levels were also tested. Iso Ab: isotype antibody; Psel Ab: P-selectin antibody. D and E: PMP-induced release and mRNA expression of VEGF in the THP-1 cells were suppressed by che-tomin under normoxia condition. Mean±SEM.n=3.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsPMP group or PMP+Iso Ab group.
图4 PMP通过激活THP-1细胞HIF-1α促进VEGF的生成
5 PMP通过激活THP-1细胞HIF-1α促进HUVECs在体外形成管腔样结构
为观察PMP激活THP-1细胞HIF-1α是否具有促血管作用,我们构建单核细胞-内皮细胞共培养系统进行实验。结果显示,常氧条件下PMP作用于THP-1细胞12 h,可促进HUVECs在体外基质胶上形成管腔样结构,该效应可被chetomin明显抑制(P<0.01),见图5。值得注意的是,PMP本身也可促进HUVECs形成管腔样结构的作用,这一结果与既往研究相符,为PMP促血管生成的直接作用。
讨 论
PMP为直径0.1~1 μm的超微膜囊泡,其不单纯是血栓及炎症性疾病的生物学标记物,更是具备功能的生物小体,且较血小板具有更大的活性表面积[7]。此外,与血小板激活后在局部聚集不同,PMP还可随血液循环流动,作用范围更加广泛。单核细胞作为主要的免疫细胞,被激活或受调控后可分化成不同功能的细胞和亚型,展现出吞噬、致炎症及促血管生成等作用[5]。研究显示PMP与单核细胞结合后,不仅能增强单核细胞在血管损伤部位的黏附[8],还能诱导其释放炎症因子产生致炎症效应[6,9],提示PMP可通过单核细胞在AS中发挥作用。
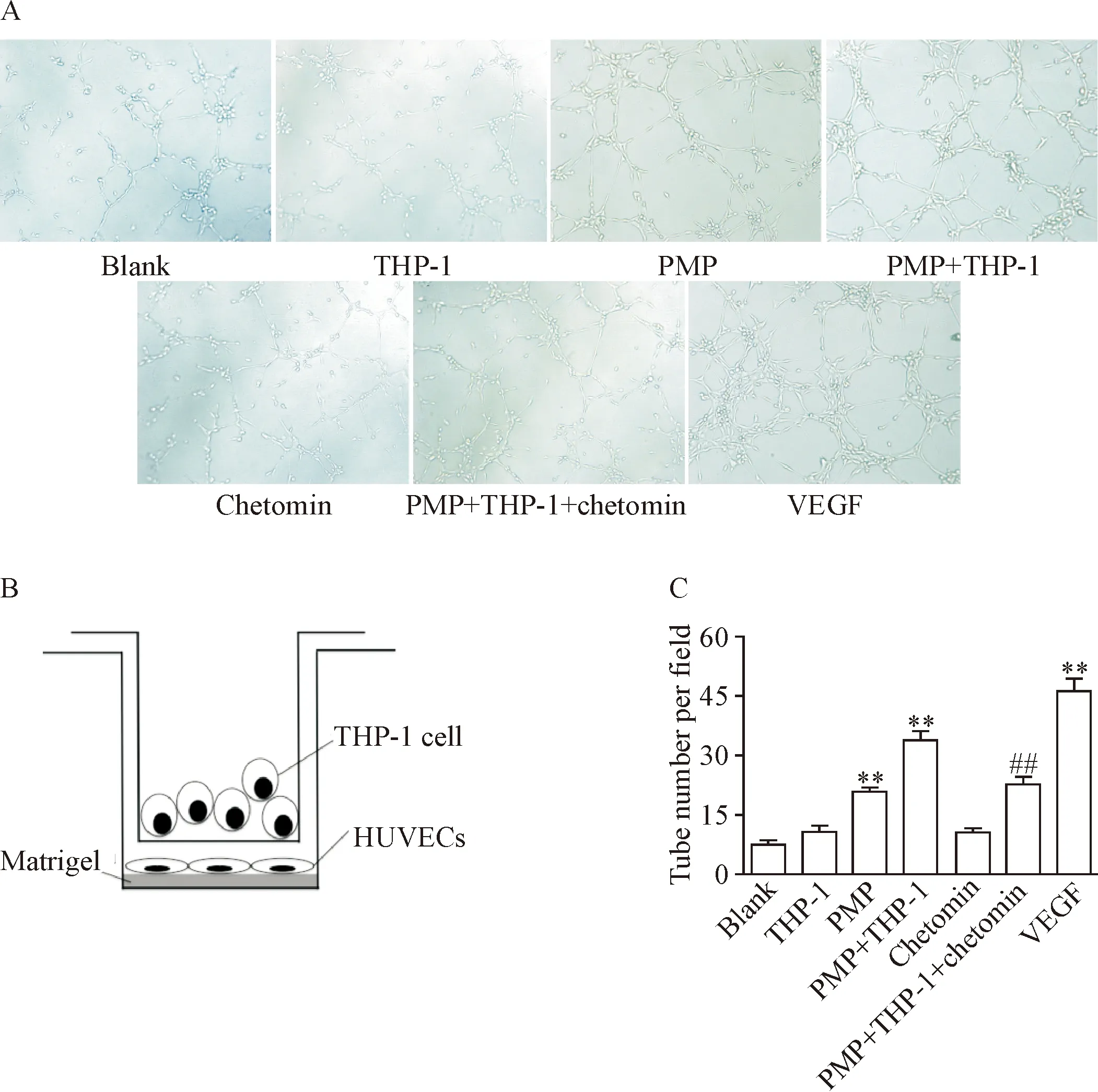
Figure 5. The interaction between PMP and THP-1 cells resulted in capillary-like network formation of HUVECsinvitromediated by HIF-1α. The THP-1 cells were treated with PMP in the presence of HIF-1α inhibitor chetomin under normoxia condition for 12 h, and the number of tube formation was observed under an inverted light microscope (×10). A: the photographs of representative field from each group; B: the diagram of a Transwell co-culture setup; C: the quantitative analysis of the tube number. Mean±SEM.n=3.**P<0.01vsblank group;##P<0.01vsPMP+THP-1 group.
图5 PMP通过激活THP-1细胞HIF-1α促进HUVECs在体外形成管腔
血管生成是AS主要的病理过程之一,而斑块内的血管生成则是导致AS进展和斑块不稳定的重要因素[10]。本研究首先用基质胶栓实验模拟在体情况,发现PMP可诱导新生血管形成,该效应在抑制HIF-1α的转录活性后明显减弱,提示HIF-1α参与介导PMP的促血管生成作用。既往研究显示,HIF-1α、VEGF和巨噬细胞共同存在于病人AS斑块内的缺氧区域,缺氧、氧化低密度脂蛋白、炎症因子等理化生物因素可刺激单核/巨噬细胞产生促血管生成效应[11-12]。我们的结果显示,无论在常氧还是缺氧条件下,PMP均可促进单核细胞释放VEGF,并上调VEGF及其调控基因HIF-1α的mRNA表达。此外,PMP还能增强单核细胞HIF-1α的转录活性,抑制该活性导致VEGF生成减少。与激活的血小板相似,PMP主要依靠P-selectin介导其与靶细胞之间的相互作用。因此,我们利用中和性抗体阻碍P-selectin与单核细胞表面P-选择素糖蛋白配体1的结合,结果发现单核细胞HIF-1α转录活性被大部分抑制,同时单核细胞VEGF的释放和mRNA表达也明显减少,这些结果说明,PMP可能通过与单核细胞结合并激活其HIF-1α促进VEGF的生成。然而,PMP是否还通过膜融合或内吞等其他方式作用于单核细胞进而激活HIF-1α尚不清楚。
为判断HIF-1α激活后单核细胞是否产生促血管生成效应,我们观察其对内皮细胞体外形成管腔的影响。结果显示在PMP激活的单核细胞组,内皮细胞成管数量明显增加,抑制HIF-1α可大部分减弱上述效应,进一步说明PMP激活单核细胞产生促血管生成效应由HIF-1α所介导。HIF-1α的调控网络十分复杂,研究表明单核细胞来源的HIF-1α可以被PI3K-Akt通路磷酸化激活[13-14],而PMP依靠P-selectin与单核细胞结合又可以活化PI3K-Akt通路[9],由此推测PMP可能通过P-selectin-PI3K-Akt-HIF-1α信号通路激活单核细胞产生VEGF,具体机制有待于进一步研究。此外,我们还发现PMP可直接诱导内皮细胞形成管腔,这可能与PMP向内皮细胞传递脂质类生长因子或上调内皮细胞基质金属蛋白酶的表达有关[15-16],表明PMP促血管生成的方式具有多样性。然而,AS血管生成的过程和调控非常复杂,目前的结果需要在AS动物模型上进一步验证。
综上所述,本研究初步表明PMP在体外可以通过单核细胞产生促血管生成效应,机制涉及PMP与单核细胞结合并激活其HIF-1α。该结果可为AS血管新生提供新的实验依据和思路。

