解淀粉芽孢杆菌psd基因过表达对胞苷发酵的影响
,*
(1.宁夏食品微生物应用技术与安全控制重点实验室,宁夏银川 750021;2.宁夏大学农学院,宁夏银川 750021)
胞苷是生物体内核酸的结构组成部分,有重要的调控作用,表现出多方面的生理活性[1]。其用途主要用于生产抗肿瘤、抗病毒药物的中间体,是基因工程研究的原材料[2]。胞苷的深入研究和广泛应用使得其需求量与日俱增,传统的嘧啶核苷生产方法核糖核酸(RNA)水解法已难以满足市场的需求量。因此研究高效合成胞苷的方法,不断提高胞苷生产水平以解决我国的胞苷产量问题就显得尤为重要[3]。

表1 引物序列及其引入的酶切位点Table 1 Primer sequences and their restriction sites
注:引物序列下划线部分表示各酶切位点。
微生物发酵法生产胞苷具有成本低、周期短、产量高等优势,因而得到了高度的重视[4]。近年来,通过发酵法提高胞苷产量的研究逐渐增多。发酵法生产胞苷一般有添加前体物发酵法和直接发酵法,前者通过微生物细胞内的5-磷酸核糖焦磷酸(PRPP)在尿嘧啶核糖磷酸转移酶(pyrR/upp)的催化下直接生成尿苷酸(UMP),经过尿苷二磷酸(UDP)、三磷酸尿苷(UTP)、胞苷三磷酸(CTP)生成胞苷[5-6]。后者利用微生物生成UMP,然后再经UDP、UTP、CTP生成胞苷[7]。增强PRPP合成途径中6-磷酸葡萄糖脱氢酶和PRPP合成酶剂量也能够有效提高胞苷的产量[8],另外还可以通过微生物遗传育种技术,选育高产胞苷的发酵菌株[7]。方海田等[9-10]先后研究了基因定点突变法强化胞苷的合成积累,并用Red重组系统敲除法阻断高丝氨酸途径,增加了天冬氨酸分流量对胞苷的积累。吴晓娇等[11]研究结果表明过表达操纵子基因carAB和pyrBI均可促进胞苷的积累。苏静等[4]通过敲除枯草芽孢杆菌cdd基因,提高胞苷产量。Asahi等[12]利用化学诱变法研究了胞苷高产菌的菌种选育,表明诱变后筛选得到的突变菌株能够提高胞苷发酵单位。另外,孙占敏等[13]、张春艳等[14]、盛春雷等[15]、黄艳辉等[16]和吴晓娇等[17]从胞苷生产菌株的选育和培养基的优化等方面也进行了研究。
研究表明,微生物法生产嘧啶核苷要求菌株具有很强的天然磷酸单酯酶活力[18],而解淀粉芽孢杆菌具备这一特性,另外解淀粉芽孢杆菌全基因组信息清楚,遗传背景清晰,嘧啶代谢通量大,适合作为胞苷生产的出发菌株[19-20]。
本试验以解淀粉芽孢杆菌(B.amyloliquefaciensBG-09)作为出发菌株,通过过表达与细胞膜通透性相关的基因psd,基因psd编码的酶磷脂酰丝氨酸脱羧酶[EC:4.1.1.65]与细胞膜磷脂合成密切相关,进而改变细胞膜结构,使胞苷由细胞内渗透到细胞外,显著提高胞苷产量。同时研究了过表达psd基因对菌体生长、葡萄糖利用和尿苷合成等方面的影响。
1 材料与方法
1.1 材料与仪器
解淀粉芽孢杆菌BG-09、质粒pHT43 宁夏食品微生物应用技术与安全控制重点实验室保藏;DH5a化学感受态细胞 宝日医生物技术(北京)有限公司;pMD19-T载体TaKaRa 宝生物工程(大连)有限公司;细菌基因组DNA小量试剂盒、质粒小量提取试剂盒、凝胶回收试剂盒 宝日医生物技术(北京)有限公司;Fast Digest AatⅡ、Fast Digest BamHⅠ与DL10,000 DNA Maker Ferments公司;其余常规试剂 均为国产分析纯;斜面活化培养基(g/L) 蛋白胨10,酵母粉5,NaCl 10,琼脂10,pH7.0,121 ℃灭菌20 min;LB培养液(g/L) 蛋白胨10,酵母粉5,NaCl 10,pH7.0,121 ℃灭菌20 min;种子培养基(g/L) 葡萄糖5,蛋白胨10,酵母粉5,NaCl 10,pH7.0,121 ℃灭菌15 min;摇瓶发酵培养基(g/L) 葡萄糖100,酵母粉10,K2HPO410,KH2PO40.5,FeSO410 mg,MnSO410 mg,MgSO4400 mg,pH7.0,121 ℃灭菌15 min。
752N分光光度计 上海精科实业有限公司;SBA-40E生物传感分析仪 山东省科学院生物研究所;JY92-IINP超声波细胞粉碎机 宁波新芝生物科技股份有限公司;LC-16岛津液相色谱仪 北京岛津医疗器械有限公司。
1.2 实验方法
1.2.1 引物设计与合成 根据解淀粉芽孢杆菌BG-09psd基因全序列(KEGG登录号T00582),采用Primer Premier 5.0设计引物。根据试验要求,在psd基因上下游100 bp范围内设计上下游扩增引物,并分别在上、下游引物中添加AatⅡ和BamHⅠ酶切位点。添加保护碱基后,设计一对引物psd-S,psd-A,用于扩增psd基因上、下游片段(表1),并委托生工生物工程(上海)有限公司合成。依据两酶切位点,设计质粒pHT43的鉴定引物,如表2所示。

表2 鉴定引物设计Table 2 Design of primers for identification
1.2.2 解淀粉芽孢杆菌基因组DNA的提取 采用TaKaRa细菌基因组小量提取试剂盒提取解淀粉芽孢杆菌BG-09基因组DNA,提取后用1%琼脂糖凝胶进行电泳检测,提取的DNA置于-20 ℃冰箱保存。
1.2.3psd基因克隆 以解淀粉芽孢杆菌BG-09基因组DNA为模板,分别加入正、反向引物,PCR扩增psd基因,反应产物经1%琼脂糖凝胶电泳后纯化回收。PCR反应的体系:Premix Taq 25 μL,模板1 μL,正、向引物各1 μL,dd H2O 22 μL。PCR反应条件:DNA模板经过95 ℃预变性5 min,进入30个循环:先95 ℃变性50 s成单链,60 ℃退火30 s使得引物分别与其同源序列相结合,再72 ℃延伸1.5 min形成双链,最后72 ℃再延伸5 min,4 ℃保存。文中其他PCR反应均按照此反应条件和比例进行。
1.2.4 TA克隆载体构建 回收目的DNA片段并连接至pMD19-T载体上,将连接产物转化至DH5a感受态细胞,在LB平板上培养;挑取阳性克隆菌落进行PCR鉴定,提取质粒经AatⅡ和BamHⅠ 酶切鉴定后得到阳性克隆,并送至生工生物工程(上海)股份有限公司进行测序。
1.2.5 重组载体构建 采用AatⅡ、BamHⅠ对测序正确的阳性克隆质粒与质粒pHT43进行双酶切,分别回收884和8038 bp的骨架载体片段,按4∶1的比例于16 ℃经T4 DNA连接酶过夜连接,将所得连接产物转化至DH5a感受态细胞,在含有50 mg/mL氨苄青霉素和氯霉素的LB培养基上培养[21]。从转化菌落中提取重组载体,重组克隆质粒经菌落PCR鉴定、提取质粒PCR鉴定和双酶切鉴定后,将阳性转化子测序,将测序正确的克隆命名为pHT43-psd。
1.2.6 解淀粉芽孢杆菌电转化感受态细胞的制备及转化 解淀粉芽孢杆菌BG-09电转化感受态细胞的制备及转化[22]。转化后转化子的多少通过在涂布相同转化菌液量的情况下平板上菌落计数确定,转化子阳性率的鉴定通过菌落PCR鉴定、提取质粒PCR鉴定、双酶切鉴定和鉴定引物鉴定[23]。验证成功的菌株即为构建好的工程株,保存菌株,并将菌株命名为B.amyloliquefaciensBG-09-psd。
1.2.7 重组质粒的诱导表达 将经过测序验证的重组菌株B.amyloliquefaciensBG-09-psd和B.amyloliquefaciensBG-09单菌落分别接种于含终浓度50 mg/L氯霉素、氨苄青霉素的LB和LB培养液试管中,37 ℃、200 r/min培养过夜;以1%接种量接种于含有30 mL LB培养液的500 mL三角瓶中,37 ℃、200 r/min 培养至OD600=0.6~0.8,加入0.5 mmol/L(终浓度)IPTG,再培养4 h后取出离心收集菌体,经超声破碎后取细胞裂解产物进行SDS-PAGE蛋白电泳分析。同时以B.amyloliquefaciensBG-09和带有空质粒pHT43的菌株B.amyloliquefaciensBG-09作为对照实验[11,24]。
1.2.8 工程菌摇瓶发酵试验 将经过验证的重组菌株B.amyloliquefaciensBG-09-psd单菌落接入装有种子培养基中,37 ℃、200 r/min振荡培养24 h后,按10%的接种量接入装有发酵培养基的摇瓶中,37 ℃、200 r/min振荡培养70 h。同时以出发菌株B.amyloliquefaciensBG-09作为对照试验[11]。
1.2.9 菌体密度测定 分别取不同发酵时间的发酵液,用蒸馏水稀释,采用752型分光光度计于600 nm处测其吸光值[25]。
1.2.10 发酵液中残糖测定 取不同发酵时间的发酵液,稀释到其中葡萄糖质量浓度0~1 g/L,采用SBA-40E生物传感分析仪测定[11]。
1.2.11 胞苷产量测定 采用高效液相色谱法(HPLC)测定发酵液中胞苷产量。色谱条件:Agilent C18(5 μm,250 mm×4.6 mm)为分离柱,V(乙腈)∶V(水)=4∶96为流动相,流动相流速为1 mL/min,柱温30 ℃,检测波长270 nm,检测器为紫外检测器[26-27]。
1.3 数据处理
文中所有数据结果均以三组平行试验的平均值±标准差表示,采用Origin软件作图。
2 结果与分析
2.1 psd基因上下游扩增及TA克隆载体构建
2.1.1psd基因上下游片段扩增 以解淀粉芽孢杆菌BG-09总DNA为模板,以特异性引物psd-S、psd-A扩增目的片段。如图1所示,1、2序列扩增产物在880 bp左右有明显条带,与目的片段大小一致。如图2所示,1、2序列切胶回收条带清晰。

图2 目的片段PCR切胶回收Fig.2 PCR cutting gel recovery of target fragment注:M:DL10000 DNA Marker;1、2:PCR扩增产物回收。
2.1.2 TA克隆载体鉴定 挑取阳性克隆菌落对重组质粒进行菌落PCR鉴定,如图3所示,1~24条带均为阳性菌落扩增产物,其中第19条带不正确,其它扩增产物大小分布在880 bp左右,与目标条带大小一致,可初步鉴定为阳性克隆。

图3 重组质粒T-psd菌落PCR鉴定结果Fig.3 PCR identification results of recombinant plasmid T-psd colony注:M:DL10000 DNA Marker;1~24:阳性菌落扩增产物,其中19条带不正确。
为进一步验证重组质粒的正确性,防止PCR扩增造成的假阳性,挑取阳性克隆用AatⅡ、BamHⅠ对提取质粒进行双酶切鉴定。结果如图4所示,挑取的阳性克隆经双酶切后,均获得长度大约为880和2700 bp的基因和空载体,进一步证实该克隆为包含目的片段的阳性克隆。将TA-psd提质粒进行PCR,结果如图5所示。其中2、4、5条带不正确,17、18、19未扩增出条带,将剩余的1、3、6、9、12号初步鉴定的阳性克隆菌株送去测序,测序结果表明1、9号为阳性克隆菌株,选定1号菌株进行下一步实验。

图4 重组质粒T-psd的双酶切(A)和pHT43双酶切(B)Fig.4 Double enzymatic digestion of recombinant plasmid T-psd(A)and pHT43 double digestion results(B)注:M:DL10000 DNA Marker;(A)1:重组质粒T-psd的双酶切;(B)1:pHT43双酶切。

图5 TA-psd提取质粒PCR扩增结果Fig.5 TA-psd extraction plasmid PCR amplification results 注:M:DL10000 DNA Marker;1~19:TA-psd提质粒PCR,其中2、4、5条带不正确。
2.2 重组载体pHT43-psd的鉴定
如图6和图7所示,转化子经菌落PCR和提取质粒PCR鉴定后,在880 bp左右均扩增出明显条带,与目标条带一致;图8序列3显示提取的质粒经AatⅡ、BamH 双酶切后,得到两条片段长度大约分别为880和8038 bp,与连接长度一致,表明带有基因psd的重组载体pHT43-psd构建成功,测序鉴定结果也说明序列完全正确。

图6 转化子菌落PCR鉴定结果Fig.6 Identification results of PCR of transformant colony注:M:DL10000 DNA Marker;1~24为转化子菌落PCR,其中13、20是正确条带。

图7 转化子提取质粒PCR扩增结果Fig.7 PCR amplification results of plasmids extracted from the transforman注:M:DL10000 DNA Marker;1~7转化子提取质粒PCR,5号条带不正确。

图8 转化子双酶切鉴定结果Fig.8 Identification results of transformants by double enzyme digestion注:M:DL10000 DNA Marker;1~3:转化子双酶切,其中3为正确条带。
2.3 电转化法转化B. amyloliquefaciens BG-09
解淀粉芽孢杆菌的自然感受态是在对数生长后期开始形成的,由于不同生长时期的菌体产生感受态的敏感程度不一样,因而选择合适的生长时期对于感受态的形成与再生较为关键[28]。转化子菌落形态如图9所示,与原始菌株B.amyloliquefaciensBG-09相比,在相同的培养时间内经过电转化构建的菌株形态明显小于原始菌株B.amyloliquefaciensBG-09,在电转化过程中瞬时高压对菌株造成伤害,使菌株数量变少,菌体形态变小。挑取阳性克隆菌落进行菌落PCR鉴定,结果如图10所示,10号菌落PCR鉴定得到880 bp的条带,验证正确;提取质粒PCR、提取质粒双酶切和引物鉴定分别如图11、图12和图13所示,提取质粒PCR得到大约880 bp的条带,鉴定引物PCR未扩增出条带,均证明重组质粒成功导入解淀粉芽孢杆菌BG-09中。
图9 转化后B. amyloliquefaciens BG-09-psd菌落形态Fig.9 Morphology of B. amyloliquefaciensBG-09-psd colony after transformation

图10 菌落PCR鉴定结果Fig.10 Identification results of colony by PCR注:M:DL10000 DNA Marker;1~14菌落PCR,其中10号为正确条带。
图11 提取质粒PCR鉴定结果Fig.11 Identification results of extracted plasmid by PCR

图12 提取质粒双酶切鉴定结果Fig.12 Identification results of extraction plasmidsby double enzyme digestion

图13 鉴定引物PCR鉴定结果Fig.13 Identification results of identification primers by PCR
2.4 重组质粒(B. amyloliquefaciens BG-09-psd)的诱导表达
将B.amyloliquefaciensBG-09-psd超声破碎,收集菌体和上清液,进行SDS-PAGE蛋白电泳,结果如图14所示,由图14可知,psd基因在破碎的菌体中有表达。在相对分子量约为32 kDa处有蛋白条带,表明psd基因在B.amyloliquefaciensBG-09中得到表达。
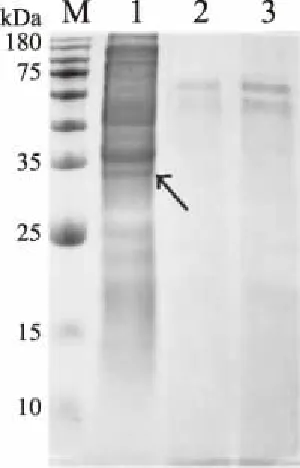
图14 psd表达的SDS-PAGE结果(图中箭头有改动)Fig.14 SDS-PAGE results of psd expression注:M:Marker(10-180KDa);泳道1:B.amyloliquefaciens BG-09-psd;2:B.amyloliquefaciens BG-09;3:B.amyloliquefaciens BG-09-pHT43。
2.5 重组质粒对菌体生长与耗糖的影响
图15和图16分别为菌株发酵生产胞苷的菌株生长及耗糖速度的变化曲线,可以看出,重组质粒对菌体的生长和耗糖都有一定的影响,工程菌B.amyloliquefaciensBG-09和菌株B.amyloliquefaciensBG-09-psd大约在10 h后进入对数生长期,B.amyloliquefaciensBG-09-psd菌株的最大OD600值为5.949,出发菌为5.928,生长水平相当,生长能力没有受到抑制。B.amyloliquefaciensBG-09-psd在0~50 h OD600值较菌株B.amyloliquefaciensBG-09有所下降,可能与psd基因有关,推测为psd基因改变细胞膜通透性从而导致细胞代谢失衡所致。

图15 不同菌株的发酵生长曲线Fig.15 Fermentation growth curve of different strains
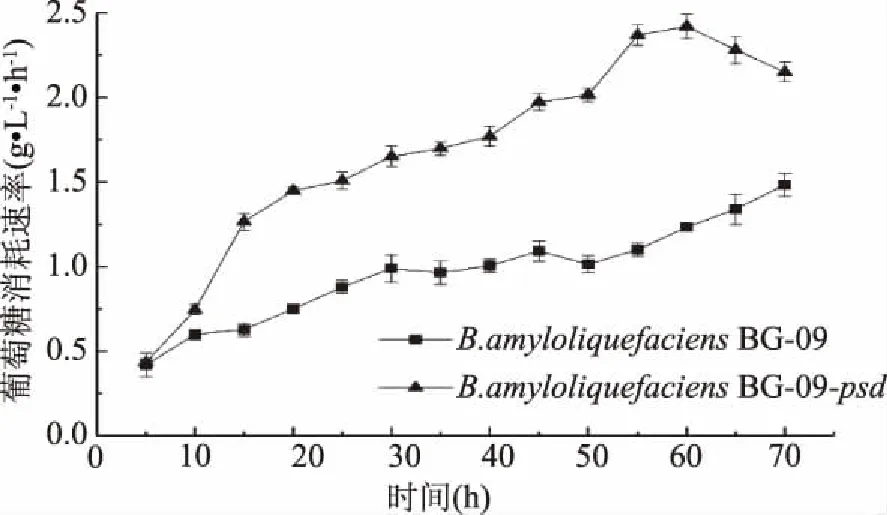
图16 不同菌株的耗糖速率曲线Fig.16 Curve of rate of sugar consumption of different strains
在0~50 h菌体密度与耗糖速率成正相关,随着有害代谢副产物的积累,菌体的生长受到限制,在发酵后期菌株B.amyloliquefaciensBG-09-psd耗糖速率呈下降趋势。菌株B.amyloliquefaciensBG-09-psd的耗糖速率在60 h时达到最大值2.420 g·L-1·h-1,工程菌B.amyloliquefaciensBG-09在60 h时耗糖速率为1.235 g·L-1·h-1,较B.amyloliquefaciensBG-09-psd低48.97%。在0~60 h葡萄糖的消耗速率增加是由于在此过程中胞苷、尿苷等代谢产物的不断积累;菌株B.amyloliquefaciensBG-09-psd60 h后葡萄糖消耗量减少是由于菌体生长进入稳定期,产生了抑制性的发酵副产物,抑制了菌体生长,所以葡萄糖的消耗量逐渐减少,也可能是菌体产生的代谢产物之间发生了相关的反应,减少了菌体对葡萄糖的消耗或是产生的代谢产物能代替葡萄糖作为能源物质;发酵过程中,重组菌株B.amyloliquefaciensBG-09-psd葡萄糖消耗速率变化快于B.amyloliquefaciensBG-09,这说明过表达基因psd对菌体的生长和耗糖速率都有一定的影响,使菌体的代谢负担加重,葡萄糖消耗速率增加,菌体生长较慢且更早地进入对数生长期较晚地进入生长稳定期。
2.6 重组质粒对胞苷积累的影响
将培养过程中发酵液离心取上清,HPLC法测定发酵液中胞苷的积累量,以解淀粉芽孢杆菌BG-09原始菌株作为对照,分别测定了不同菌株的尿苷和胞苷产量,探究发酵0~70 h过程中尿苷产量及其对胞苷产量的影响。由图17、图18可知,菌株B.amyloliquefaciensBG-09和B.amyloliquefaciensBG-09-psd的20~70 h发酵液中均含有尿苷和胞苷。发酵过程中,菌株B.amyloliquefaciensBG-09-psd70 h可以积累(0.552±0.02) g/L尿苷,比B.amyloliquefaciensBG-09菌株尿苷产量(0.578±0.01) g增加了6.56%。在发酵过程中尿苷大体呈现先减少后增加的趋势,由于发酵初期营养物质丰富尿苷迅速合成,之后绝大部分的尿苷分解产生尿嘧啶所致,而菌株B.amyloliquefaciensBG-09-psd变化较明显,原因可能是psd基因过表达影响了细胞膜的通透性。
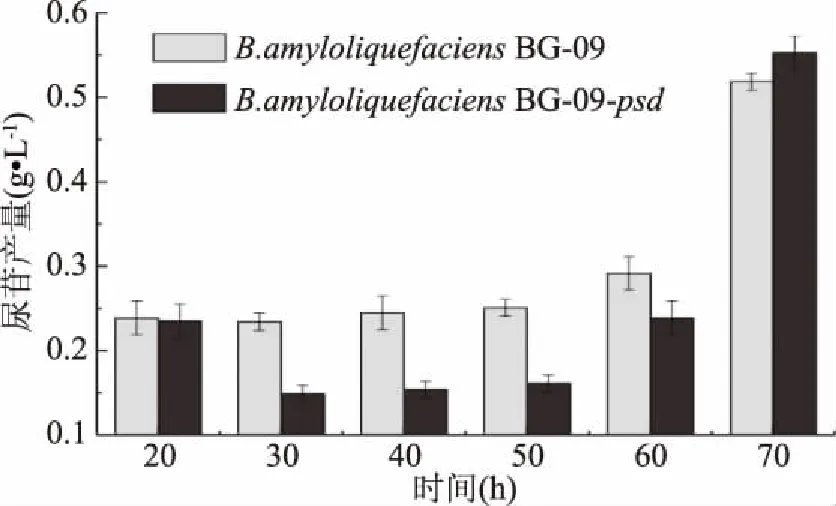
图17 不同菌株的尿苷产量Fig.17 Uridine yield of different strains
发酵过程中,菌株B.amyloliquefaciensBG-09 70 h可以积累(1.038±0.03) g/L胞苷,B.amyloliquefaciensBG-09-psd积累(1.199±0.02) g/L,比出发菌B.amyloliquefaciensBG-09产量提高了15.51%。重组菌株B.amyloliquefaciensBG-09-psd发酵产物明显高于菌株B.amyloliquefaciensBG-09,由此说明过表达基因psd能够增强嘧啶代谢途径,使胞苷的积累量有所提高。在发酵前60 h内,过表达psd基因也能够使尿苷向胞苷合成的方向移动,增加胞苷累积量。

图18 不同菌株的胞苷产量Fig.18 Cytidine yield of different strains
3 结论
本文通过过表达解淀粉芽孢杆菌BG-09有关细胞膜渗透性基因psd,分析对胞苷产量的影响。结果表明,过表达基因psd对菌体的生长有一定的影响,使菌体更早地进入对数生长期、较晚地进入生长稳定期。在发酵70 h可以积累(1.199±0.02) g/L胞苷,比出发菌B.amyloliquefaciensBG-09产量提高了15.51%。原始菌株B.amyloliquefaciensBG-09 70 h可以积累(0.518±0.01) g/L尿苷,重组菌株B.amyloliquefaciensBG-09-psd积累(0.552±0.02) g/L,比出发菌B.amyloliquefaciensBG-09产量增加了6.56%。过表达基因psd可以有效改变细胞膜渗透性,促进胞苷的分泌,从而使胞苷产量提高。为了显著提高胞苷的产量,下一步研究的重点将是通过基因工程技术把胞苷合成途径中影响细胞膜渗透性的相关基因进行串联表达,或从优化培养基和降低副产物的积累等多方面提高胞苷产量。

