淀粉微胶囊对茶多酚的载运及其对餐后血糖反应的影响
刘天棋,张根义
(江南大学 食品学院,江苏 无锡 214122)
茶多酚(Tea polyphenols,TP)含多种羟基,具有强抗氧化性,是一种自然强抗氧化剂[1],拥有抗肿瘤等各种生理活性[2],能够较好地抑制淀粉的酶解[3-9],有助于淀粉慢消化,降低餐后血糖水平,从而能够对有关的慢性疾病起到预防和治疗的作用,是当代营养学与食品科学范畴的钻研热门。但茶多酚稳定性较差,对环境因素敏感,极易被破坏,因此当机体直接摄入茶多酚,茶多酚由于受到对消化环境敏感、小肠对茶多酚的转运效率低、机体代谢速度快、膳食环境复杂等许多方面的影响[10],造成其在达到小肠上半段充分施展其功能之前,就已经在胃里大量损失了。
为应对以上情况,本文先选取载运体系包载茶多酚,然后选用合适的壁材进行二次包埋。目前对于茶多酚的载运体系有竹叶纤维[11]、交联PVP凝胶[12]、酸性白土[13]、脂质体[14]、酵母细胞[15]等。 这些材料都有其自身的局限性,存在工艺复杂、容易残留、生理相容性较差等问题。轻度糊化淀粉是采用物理改性的方法,在淀粉糊化的峰值温度以下,处理淀粉较短的时间,在其并未完全糊化的状态下,再利用冷冻干燥技术制备的吸附力较强的一种改性淀粉[16]。同其他吸附材料对比,轻度糊化玉米淀粉不仅具有耗资少、易于操作、不添加化学试剂、无毒[17]等特点,还有较大的比表面积和孔容比,能够将客体分子吸附到淀粉颗粒孔洞内部,依靠分子间作用力对客体分子起到类似于“包埋”的作用。因此,轻度糊化玉米淀粉是非常好的淀粉基包埋材料和缓释剂。
海藻酸钠是一种天然褐藻和海藻衍生的带阴离子的多糖[18],与Ca2+等同时存在时会发生凝胶化,且其凝胶对pH很敏感、同人体的相容程度好,具有抗酸和肠溶性特点,被广泛应用于食品、药品等行业[19-22]。壳聚糖是由甲壳素去掉乙酰官能团后获取的链是线性的多糖,含有大量伯胺基[23],能与海藻酸钠的羧基形成聚电解质膜。壳聚糖具有与植物纤维素和人体骨胶原组织相似的双重结构,生物特性极好[24]。
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料、试剂 茶多酚购自杭州禾田生物技术有限公司;普通玉米淀粉,购自国民淀粉化学有限公司;海藻酸钠、壳聚糖、无水CaCl2、95%乙醇、醋酸、醋酸钠、NaOH、没食子酸、Folin-phenol试剂、碳酸氢钠、盐酸、KH2PO4等和胰蛋白酶是国药购买;HK法测定葡萄糖试剂盒购买于利德曼 (北京);α-淀粉酶、葡萄糖苷酶、胃蛋白酶从Sigma公司购买。
1.1.2 主要仪器、动物 型号PB4001E精密电子天平:美塔雷脱立多国家股份公司;电子天平:精密科学 (上海)有限公司;DELTA320 pH计:Mettler Toledo;H0one-A恒温磁力搅拌器:上海赛斯设备有限公司;THZ-Eight2恒温水浴振荡器:Guohua有限公司;DZF-1B型真空干燥箱:Abotai实验设备有限公司(上海);超低温冷冻冰箱:美国瑞威克有限公司;1 mL 注射器(0.5 mm×20 mm):无锡 SoulYu 医疗器械有限公司;80-2B型低速度离心机:安亭实验仪器责任有限公司;光谱M5型酶标仪:美国分子器件有限公司;2800UV型紫外分光光度计:上海Unique仪器有限公司;S3500型激光粒度自动分析仪:美国麦奇克有限公司;IS10傅里叶红外变换光谱仪:美国尼克莱特公司;FEI Quanta 200扫描电子显微镜、血糖测试仪、测定纸:美国强生公司;One-Touch血糖测试仪:强生(中国)医疗器材有限公司。
SPF级健康KM雄性小鼠,于Slake实验动物公司购买,江南大学实验动物中心饲养,饲养条件:温度(25±2) ℃,相对湿度(60±5)%。
1.2 实验方法
1.2.1 茶多酚用量的测定方法 选用福林酚[25-26]法量化溶液里茶多酚的量,将没食子酸(Gallic acid)作比照品,设置适当浓度梯度与福林酚溶液作用,经过3~8 min,添加4 mL质量浓度75 g/L Na2CO3溶液,加水,然后摇匀,室温静置1 h,于765 nm条件下量定吸光度(Abs)并制作标准曲线。
茶多酚的包载量及包埋率的量化方法为

式中:c1为TP溶液质量浓度;V1为TP溶液体积;c2为洗涤液和滤液TP质量浓度;V2为滤液及洗涤液体积;M为干燥后微胶囊质量。
1.2.2 轻度糊化玉米淀粉的制备 取适量普通玉米淀粉(通过GB/T 21305—2007/IOS712:1998测得其水分含量为13.4%),于90℃(低于糊化温度)处理1 min,然后立即在-40℃冰箱预冻12 h,之后冷冻干燥48 h(-80℃、真空度10 Pa),经粉碎处理后就获得轻度糊化玉米淀粉。
1.2.3 微胶囊的制备 取适量轻度糊化玉米淀粉,加入20 mL 25 mg/mL茶多酚,放入20℃恒温水浴振荡器里吸附60 min,转速设定为110 r/min,之后与海藻酸钠10 mL搅动均匀,取一定浓度的壳聚糖和氯化钙各25 mL搅拌均匀并调节pH。用齿轮泵将轻度糊化玉米淀粉、茶多酚与海藻酸钠混合液匀速泵入装有壳聚糖、氯化钙的烧杯里,静置20 min后过滤并水洗,将滤液和洗涤液混合之后测定总体积与吸光度,计算茶多酚含量。真空干燥即得微胶囊。
1.2.4 海藻酸质量浓度作用于微胶囊释放茶多酚的情况 称取轻度糊化玉米淀粉1.5 g放入烧杯,向烧杯添加20 mL 25 mg/mL茶多酚,放入20℃恒温水浴振荡器里,110 r/min吸附60 min。配置质量浓度分别为 0.5、1.5、2.5、3.5和 4.5 g/L的海藻酸钠溶液,各取10 mL分别加入到上述混合液中,搅匀后泵入25 mL质量浓度1 g/L的壳聚糖和25 mL质量浓度10 g/L CaCl2构成的混合液里。将最终获得的各微胶囊放入模拟胃、肠液里测量茶多酚的释放情况,确定海藻酸钠的最适质量浓度。
1.2.5 正交试验设计 以壳聚糖质量浓度 (A)、氯化钙质量浓度(B)、pH值(C)3要素各选取 3水平实施正交试验,用样品于模拟胃液、模拟肠液里处理30 min时茶多酚释放速率做评定标准,表明各要素对茶多酚在胃肠道里释放情况的作用水平。
1.2.6 轻度糊化玉米淀粉及微胶囊粒径分布 选取激光粒度分析仪,对样品的粒径情况做测量,将微胶囊样品置于样品槽中,经过对粒群衍射,由计算机推算出粒群相应粒径散布。
1.2.7 傅里叶变换红外分析 准确称取样品与溴化钾粉末(20∶1)混合均匀,研磨后压片,通过 IS10型傅里叶红外光谱仪进行测试,以空白溴化钾片作为参比,测定限度为 420~4 000 cm-1。
1.2.8 SEM扫描电镜分析 采用SEM扫描定性分析样品颗粒。将适量的样品进行固定、脱水、干燥和粘样后,镀上一层重金属膜,便可进行镜检,放大适当的倍数,观察样品的形态变化情况。
1.2.9 微胶囊于模拟胃液环境的释放情况 首先制备模拟胃液:将9 mL盐酸、80 mL蒸馏水和10 g胃蛋白酶混合,搅拌均匀,pH调节至1.2,用1 000mL容量瓶定容再预热至37℃备用。每种样品称1 g加入100 mL具塞锥形瓶里,添加40 mL模拟胃液,预热至37℃,放到恒温振荡器(<200 r/min)处理, 在 0、5、10、15、20、30、40、60、75、90、105 和 120 min取样1 mL,检测总酚含量(以空白胃液与福林酚试剂反应作为分光光度测定时候的空白对照),计算累积释放率,并补充等量模拟液。
1.2.10 微胶囊于模拟肠液环境的释放情况 制备模拟肠液:称取6.8 g磷酸二氢钾,用250 mL蒸馏水溶解,添加190 mL 0.2 mol/L的氢氧化钠和400mL水,加入10 g胰蛋白酶,调节pH值为7,用1 000 mL容量瓶定容后预热至37℃备用。分离出上述模拟胃液中处理0.5和2.0 h的微胶囊,洗涤后放到盛有50 mL模拟肠液(预热到37℃)锥形瓶里,放入恒温振荡器(<300 r/min)里处理,在 10、20、30、60、90、120、150和180 min取样1 mL,检测总酚含量(以空白肠液与福林酚试剂反应作为分光光度测定时候的空白对照),获得释放率的累计值,并增补同样体积的模拟液。
1.2.11 微胶囊对小麦粉体外消化性的影响 称取95 mg小麦粉与5 mg茶多酚和相应质量的各样品(使得茶多酚占淀粉质量的5%)于具塞试管中,加入pH为5.2的醋酸-醋酸钠缓冲溶液5 mL,再加入搅拌子,95℃水浴20 min,磁力搅拌速度为500 r/min。冷却至37℃后,分别移取1 mL样品,加入备好到37℃的1 mL α-淀粉酶及葡萄糖苷酶(290 U/mL∶15 U/mL)酶液里,在 37℃前提下处理,分别在酶解反应的第0~120 min内每隔20 min抽样100μL,加入 900 μL 无水乙醇,离心 3 min(转速 1 000 r/min)后采用己糖激酶(HK)法[27]测量反应后体系里葡萄糖的量,并按如下方法求出小麦粉体外消化率,计算快消化淀粉、慢消化淀粉及抗性淀粉所占比例。
淀粉体外消化率=葡萄糖含量×0.9×100%
RDS 快消化淀粉(%)=(G20-FG)×0.9/TS
SDS 慢消化淀粉(%)=(G120-G20)×0.9/TS
RS 抗性淀粉(%)=[TS-(RDS+SDS)]/TS
其中:FG为淀粉中游离的葡萄糖含量,G20为样品水解20 min后的葡萄糖含量,G120为样品水解120 min后的葡萄糖含量,TS为总淀粉含量。
1.2.12 微胶囊对小鼠餐后血糖反应的影响 选取禁食5 h后空腹血糖正常的小鼠,随机划成4组,各组6只,设定为空白组、对照组1、对照组2及样品组 (组间差不大于1.1 mmol/L)[28]。空白组按照0.1mL/10 g给小鼠灌胃糊化后的小麦粉;对照组1灌胃糊化后的小麦粉与茶多酚(占总质量的5%)混合物;对照组2灌胃糊化后的小麦粉与未包埋茶多酚的微胶囊;样品组灌胃糊化后的小麦粉与包埋了茶多酚的微胶囊(保证样品组的茶多酚含量与对照组1 的相等), 并在 0、15、30、45、60、90 和 120 min 选择尾尖取血,利用强生血糖仪测量血糖值。
2 结果与讨论
2.1 没食子酸标准曲线
获得回归方程y=0.011 32x+0.009 77,R2=0.999 5。其中:x为没食子酸的质量浓度,y为吸光值。
2.2 海藻酸质量浓度作用于微胶囊释放茶多酚的情况
海藻酸钠的黏度相对较大,与干燥后微胶囊释放茶多酚的速度也有较大关系,因此,寻找适当的海藻酸钠质量浓度,对于实现茶多酚在胃中被保护及在小肠上端迅速定点释放很重要。实验显示,若海藻酸钠的质量浓度较高(3.5和4.5 g/L),形成的微胶囊在胃中120 min时的TP释放率分别为9.12%和7.30%,缓释效果较好,但在肠中30 min的释放率分别为43.0%和37.7%,释放较慢,无法实现在小肠上半段的定点释放;而当质量浓度较低(0.5和1.5 g/L)时,TP在肠中释放率较高分别为61.0%和60.99%,但在胃中120 min的释放率分别为31.0%和19.9%,释放率较大,无法有效保护茶多酚;若海藻酸钠质量浓度是2.5 g/L,微胶囊在胃中120min释放率为13.32%,释放率较低,而在肠中30 min的释放率为59.7%,释放较快。因此,综合在胃和肠道的释放效果,选择海藻酸钠的质量浓度为2.5 g/L。
2.3 正交试验结果分析
经过分析,选取1.5 g轻度糊化玉米淀粉、质量浓度2.5 g/L的海藻酸钠10 mL、25 mg/mL的茶多酚溶液20 mL、壳聚糖和氯化钙都是25 mL。实施的正交试验的结果如表1所示。

表1 正交试验设计及结果Table 1 Orthogonal experiment design and results
由表1可知,各因素影响茶多酚在胃中和肠中的释放率的顺序都为氯化钙质量浓度>pH值>壳聚糖质量浓度。最佳工艺为A2B2C2,即壳聚糖质量浓度1 g/L、氯化钙质量浓度10 g/L、pH值3.5。表2方差分析表明,要素壳聚糖质量浓度(A)、氯化钙质量浓度(B)、pH值(C)于茶多酚在胃中的释放率都存在显著性影响(P<0.05),从表3可知,要素氯化钙质量浓度(B)于茶多酚在肠中的释放率存在显著影响(P<0.05),因素壳聚糖的质量浓度(A)、pH 值(C)没有显著影响。为检验这个最佳试验水平,再做3次重复试验,得到微胶囊对茶多酚的包埋率分别是86.32%、84.5%、81.42%,平均包埋率为84.08%;包载量分别是214.7、207.13和201.97 mg/g,平均包载量为207.6 mg/g;在胃液中处理30 min时的茶多酚释放率分别是12.3%、9.57%、8.4%,平均释放率是10.09%;在肠液中处理30 min时的茶多酚释放率分别是65.5%、60.7%、58.06%,平均释放率是61.42%。3次试验的数据相差不大,证明这个制备条件相对稳定,试验可行性强,获得的微胶囊外观形状规则、不粘连。

表2 方差分析(胃液中30 min释放率)Table 2 Analysis of variance(release rate of 30 min in gastric juice)

表3 方差分析(肠液中30 min释放率)Table 3 Analysis of variance(release rate of 30 min in the intestinal fluid)
当不添加壳聚糖时,测定微胶囊的茶多酚包埋率为(42.37±1.4)%,包载量为(90.4±3.67) mg/g,饱满效果较差,且制备的微胶囊在胃液中30 min的释放率较大,为(37.56±1.21)%,无法实现对茶多酚的有效保护,因此在制备微胶囊时须添加壳聚糖。
2.4 轻度糊化玉米淀粉及微胶囊粒径分布
用激光粒度仪将轻度糊化玉米淀粉、没有包载芯材茶多酚的壁壳和包载了茶多酚的微胶囊做了分析,结果如图1所示。

图1 轻度糊化玉米淀粉粒径分布Fig.1 Particle size distribution of mild gelatinized corn starch
由图1可知,和普通玉米淀粉相比,经过轻度糊化处理的淀粉粒径稍有增大,但增大幅度不明显。分析其原因是糊化过程水分子进入到淀粉颗粒内部使得淀粉膨胀,之后水分子经预冻后结冰并升华,淀粉颗粒框架不变,致使粒径增大[29]。
如图2所示,微胶囊的粒径分布为:1 100~1 000 μm 占 1.1%;1 000~830 μm 占 9.79%;830~600 μm 占 16.1%;600~530 μm 占 41.26%;530~400 μm 占 21.79%;400~330 μm 占 6.4%;330~250 μm占2.66%;250~175 μm 占 0.9%,符合高斯分布。 且同未包载芯材茶多酚的外壁相比较,微胶囊的粒径有所增大,推测是由于外壁包载了茶多酚,使得微胶囊的粒径增加。
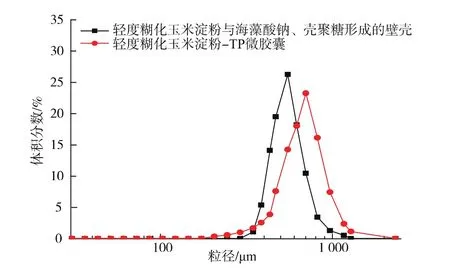
图2 轻度糊化玉米淀粉、壳聚糖、海藻酸钠组成的外壁及微胶囊粒径分布Fig.2 Particle size distribution of microcapsules and wall shell formed by mild gelatinized starch,sodium alginate and chitosan
2.5 傅里叶红外分析
由图3可见,壳聚糖的O-H特征峰在3 415 cm-1,-NH2的吸收峰在 1 575 cm-1;海藻酸钠的 O-H特征峰在3 400 cm-1,苯环的C-H振动在2 930 cm-1,1 615 cm-1是-COO-不对称伸缩振动峰;轻度糊化玉米淀粉的O-H的特征峰出现在3 000~3 500 cm-1,而707 cm-1处出现淀粉的特征峰。这些表明了壳聚糖上氨基与海藻酸钠上羧基相结合成了聚电解质膜,包载了轻度糊化玉米淀粉。
轻度糊化玉米淀粉+壁材吸收峰幅度明显减小,可能是因为形成的壁壳是复合凝聚物。轻度糊化玉米淀粉-TP微胶囊图谱的TP的峰显着削弱,并且组合体的图谱和壁壳的类似,说明茶多酚进到了微胶囊的内腔,羟基的特征吸收峰在3 000~3 700 cm-1,这一波段代表了不同羟基的波数,包埋了茶多酚的微胶囊的峰比胃包埋茶多酚的壁壳的峰强度高,说明微胶囊包埋了茶多酚,壁壳和茶多酚之间形成了更多的羟基,羟基的种类和数量有所增加。这些都证明了包埋物的生成。

图3 各组分及微胶囊的FTIR图Fig.3 FTIR spectrum of each component and microcapsule
2.6 SEM扫描表征分析
从图4可看出,未添加茶多酚时的外壁褶皱较为明显且外观粗糙,可能是外壁表面有较多孔隙,而加入茶多酚之后,微胶囊褶皱相对平浅,外观相对平滑,这或许是茶多酚被包埋造成的。且从图中褶皱处可以看出由壁材包埋形成的外壁层较薄,这将有利于微胶囊在进入小肠时快速释放茶多酚,以实现茶多酚的定点释放。

图4 壁壳、轻度糊化玉米淀粉-TP微胶囊及微胶囊群体的扫描电镜图Fig.4 SEM images of wall,mild gelatinized corn starch-TP microcapsulesand mild gelatinized corn starch-TP microcapsule group
2.7 微胶囊于模拟胃液环境的释放情况
同时研究了几种不同组合方式微胶囊,从图5可以看出有突释情况,这是没有被包载的残留在微胶囊表面的TP造成的,在突释后的释放过程中,茶多酚从微胶囊里释放的同时也会遭到胃液的破坏,所以释放率曲线表现出波动的状况。
轻度糊化玉米淀粉在吸附TP后,在没有添加壁材时,在模拟胃液里的释放速度较快,释放率也较高,使得TP损失较多,不能对TP起到较好的保护作用,而添加了壁材之后,TP于胃里的释放速率和释放量降低明显,证明了添加壁材的重要性。
以改性淀粉为芯材载体的微胶囊与以普通玉米淀粉为芯材载体形成的微胶囊相比,在胃中对TP的保护效果更好,这是因为与普通玉米淀粉相比,改性淀粉由于其自身物理结构的改变,吸附TP的能力更强,因此在胃中的释放更为缓慢,释放率也更低。
微胶囊在胃液里的释放率为 0.5 h:(10.09±0.25)%,2.0 h:(16.22±0.84)%。 表明在 pH1.2 时,包埋物的释放较缓慢。

图5 微胶囊于模拟胃液的释放情况Fig.5 Release of microcapsules in simulated gastric fluid
2.8 微胶囊于模拟肠液环境的释放情况
从图6可以看出,在胃液里停留0.5与2.0 h的微胶囊在肠液里都出现了快速释放,在肠液里反应0.5 h时,在胃液里停留0.5 h的微胶囊释放速率达到(61.42±1.13)%,在胃里停留 2.0 h的微胶囊的释放率达到了(72.40±1.32)%,后者在肠中的释放率稍快,但两者没有显著差异,说明制备的微胶囊在胃中比较稳定,不因为在胃中停留的时间过长而结构被破坏,在进入肠中以后受肠液pH的影响快速释放出茶多酚,能够达到包埋物于胃中少溶于肠中快速释放。
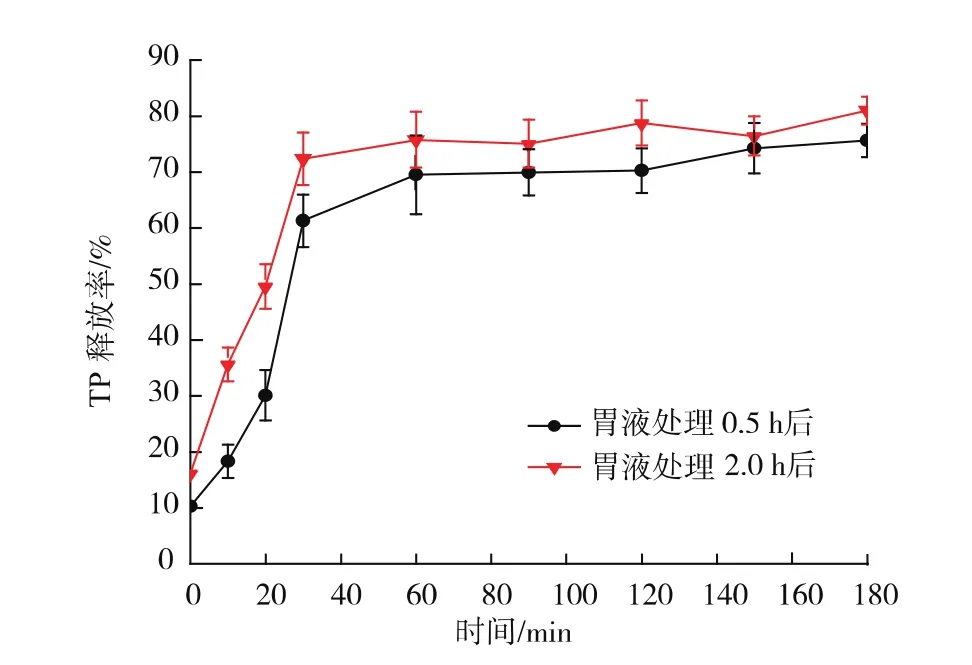
图6 胃液分别处理0.5 h和2.0 h后微胶囊在模拟肠液里的释放情况Fig.6 Release of microcapsules in simulated intestinal fluid after being treated by simulated gastric fluid for 0.5 and 2.0 hours
2.9 微胶囊对小麦粉体外消化性的影响
由图7和表4可知,直接添加茶多酚的小麦粉组与单独的小麦粉组的体外消化结果并无明显差异,说明直接添加茶多酚时,茶多酚由于未被保护而大量损失,无法发挥促进淀粉慢消化的效果;没有包载茶多酚的轻度糊化玉米淀粉微胶囊组与单独的小麦组的消化结果无明显差异,说明芯材载体轻度糊化玉米淀粉的慢消化作用可忽略不计;而含有等量茶多酚的轻度糊化玉米淀粉-TP组的快消化淀粉含量减少了16.13%,抗性淀粉的含量增加13.51%,表明微胶囊较好地保护了茶多酚,且茶多酚发挥了有效的促进淀粉慢消化的功能。

图7 微胶囊对小麦粉体外消化性的影响Fig.7 Effects of microcapsules on the digestive properties of wheat flour in vitro

表4 不同样品中的 RDS、SDS、RS 的含量(x±s,n=3)Table 4 Content of fast digested starch (RDS),slow digested starch (SDS) and resistant starch(RS)in different samples
2.10 微胶囊对小鼠餐后血糖反应的影响
将以轻度糊化玉米淀粉为芯材载体的茶多酚微胶囊对小鼠实施灌胃,并观测小鼠的餐后血糖波动,结果如图8所示。
由图8可以看出,单独只灌胃小麦粉后,小鼠餐后血糖迅速升高,并在30 min血糖升高了5.90 mmol/L,达到餐后血糖峰值,且与小麦粉直接和茶多酚混合组相比,并无显著差异。

图8 灌胃微胶囊的小鼠餐后血糖反应曲线Fig.8 Blood glucose response curve after meals of mice fed with microcapsules
与只灌胃小麦粉组和小麦粉直接与茶多酚混合组相比,具有等量茶多酚的轻度糊化玉米淀粉-TP微胶囊组的餐后血糖反应明显较低,微胶囊组在餐后15 min的血糖含量仅为小麦粉组的61.80%左右,为小麦粉直接加茶多酚组的64.64%左右,餐后30 min的血糖相比小麦组降低了32.15%,相比小麦粉直接加茶多酚组降低了29.87%,血糖明显降低。
微胶囊组的餐后血糖的峰值出现在45 min,推迟了15 min,且血糖最大波动值分别仅为4.20 mmol/L,证明茶多酚微胶囊能够使餐后血糖波动整体趋势相对平缓。
3 结 语
本实验采用轻度糊化玉米淀粉包载茶多酚,再利用抗酸与肠溶性、且对pH敏感、生物相容较高的海藻酸钠、壳聚糖为壁材,对芯材进行包埋,壁材的质量浓度及比例在经优化后既能成膜包裹芯材载体及芯材,又不至于影响芯材在小肠中的快速释放,实现壁壳在胃中稳定,减少茶多酚在胃中的损失,而到达小肠上半段快速溶解,定点释放茶多酚。确定制备条件是1.5 g轻度糊化玉米淀粉,20 mL 25 mg/mL的茶多酚,10 mL 2.5 g/L的海藻酸钠,25 mL 1 g/L的壳聚糖,25 mL 10 g/L的氯化钙,用NaHCO3调节pH为3.5,在最佳条件下获得的轻度糊化玉米淀粉-TP微胶囊的茶多酚包埋率达84.08%,平均包载量为207.6 mg/g。若只采用海藻酸钠和壳聚糖来包载茶多酚,干燥之后骨架脆弱,整体呈片状,而本实验通过添加改性淀粉,克服了这一缺点,使微胶囊形态得到完善,包埋率也得到提高。
将微胶囊进行小麦粉体外消化实验,结果表明相对于未经保护的茶多酚直接与小麦粉的消化结果,经微胶囊化的茶多酚能很好地实现淀粉慢消化,且在小鼠实验中也得到了验证,相对于直接灌胃茶多酚的小鼠,灌胃微胶囊组的小鼠餐后血糖波动整体趋势相对平缓,血糖峰值明显降低,且峰值出现的时间推迟了15 min。淀粉微胶囊实现淀粉慢消化及对餐后血糖反应影响的原理还有待进一步研究。

