一种靶向于生长抑素受体2的药物筛选模型的建立与应用
顾倩倩,刘 翠,方伟彬,刘培庆,李 民
(中山大学药学院,新药成药性评估与评价国家地方联合工程实验室,广州 510006)
生长抑素(somatostatin,SST)是一种由14个氨基酸组成的环状多肽,最早于1968年从大鼠的下丘脑中被分离出来[1]。SST可作用于多种器官,包括大脑、垂体、肠道、胰腺、肾上腺、甲状腺和肾脏等,在机体内主要发挥内源性的抑制作用[2]。SST主要适用于急性胰腺炎,上消化道出血,胰、胆、肠瘘的辅助治疗,肢端肥大症等[3-4]。内源性的SST半衰期较短,通常只有1~3 min,临床上常用的生长抑素制剂有思他宁、奥曲肽和兰瑞肽。为了开发更多作用时间长、疗效好的生长抑素类似物(somatostatin analogue,SSTA)及激动剂,首先要构建稳定可靠的细胞模型。
SST发挥作用需要靶向于生长抑素受体(somatostatin receptors,SSTRs),该类受体属于G蛋白偶联型受体,共含有5种亚型,分别为SSTR1、SSTR2、SSTR3、SSTR4以及SSTR5[5]。相对于该受体家族的其它成员,SSTR2分布最广,与疾病联系最为紧密[6]。因此本研究选择以SSTR2为靶点,构建稳定的细胞筛选模型。
细胞内Ca2+作为一种第二信使,通过调整其浓度升高或降低在多种信号通路中发挥作用。钙流检测原理为荧光指示剂Fluo-4/AM为酯化形式,与活细胞孵育一段时间后可透过细胞膜进入细胞内,细胞内的酯酶会将其水解成游离酸形式,从而与胞内的Ca2+相互作用,在一定波长下可以检测到荧光信号的变化[7]。当SSTRs被激活后会与抑制型G蛋白( Gi )相偶联,从而使细胞内Ca2+浓度上升。本研究旨在构建SSTR2稳定表达的细胞株,为该受体激动剂或SSTA的筛选奠定模型基础。
1 材料和方法
1.1 材料pENTER-SSTR2购自美国Vigenebio公司;载体pEGFP-N3以及HEK293细胞株由本实验室保存;PCR酶购自日本TOYOBO公司;XhoI、BamHI以及T4 DNA连接酶购自美国Thermo公司;转染试剂Lipo 2000、钙离子指示剂Fluo-4/AM购自美国Invitrogen公司;G418粉末购自中国浩玛公司;HBSS购自美国HyClone公司;pluronic F-127、Probenecid购自中国美伦公司;BSA购自中国翔博生物公司;96孔黑壁底透板购自美国Costar公司; GAPDH抗体(6004-1-lg)购自美国Proteintech公司;GFP抗体(sc-9996)购自中国Santa Cruz公司;思他宁制剂购自瑞士Merck公司;Flex Station 3多功能酶标仪工作站购自美国Molecular Devices公司;化学发光成像系统购自美国Azure公司。
1.2 质粒构建[8]根据载体pEGFP-N3及SSTR2目的基因序列信息设计引物,F: 5′-CCGCTCGAGCTATGGACATGGCGGATGAGCCA-3′ (XhoI) ; R: 5′-CGGGATCCGATACTGGTTTGGAGGTCTC-3′ (BamHI)。以pENTER-SSTR2作为模板,按照KOD酶说明书操作,PCR扩增获得约1.1 kb的目的片段,用胶回收试剂盒对其进行回收。将回收后的目的片段与载体pEGFP-N3用XhoI和BamHI进行双酶切,酶切产物回收后用T4 DNA连接酶连接。最后用DH5a感受态细胞对连接产物进行转化,转化的菌板置于37 ℃培养箱过夜。次日,挑取3个单菌落进行菌落PCR。选取阳性克隆摇菌提质粒,进行双酶切鉴定并送公司测序,将测序结果与人源SSTR2序列比对。获得的重组质粒命名为SSTR2-pEGFP-N3。
1.3 细胞转染及观察将HEK293细胞接种于60 mm培养皿,细胞在贴壁12~24 h后密度占0.60~0.80。将SSTR2-pEGFP-N3重组质粒以及空白质粒pEGFP-N3按Lipo2000试剂说明书步骤分别进行转染,4~6 h后更换为无双抗的完全培养基。继续培养至24 h,使用荧光显微镜观察GFP绿色荧光,对比两组细胞绿色荧光的分布。
1.4 mRNA水平验证提取实验组SSTR2-GFP-HEK293与对照组pEGFP-N3-HEK293两组细胞的RNA,按照逆转录试剂盒操作说明逆转录成cDNA。设计qPCR引物:GAPDH-F: 5′-ACCCACTCCTCCAC CTTTGA-3′, R: 5′-CTGTTGCTGTAGCCAAATTCGT-3′; SSTR2-F: 5′-TGGCTATCCATTCCATTTGACC-3′, R: 5′-AGGACTGCATTGCTTGTCAGG-3′。取适量cDNA加入SYBR Green Mix及引物,利用实时荧光定量PCR仪进行qPCR。根据实验所得Cp值计算实验组与对照组中SSTR2的相对mRNA表达水平。
1.5 Western-blot验证将实验组及对照组细胞分别接种于35 mm培养皿中,待细胞贴壁后,倒弃培养基,加入细胞裂解液,收集细胞置于冰上裂解30 min。离心取蛋白上清,使用BCA试剂盒定量,两组蛋白样品均为20 μg,沸水浴5 min使蛋白变性。采用70 V、30 min浓缩,120 V、60 min分离的条件进行电泳,230 mA、90 min的条件进行电转。电转完牛奶室温封闭1 h,并于4 ℃环境中过夜孵育一抗GAPDH及GFP。用TBST清洗3次,洗完后的PVDF膜室温孵育对应二抗1 h,TBST清洗后用化学发光成像仪显影曝光,对目的蛋白条带进行分析。
1.6 稳转细胞株的筛选将鉴定成功的SSTR2-GFP-HEK293细胞用1 g·L-1的G418筛选。筛选一周之后,用胰酶消化细胞,取少量细胞种于96孔板的A1孔中,使细胞数量大致在4 000~5 000个。对A1孔中的细胞进行横竖梯度稀释,使单克隆细胞集中分布于96孔板的右下方部位。种好的96孔板置于37 ℃、5% CO2培养箱中培养两个星期左右,期间3~5 d换一次液。待单克隆长成较大的集落,于荧光显微镜下挑取带绿色荧光的克隆,即阳性克隆。阳性克隆扩大培养,获得SSTR2过表达的稳转细胞株,命名为SSTR2-GFP-HEK293。
1.7 钙流检测体系的建立取适量SSTR2-GFP-HEK293细胞种于96孔黑壁底透的培养板中,待细胞贴壁24 h后,开始钙流检测。参考文献[9-10],首先配制钙流检测工作液:2 μmol·L-1的Fluo-4/AM、质量分数为0.05% 的Pluronic F-127、2.5 mmol·L-1Probenecid、质量分数为0.1%的 BSA,溶剂为含钙镁不含酚红的HBSS。用预热至37 ℃含质量分数为0.1% BSA的HBSS溶液清洗细胞两次。清洗后,每孔加入50 μL的钙流检测工作液,于培养箱中孵育40 min。用相同的HBSS溶液清洗细胞,至少1次。洗后每孔加入160 μL含质量分数为0.1% BSA的HBSS溶液,于培养箱中放置10 min。为了验证钙流检测体系的可行性,使用阳性药离子霉素(Ionomycin),配制成20 μmol·L-1的母液(5×),用Flex station 3检测激发波长485 nm,发射波长525 nm下的荧光。
1.8 检测条件的优化在确定检测体系可行性以及构建的SSTR2-GFP-HEK293稳转细胞株在生长抑素制剂思他宁的刺激下会产生特异性钙流信号变化后,为了获得较高的信号窗口(ΔRFU)以及相对经济适宜的筛选条件,本研究对检测细胞数量、荧光指示剂浓度、以及指示剂的孵育时间进行了优化。在40 μmol·L-1生长抑素制剂思他宁的作用下对比每孔10 000~50 000个细胞,荧光指示剂浓度为2~5 μmol·L-1,指示剂孵育时间分别为30、45、60、75、90、105 min相应条件下ΔRFU的变化。在最适条件下对3个不同批次SSTR2激动剂思他宁进行EC50检测。
1.9 统计学分析所有数据分析均采用GraphPad Prism 5软件。实验组与对照组钙流信号ΔRFU采用两组间t检验数据处理分析,EC50值通过非线性拟合获得。每组实验均设置3个复孔, ΔRFU为钙流信号最大值与前20 s仪器加样前基线平均值的差值。Stimulation/%=(ΔRFU-ΔRFUmin)/(ΔRFUmax-ΔRFUmin) ×100%
2 结果
2.1 SSTR2-pEGFP-N3质粒的鉴定由PCR扩增获得1.1 kb的SSTR2目的条带(Fig 1A),挑取3个克隆进行菌落PCR,琼脂糖凝胶电泳结果显示3个为阳性克隆(Fig 1B)。选取其中1号克隆摇菌提质粒,并用XhoI、BamHI进行双酶切,酶切获得全长质粒(5.8 kb)、载体(4.7 kb)以及SSTR2基因(1.1 kb)的目的条带,符合对应片段大小(Fig 1C)。双酶切鉴定成功的质粒测序进一步确认,测序结果显示与NCBI上SSTR2的目的序列完全匹配。
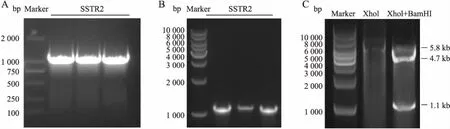
Fig 1 Construction and identification of recombinant plasmids SSTR2-pEGFP-N3
A: The fragment of SSTR2 was amplified by PCR from the template of pENTER-SSTR2; B: The positive plasmids with SSTR2 were identified using colony PCR; C: The recombinant plasmid was identified by double digestion of XhoI and BamHI.
2.2 SSTR2-GFP-HEK293稳转细胞株的鉴定用荧光显微镜观察转染了重组质粒SSTR2-pEGFP-N3以及对照组pEGFP-N3质粒24 h后的HEK293细胞。过表达SSTR2的实验组细胞的绿色荧光在细胞膜上均匀分布,符合该受体的分布情况,而对照组细胞的绿色荧光则分散于整个细胞质中(Fig 2A)。Western blot结果显示SSTR2-GFP-HEK293稳转细胞成功表达了SSTR2与GFP标签的融合蛋白(Fig 2B)。qPCR结果也显示相比于对照组,在SSTR2-GFP-HEK293稳转细胞中SSTR2基因mRNA水平明显上调,进一步表明该稳转细胞株成功表达了SSTR2基因。
2.3 钙流检测模型的建立基于文献调研,初步建立了钙流筛选体系。为验证该体系的可行性,使用了阳性药离子霉素(Ionomycin)。离子霉素是一种离子载体,对Ca2+有很好的亲和力,不仅可以使其从胞外进入胞内,还能促进其从胞内的库释放到细胞溶质内。实验结果表明离子霉素可以显著的升高细胞内的钙信号值,而溶剂对照组则几乎没有钙流信号的变化(Fig 3A),表明该体系能有效地检测到细胞内的钙流信号变化。在确定体系可行性后,对SSTR2-GFP-HEK293细胞模型有效性进行鉴定。在离子霉素验证后的体系,将刺激药物换成SSTR2受体激动剂生长抑素制剂,以pEGFP-N3-HEK293细胞作为对照。结果显示实验组细胞在思他宁的刺激下会产生浓度依赖性的钙流信号增加,而对照组则未出现钙流信号变化(Fig 3B)。
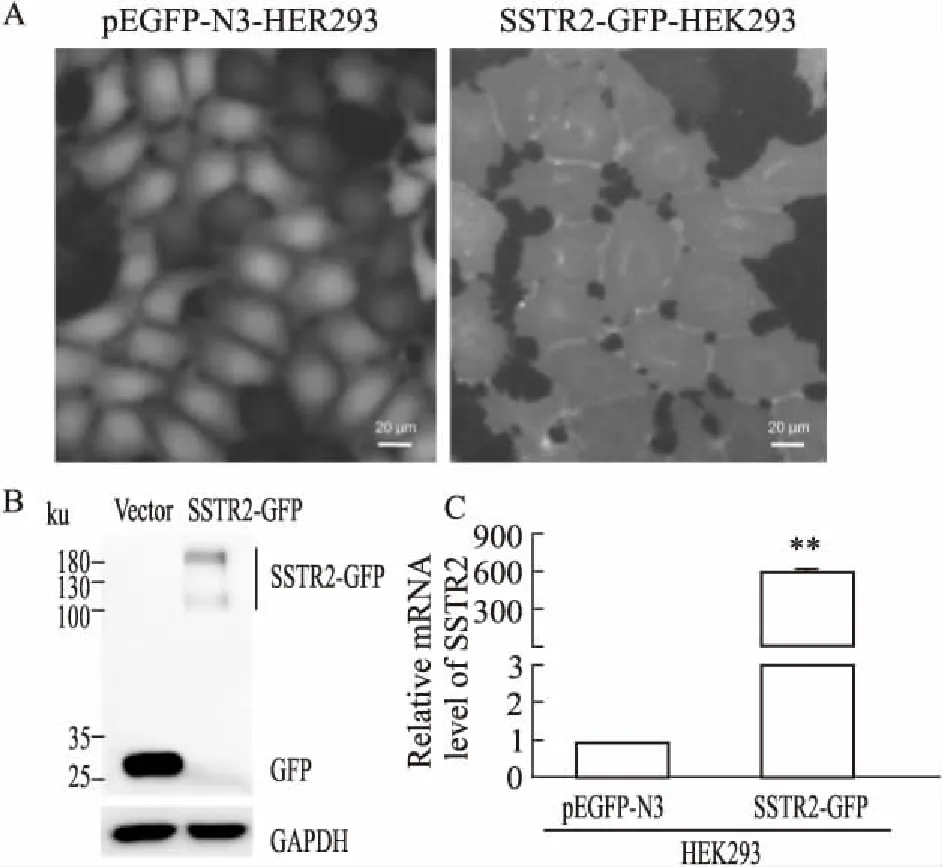
Fig 2 Identification of stable cell lines
2.4 钙流检测体系的优化将钙流信号以ΔRFU表示,结果显示当细胞个数为30 000/孔时ΔRFU值与本底有统计学差异(P<0.05),所以最终确定每孔30 000个细胞运用于接下来的检测体系中(Fig 3C)。在对荧光指示剂Fluo-4/AM浓度进行优化时,发现ΔRFU随着指示剂的浓度增加而增加。为了获得相对较大的ΔRFU值,以及考虑到后期做大量筛选的成本问题,选用了3 μmol·L-1的Fluo-4/AM作为后期筛选的工作浓度(Fig 3D)。优化荧光指示剂孵育时间结果显示,当孵育45 min时,ΔRFU显著增加(P<0.01),就算进一步延长孵育时间也不能更有效的提高ΔRFU,为了后期筛选工作的高效及迅速,确定荧光指示剂的孵育时间为45 min(Fig 3E)。
2.5 SSTR2-GFP-HEK293细胞筛选模型的应用对3个批次(批号分别为AU021084、AU022158、AU020854)的生长抑素制剂思他宁进行检测,EC50值分别为51.37 pmol·L-1、81.14 pmol·L-1、56.80 pmol·L-1(Fig 3F)。结果表明,不同批次的思他宁EC50值接近,符合已上市药生产规范,同时也表明该检测体系的稳定有效性。
3 讨论
SST及SSTA已被临床应用于治疗多种人类疾病,如促肾上腺皮质激素过量引起的库欣综合征,生长激素过度释放导致的肢端肥大症,以及消化道出血等。研究表明相对于该受体家族的其它成员,SSTR2的分布最为广泛,尤其是在一些肿瘤组织中[3]。SSTR2与癌症治疗相关的研究逐年增加,该受体在多种癌细胞及肿瘤血管中异常表达[11-12]。当体内受体被激活时会产生抑制激素分泌和细胞增殖的效应,该效应与癌症的发生发展密切相关。SSTA目前已被开发为抗肿瘤的辅助药物,部分长效制剂甚至直接发挥抗肿瘤作用,如奥曲肽[13]。开发作用时间长、疗效好的SSTRs激动剂和SSTA,不仅为消化道出血、急性胰腺炎以及肢端肥大症等疾病提供更多的用药选择,同时也可作为癌症治疗的一种新策略。本研究选择建立靶向于SSTR2的体外筛选模型,便于筛选出特异性靶向该受体的激动剂及类似物。
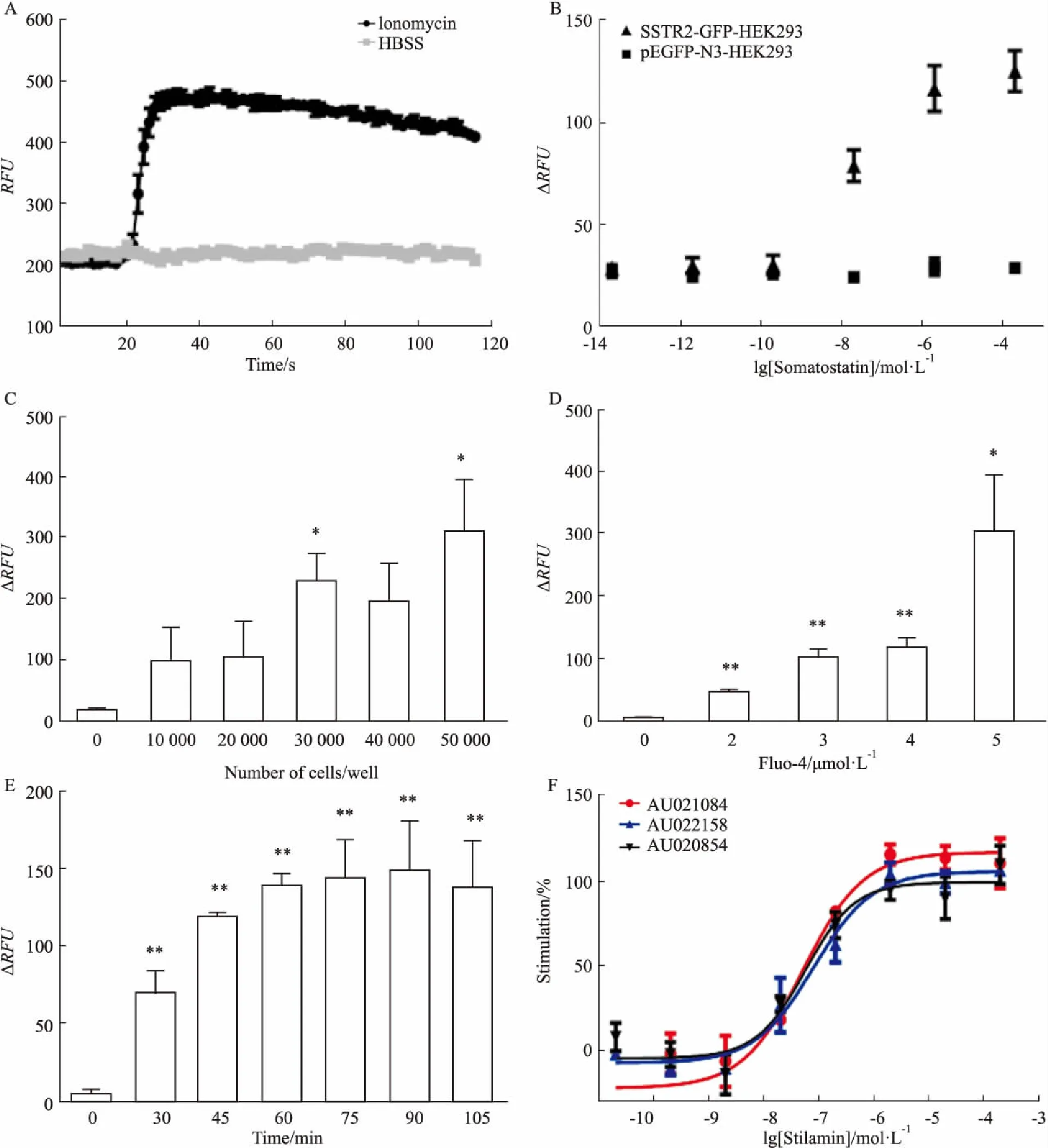
Fig 3 Optimization and application of calcium flow detection system
配体与受体的结合会使体内的第二信使产生一系列的生理变化,常见的第二信使有cAMP、cGMP、Ca2+等。本研究前期有检测过cGMP的信号变化,发现该模型在生长抑素制剂思他宁的作用下,cGMP的信号难以检测到。对比通过钙流的方式检测体内Ca2+的信号变化,钙流检测方法更为敏感,易于检测。
本研究建立的细胞筛选模型,从检测细胞的数量、荧光指示剂的浓度,以及指示剂孵育的时间等方面对钙流检测体系进行了优化。确定30 000个细胞每孔,Fluo-4/AM指示剂浓度为3 μmol·L-1,孵育时间为45 min相对适宜的检测条件,为后续该筛选模型的应用奠定了基础。
以SSTR2为靶点的筛选模型的建立,不仅可以为寻找新的SSTR2激动剂及SSTA提供有效的方法,同时也适用于新药研发过程中对未上市药进行体外药效评估及产品质量控制。
(致谢:本实验在中山大学药学院的新药成药性评估与评价国家地方联合工程实验室完成,在此对给予实验帮助的老师和同学表示感谢。)