槲皮素对Aβ25-35致PC12细胞损伤的雌激素样保护作用及分子机制
王 翠,郭童林,沈丽霞
(河北北方学院药学系,河北省神经药理学重点实验室,河北 张家口 075000)
阿尔茨海默病(Alzheimer’s disease,AD)是一种起病隐匿、进行性发展的神经退行性疾病。AD的病因和发病非常复杂,至今仍未明确,淀粉级联假说认为,β淀粉样蛋白(β-amyloid,Aβ)在大脑皮层的堆积是AD早期病理发生的关键,并最终导致AD其它的病理表现[1]。此外,Aβ的沉积是tau蛋白病变的上游机制,在Aβ引起的级联反应下游,tau蛋白代谢异常是引起神经元功能退化,甚至凋亡的重要原因之一[2]。其中,糖原合成酶激酶-3β(glycogen snythase kinase 3β,GSK-3β)是主要的tau蛋白激酶,并且与tau蛋白的异常磷酸化联系最为密切,参与机体多个细胞信号转导通路,是PI3K/Akt信号通路的下游分子[3]。PI3K/Akt信号通路具有磷酸化GSK-3αSer-21、GSK-3βSer-9的作用,磷酸化GSK-3β可以引起促细胞存活基因的表达,从而促进细胞存活[4]。近年来研究表明,雌激素不仅调节生殖系统的生长发育,而且参与AD的病理生理过程,发挥着重要的神经保护作用[5]。雌激素不仅能够调节基因转录,也能与细胞膜上的雌激素受体(estrogen receptor,ER)、G蛋白偶联受体30结合,激活PI3K和MAPK信号通路[6]。因此,GSK-3β以及相关的PI3K/Akt信号通路已成为以tau蛋白病理学为特征的神经退行性疾病的早期诊断和治疗的重要靶点。
为避免雌激素长期应用引起的不良反应,植物雌激素受到广泛关注。许多研究显示,植物雌激素能与细胞膜及细胞核内的ER结合,发挥神经保护、抗氧化和抗凋亡作用[7-8]。课题组以往的实验证实,槲皮素(quercetin,Que)对原代培养的初生大鼠海马和皮层神经元具有雌激素样保护作用。本实验以Aβ25-35诱导PC12细胞损伤为模型,通过ER介导的相关信号转导通路,探讨槲皮素雌激素样保护作用的分子机制,进而探索植物雌激素替代雌激素作为AD治疗性药物的可行性。
1 材料与方法
1.1 材料
1.1.1细胞株 大鼠肾上腺嗜铬细胞瘤细胞(PC12,高分化型),购自中国科学院典型培养物保藏中心昆明细胞库。
1.1.2药物与试剂 槲皮素(纯度98%,批号:100081-200907)、金雀异黄素(纯度99.1%,批号:111704-201302),均购自中国药品生物制品检定研究院;17β-雌二醇(Abcam公司,批号:APN11282-1-1);Aβ25-35(Sigma公司,批号:A4559);ER拮抗剂ICI182,780(Abcam公司,批号ab120131);DMEM高糖培养基(HyClone公司,批号:SH30284.01);四季青无噬菌体低内毒素特级胎牛血清(浙江天杭科技公司,批号:11011-8611);MTT(Biosharp生物科技公司,批号:BS030A);β-actin抗体(Santa Cruz公司,批号:SC47778);抗体ERα(批号:ab32063)、ERβ(批号:ab3576)、p-Akt(Ser473)(批号:ab81283)、total-Akt(批号:ab32505),均购自Abcam公司;抗体p-GSK-3β(Ser9)(批号:5558S);GSK-3β(批号:12456T),购自CST公司;IRDye 680RD羊抗鼠二抗(批号:926-68170)、IRDye 800CW羊抗兔二抗(批号:827-08365),均购自Odyssey公司;Alexa Fluor®594羊抗兔二抗(Abcam公司,批号:ab150080)。
1.1.3仪器 CO2培养箱(Thermo公司);倒置显微镜(Nikon公司);超速冷冻离心机(Sigma公司);Cytation5细胞成像微孔板检测仪(BioTek公司);Odyssey CLy红外荧光扫描成像系统(LI-COR公司);FV3000共聚焦激光扫描显微镜(OLYMPUS公司)。
1.2 方法
1.2.1细胞培养 PC12细胞用无酚红的DMEM高糖培养基(含10%胎牛血清、100 kU·L-1青霉素、0.1 g·L-1的链霉素),置于37 ℃、5% CO2培养箱中培养,每2~3 d传代1次。
1.2.2MTT法检测细胞存活率
1.2.2.1Aβ25-35致PC12细胞损伤模型的建立 将细胞以8×107·L-1的密度接种于96孔板中,每孔100 μL培养液,细胞培养24 h后,吸出培养基,加入不同浓度的Aβ25-35(终浓度1、5、10、20、30 μmol·L-1)继续培养24 h,每组设4个复孔。
1.2.2.2不同浓度Que对PC12细胞的影响 实验分为正常对照组、Que组(终浓度1.25、2.5、5、10、20、40、50、60、80、100、200 μmol·L-1),加药培养24 h,每组设4个复孔。
1.2.2.3不同药物对细胞损伤模型的影响 本课题组及其他研究结果均已证实[9-10],17β-雌二醇(17β-estradiol,17β-E2)与金雀异黄素(genistein,Gen)均可以对Aβ25-35诱导的PC12细胞损伤起到保护作用。因此,本实验选择17β-E2与Gen作为阳性对照药。实验分组为:正常对照组、模型组(Aβ25-3520 μmol·L-1)、17β-E2 0.1 μmol·L-1组、Gen 50 μmol·L-1组、Que组(40、60、80 μmol·L-1),MTT法检测细胞存活率。同时,设置ER拮抗剂ICI182,780组,将终浓度为1 μmol·L-1的ICI182,780在培养箱中预孵育1 h,然后弃去培养基,按照正常对照组、Aβ25-35组、Que组、ICI组、ICI+Que组分别给药。
1.2.3细胞免疫荧光染色检测ERα和ERβ的表达 取对数期细胞,以2×108·L-1的密度接种到激光共聚焦专用的细胞培养皿中,按照“1.2.2.3”的分组分别加药培养24 h后,弃去含药培养基,依次用4%多聚甲醛室温固定15 min,0.1% TritonX-100透化液室温下处理细胞10 min,5%牛血清白蛋白室温作用细胞2 h,分别加入一抗ERα(1 ∶200)、ERβ(1 ∶200)4 ℃过夜,根据一抗性质加入Cy3标记的山羊抗兔二抗(1 ∶500,PBST稀释),室温避光孵育1 h,滴加DAPI染色液避光作用15 min,对细胞核进行复染,激光共聚焦显微镜下观察,采集图像,使用Image-Pro Plus6.0软件分析结果,实验重复3次。
1.2.4Western blot检测相关蛋白的表达 将细胞以6×108·L-1的密度,每皿加入6 mL细胞悬液,按照“1.2.2.3”的分组分别作用PC12细胞24 h,收集细胞,加入裂解液,冰上裂解30 min后,4 ℃、12 000 r·min-1离心30 min,吸取上清,BCA法测定蛋白含量,95 ℃蛋白变性10 min。确保蛋白上样量在30 μg以上,采用10% SDS-PAGE凝胶电泳分离蛋白,转膜,5%脱脂奶粉室温摇床封闭2 h,加入一抗β-actin、ERα和ERβ(1 ∶500)、p-Akt(1 ∶1 000)、total-Akt(1 ∶2 000)、p-GSK-3β(1 ∶500)、total-GSK-3β(1 ∶1 000),4 ℃孵育过夜,TBST洗膜4次,每次5 min,室温摇床孵育荧光二抗1 h(1 ∶15 000),TBST洗膜4次,每次5 min,红外荧光扫描成像系统检测分析条带灰度值。

2 结果
2.1 Aβ25-35致PC12细胞损伤模型的鉴定Fig 1的MTT结果显示,Aβ25-35(1、5、10、20、30 μmol·L-1)作用细胞24 h,细胞存活率逐渐降低,与浓度呈正相关,表明细胞的增殖受到明显抑制,与对照组相比差异有统计学意义(P<0.05)。Aβ25-35作用PC12细胞24 h的半数致死浓度(IC50)为27.34 μmol·L-1,故选择20 μmol·L-1的Aβ25-35作用PC12细胞24 h,建立AD体外细胞损伤模型。
2.2 槲皮素对Aβ25-35致PC12细胞损伤模型的影响本课题组前期研究结果表明,槲皮素浓度低于80 μmol·L-1时不会对细胞造成毒性损伤,故选择槲皮素(40、60、80 μmol·L-1)用于后续实验。大量实验结果均表明,17β-雌二醇和金雀异黄素通过ER参与并激活其它信号途径,发挥神经保护作用,故选择其为阳性对照药,MTT结果显示,0.1 μmol·L-1的17β-E2和50 μmol·L-1Gen与Aβ25-35共同作用细胞的存活率最高,故用于后续实验中的阳性对照药给药剂量。低、中、高浓度的槲皮素与Aβ25-35共同作用细胞24 h后,17β-E2(0.1 μmol·L-1)组、Gen(50 μmol·L-1)组、Que(40、60、80 μmol·L-1)组与模型组相比,细胞存活率均明显升高(P<0.05),表明槲皮素可以保护Aβ25-35诱导的PC12细胞损伤(Fig 2A)。为进一步探讨这种保护作用是否通过ER发挥作用,同时加入ICI182,780(1 μmol·L-1),结果发现,Que(60 μmol·L-1)组细胞的存活率明显高于模型组(P<0.01),Aβ+Que+ICI组与Aβ+Que组相比,能明显抑制细胞的存活率(P<0.01),表明槲皮素对细胞的保护作用可被ER拮抗剂ICI182,780所拮抗(Fig 2B)。
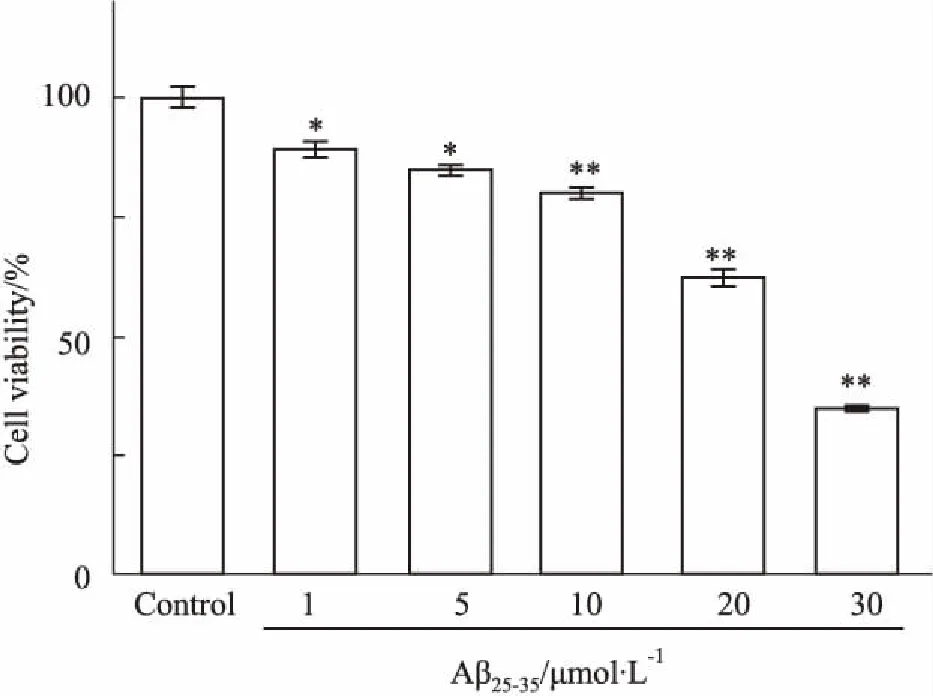
Fig 1 Effect of Aβ25-35 on viability of PC12 cells n=4)
*P<0.05,**P<0.01vscontrol
2.3 细胞免疫荧光染色检测ER表达免疫荧光染色结果表明(Fig 3),与对照组相比,模型组ERα蛋白表达的荧光强度明显减弱(P<0.01);与模型组相比,17β-E2组、Gen组、Que(40、60、80 μmol·L-1)组中,ERα蛋白表达的荧光强度明显增加(P<0.01)。各组ERβ蛋白与模型组相比荧光强度均有所增加,但差异无显著性(P>0.05),见Fig 4。
2.4 槲皮素对Aβ25-35致PC12细胞相关蛋白表达的影响Fig 5、6结果表明,与对照组相比,模型组ERα、p-Akt、p-GSK-3β蛋白的表达均明显降低(P<0.01);阳性药物17β-E2组、Gen组和Que组均明显上调了上述3种蛋白的表达量(P<0.01),而模型组和不同给药组对ERβ、total-Akt和total-GSK-3β蛋白表达的影响并不明显(P>0.05)。
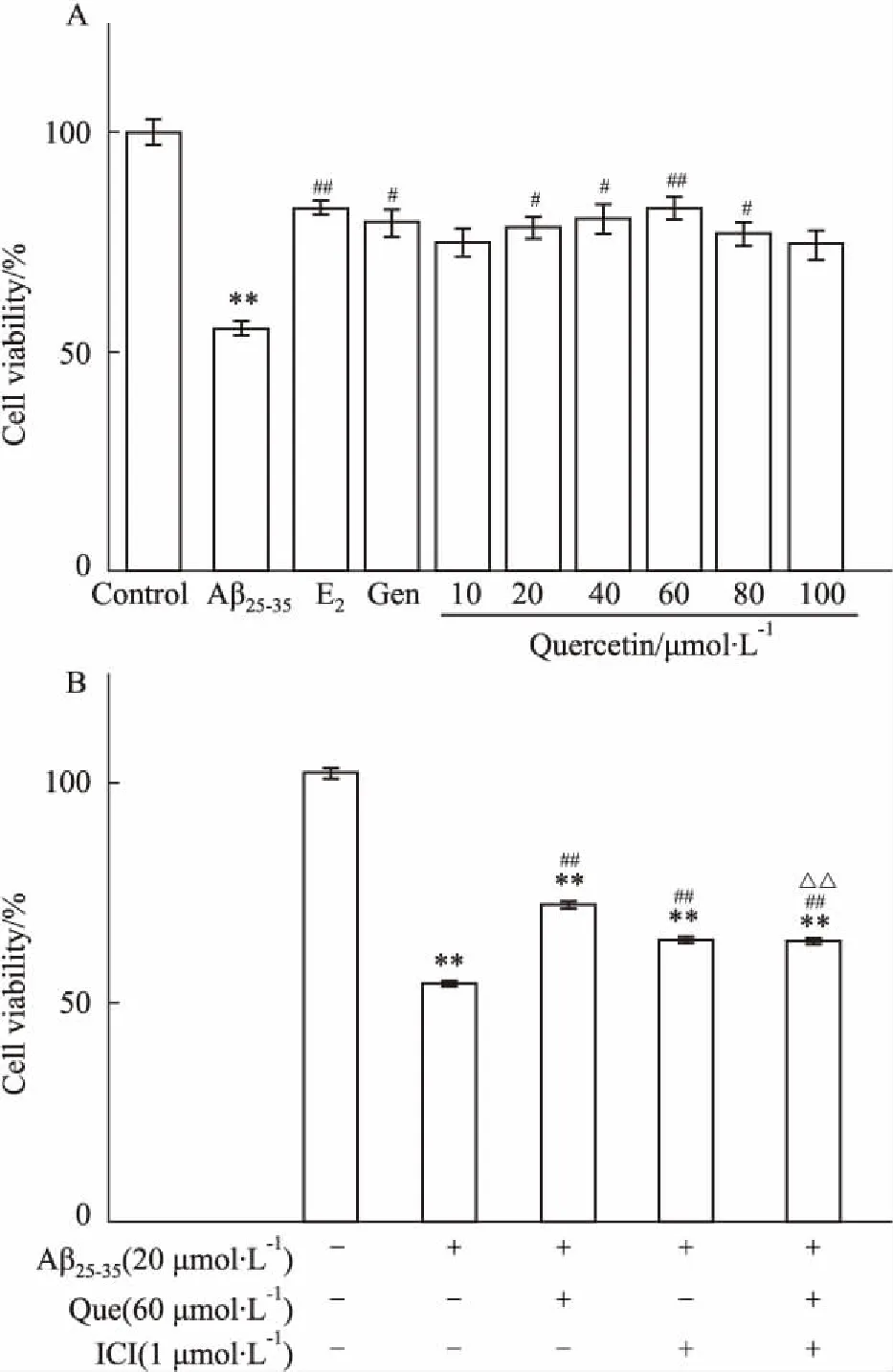
Fig 2 Effect of quercetin on PC12 cells
A: Effect of different concentrations of quercetin on PC12 cells viability induced by Aβ25-35; B: Effect of quercetin on PC12 cells viability induced by ICI182,780.**P<0.01vscontrol;#P<0.05,##P<0.01vsAβ25-35;△△P<0.01vsAβ25-35+Que.
2.5 槲皮素与ICI182,780共同孵育后相关蛋白表达的变化如Fig 7所示,与对照组相比,各实验组total-Akt和total-GSK-3β蛋白表达基本无变化(P>0.05)。Aβ+Que组与模型组相比,p-Akt、p-GSK-3β蛋白水平明显升高(P<0.01);而Aβ+Que+ICI与Aβ+Que组相比,p-Akt、p-GSK-3β蛋白水平明显降低(P<0.01)。提示槲皮素上调上述蛋白水平的作用可被ER抑制剂所拮抗。
3 讨论
迄今为止,AD的病因和发病机制仍未完全阐明,普遍被认可的发病机制是β-淀粉样蛋白学说。研究认为,Aβ沉积是AD发病的中心环节,Aβ的神经毒性是多种因素导致AD发病的共同通路[11-12]。PC12细胞广泛用于神经药理学的体外实验研究,受神经生长因子(nerve growth factor,NGF)处理时间长短或剂量大小影响,当PC12细胞处于未分化状态,或NGF处理时间短或剂量小时,不表达ER蛋白,故本课题组选用高分化状态的PC12细胞用于AD体外模型的研究。本实验结果表明, 20 μmol·L-1的Aβ25-35作用PC12细胞24 h时,细胞活力明显降低,因此,用于建立AD体外损伤模型,探讨槲皮素对AD发挥雌激素样保护作用的分子机制。
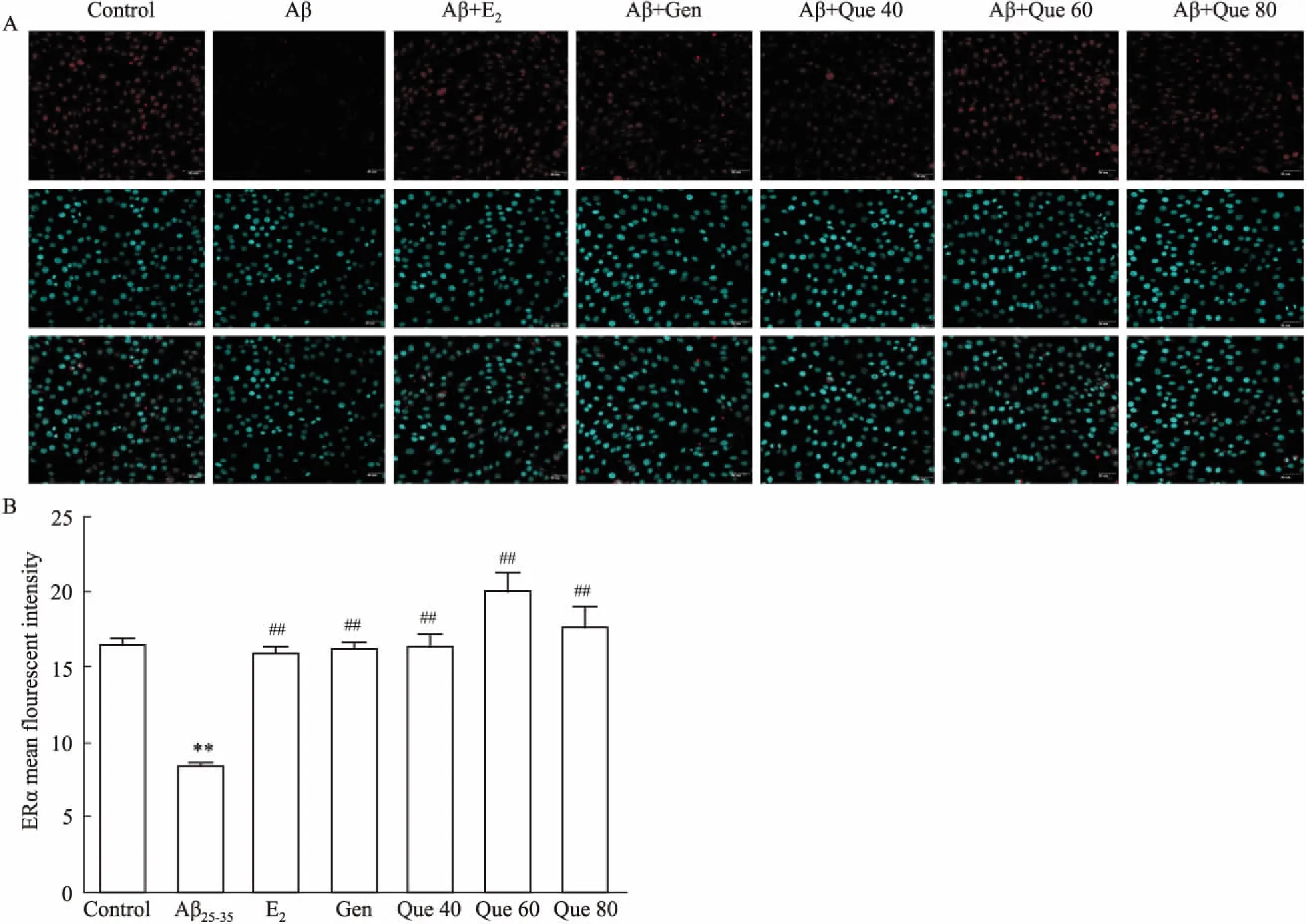
Fig 3 ERα expression by immunofluorescence staining(×400)
A: Immunofluorescence staining of positive ERα protein; B: ERα mean fluorescent intensity.**P<0.01vscontrol;##P<0.01vsAβ25-35.
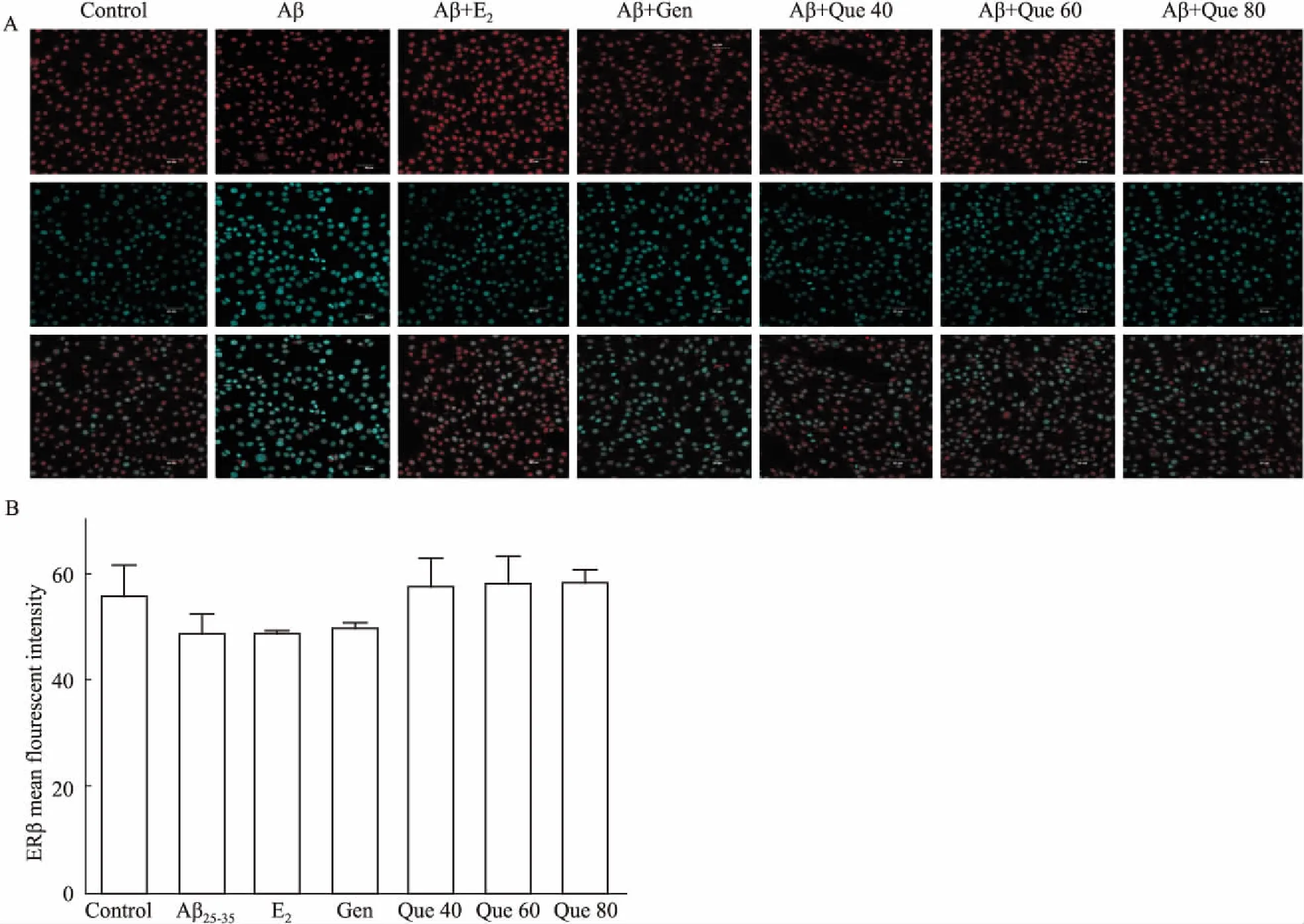
Fig 4 ERβ expression by immunofluorescence staining(×400)
A: Immunofluorescence staining of positive ERβ protein; B: ERβ mean fluorescent intensity.
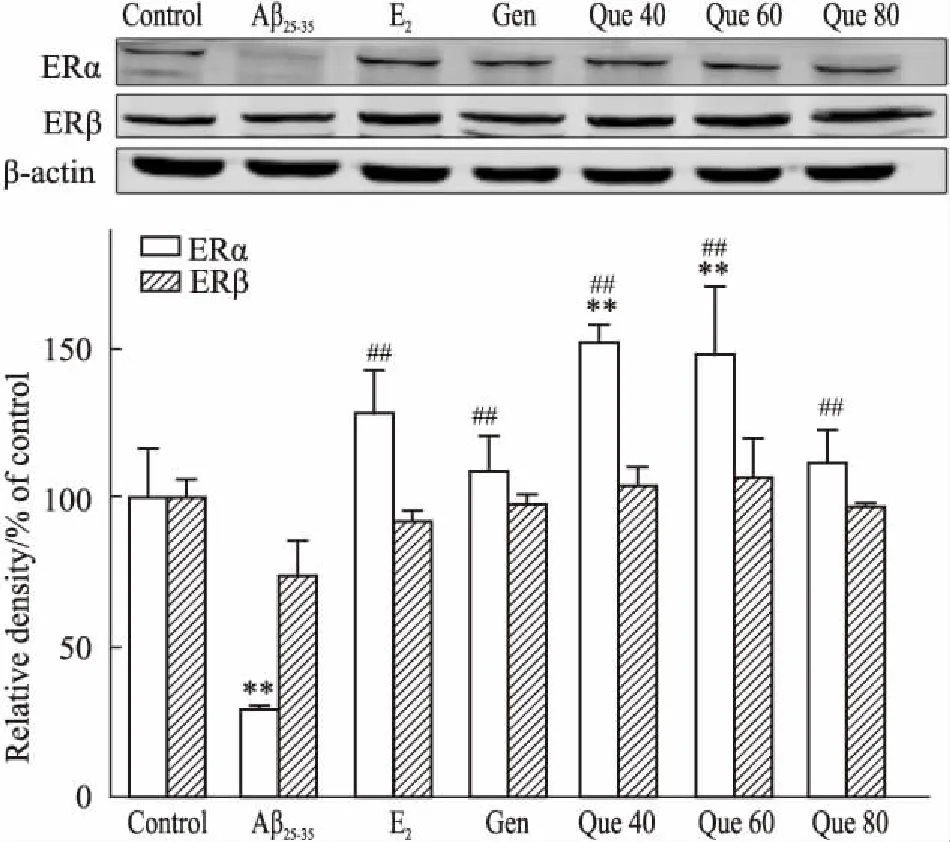
Fig 5 Effects of quercetin on ERα, ERβ protein expression in PC12 cells induced by Aβ25-35 n=3)
**P<0.01vscontrol;##P<0.01vsAβ25-35
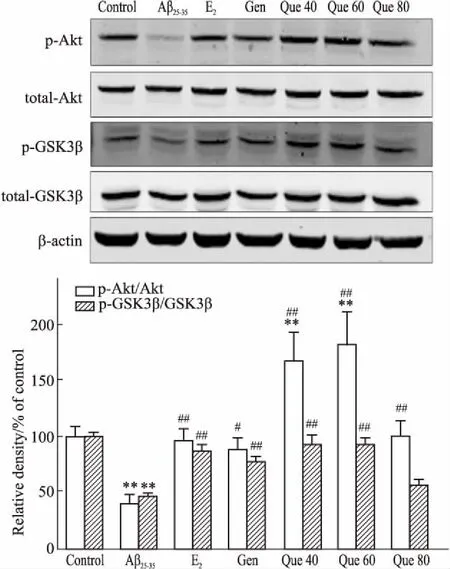
Fig 6 Effects of quercetin on expression of p-Akt, p-GSK-3β in PC12 cells induced by Aβ25-35 n=3)
**P<0.01vscontrol;#P<0.05,##P<0.01vsAβ25-35
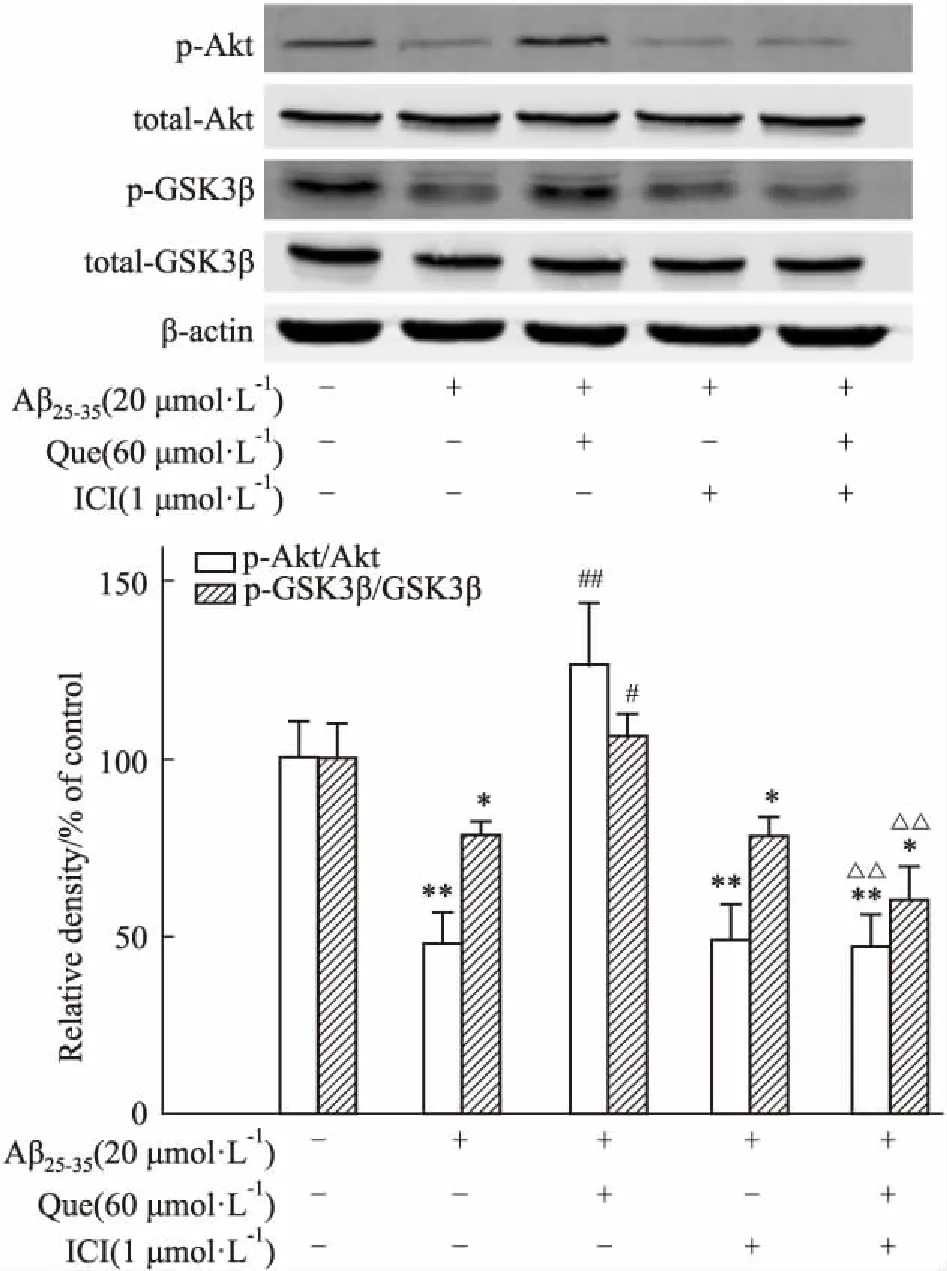
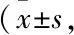
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsAβ25-35;△△P<0.01vsAβ25-35+Que
本实验用Aβ25-35诱导PC12细胞24 h后,MTT法检测细胞活力,结果显示,与模型组相比,槲皮素药物组与17β-雌二醇、金雀异黄素阳性药物组类似,在一定剂量范围内可以提高PC12细胞活性,初步验证了槲皮素的神经保护作用。为探讨槲皮素神经保护效应与ER的关系,使用ER完全拮抗剂ICI182,780,其能够阻断雌激素类物质通过ER介导的生物学活性。MTT结果表明,加入抑制剂预孵育细胞后,槲皮素对细胞的保护作用受到明显抑制。而细胞免疫荧光和Western blot的结果也发现,槲皮素可以明显提高ERα蛋白的表达,对于ERβ蛋白,槲皮素和模型组的蛋白表达量之间差异无显著性;当加入ICI182,780时,槲皮素的神经保护作用减弱,表明槲皮素具有一定的雌激素样作用,且可能是由ERα介导的。
植物雌激素同雌激素类似,除了在基因组作用下,与位于细胞质和细胞核上的ER结合,与目标基因启动子上的雌激素反应元件(estrogen response element,ERE)结合发挥效应,还能与膜上ER结合,通过第二信使,激活一系列信号通路,间接调节基因转录,可以在几秒到几分钟内产生快速的生物学效应[13]。本研究表明,槲皮素不仅通过与ERα结合发挥雌激素样神经保护作用,还可快速激活细胞内PI3K/Akt/GSK-3β信号转导通路。Western blot结果显示,槲皮素药物组、17β-雌二醇和金雀异黄素阳性药物组p-Akt、p-GSK-3β蛋白表达量明显高于模型组。表明槲皮素可以拮抗Aβ25-35诱导的PC12细胞损伤,其机制为通过激活PI3K/Akt信号通路,抑制下游靶分子GSK-3β活性,发挥神经保护作用。为进一步探讨ER与PI3K/Akt信号通路的关系,使用工具药ICI182,780干预PC12细胞后,检测细胞中p-Akt、p-GSK-3β蛋白的表达,结果表明,当ICI182,780存在时,上述蛋白的表达均被明显抑制,表明槲皮素提高p-Akt、p-GSK-3β的表达可能有ER参与。因此,槲皮素通过经典的ER通路及PI3K/Akt/GSK-3β信号通路发挥保护作用,两种途径存在交叉和相互影响。
ER是核激素受体超家族成员,与DNA应答元件结合的配体依赖型转录调控因子。经典的ER包含ERα和ERβ两种亚型。有研究表明,植物雌激素具有类雌激素和/或抗雌激素活性的双向作用,不同类型的植物雌激素与ER结合的亲和力不同而表现出不同的作用效能,金雀异黄素等对ERβ亲和力更强[14]。本课题组之前的研究结果发现,金雀异黄素和槲皮素可以通过ER促进MCF-7和T47D细胞的增殖,提高细胞分裂增殖指数,从而表现出雌激素样活性。我们前期的研究也证实,与其他植物雌激素不同的是,槲皮素对海马或皮层神经元的保护作用主要是通过ERα受体介导的。综上所述,通过雌激素耗竭条件下建立稳定的AD体外损伤模型,证实槲皮素具有雌激素样作用,对Aβ25-35诱导的PC12细胞的损伤具有保护作用,其通过经典的ER途径,影响PI3K/Akt/GSK-3β信号通路的激活。这也为我们后续对槲皮素是否通过抑制tau蛋白的过度磷酸化,发挥神经保护作用的分子机制研究奠定了理论基础,以期更好地发挥槲皮素此类植物雌激素在退行性神经疾病中的应用价值。