ERK1/2-Runx2信号通路在TNF-α对牙周膜干细胞成骨分化影响中的作用
韩耀伦 王 璐 马 欣
(河南省人民医院口腔科,郑州450000)
牙周病是口腔常见的炎症性疾病,临床治疗的难点为牙周组织的不可逆性丧失,其治疗的核心为牙周缺损骨质的修复,干细胞在骨质缺损修复中具有重要作用,尤其牙周膜干细胞[1]。骨质缺损修复受多种炎性因子影响,也受错综复杂的信号通路的调控[2]。研究表明肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)可抑制牙周膜干细胞的成骨分化[3];研究证实Runt相关转录因子2(Runt-related transcription factor 2,Runx2)是重要的成骨细胞特异性转录因子,在成骨分化中发挥重要作用[4];细胞外调节蛋白激酶1/2(Extracellular regulated protein kinase 1/2,ERK1/2)在细胞增殖和分化中具有重要作用,是细胞增殖分化的网络核心,Runx2为其下游靶基因重要成员,转录水平受ERK1/2信号通路调控[5]。 ERK1/2-Runx2通路是否在TNF-α抑制牙周膜干细胞成骨分化中发挥作用尚不清楚。本文将对其进行研究,为临床提供依据。
1 材料与方法
1.1材料
1.1.1牙周膜标本来源 牙周膜标本来自我院口腔科门诊18例正畸治疗患者拔出的40颗第一或第二前磨牙,患者近期无急性感染、无牙体及根尖周疾病、无全身系统性疾病、无慢性感染性疾病、无吸烟和特殊药物服用史,标本取样前经患者知情同意。
1.1.2主要试剂 胎牛血清、PBS、α-MEM培养基、胰蛋白酶、Ⅰ型胶原酶(美国HyClone公司),表皮生长因子(Epidermal growth factor,EGF)、茜素红粉剂、TNF-α等(美国Worthington公司),鼠抗人APC标记的CD31和CD45单抗、FITC标记的CD90单抗、PE标记的CD105单抗(美国eBioscience公司),碱性磷酸酶(ALP)试剂盒、逆转录-聚合酶链免疫反应(Reverse transcription-polymerase chain immuno-reaction,RT-PCR)试剂盒(美国Sigma公司),锌指结构转录因子(Zinc finger structure transcription factor,Osterix)、骨桥蛋白(Osteopontin,OPN)、ERK1/2、p-ERK1/2、Runx2、β-actin等抗体(美国Invitrogen公司)。
1.2方法
1.2.1牙周膜干细胞分离和培养 将患者[年龄(24.16±4.21)岁,男性6例,女性12例]正畸拔除的前磨牙拔除后,放入α-MEM细胞培养液(含3倍双抗)中,由冠向根部刮取根中1/3牙周膜,将刮取的组织块剪成约1 mm3,1 000 r/min离心5 min,Ⅰ 型胶原酶消化,加入培养液终止消化,离心后弃上清液,加入适量培养液,接种到培养皿中培养,待细胞从组织块中爬出并达80%~90%融合时进行传代培养。
1.2.2牙周膜干细胞鉴定 取传代培养第4代细胞,胰蛋白酶消化后离心,用PBS液重悬,将细胞密度调整为2×106个/ml,分别加入鼠抗人APC标记的CD31和CD45、FITC标记的CD90、PE标记的CD105单抗,空白对照不加,孵育20 min后采用流式细胞仪检测细胞表面标记物。
1.2.3实验分组及处理 将生长良好的第3代牙周膜干细胞分为对照组、TNF-α组和激动剂组,对照组加入成骨诱导液(含0.1 μmol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 μg/ml维生素C)[6]培养;TNF-α组在成骨诱导液中加入TNF-α(10 ng/ml)[6]培养;激动剂组在成骨诱导液中加入TNF-α(10 ng/ml)和ERK通路激动剂EGF(30 ng/ml)[7]培养。将细胞经胰蛋白酶消化后制备成细胞悬液,调整细胞密度为2×104个/ml,接种到6孔板中,每组设7个复孔,培养至细胞达70%融合后更换为各组含相应成分的成骨诱导液,每3天换液1次。
1.2.4ALP染色及活性测定 ①ALP染色:将上述3组细胞接种到6孔板中加入相应成分的成骨诱导液成骨诱导1周后,弃去培养液,PBS洗涤,多聚甲醛固定1 h,PBS洗涤,加入BCIP/NBT工作液孵育30 min,PBS洗涤,显微镜下拍照观察染色情况。②ALP活性测定:将生长良好的第3代牙周膜干细胞制备成细胞悬液,每孔1 000个细胞接种到96孔板中,MEM培养基培养24 h后换成成骨诱导液,3 d换液,7 d弃去培养液,PBS洗涤,加入0.2% Triton X-100孵育30 min,显微镜下观察细胞情况,每孔加入ALP基质液和含有p-硝基苯磷酸的碳酸盐缓冲液孵育30 min,加入显色液,酶联免疫检测仪测定波长520 nm处吸光值,每组7个孔,取平均值。
1.2.5茜素红染色定量 将上述3组细胞接种到6孔板中加入相应成分的成骨诱导液成骨诱导3周后,吸出培养液,PBS洗涤,多聚甲醛固定30 min,PBS洗涤,加入茜素红染色液孵育30 min,PBS洗涤,显微镜下拍照观察染色情况。拍照后每孔加入氯化十六烷吡啶孵育15 min,移入96孔板,酶联免疫检测波长540 nm处吸光度值。钙化结节值=目标组吸光度值/对照组吸光度值。
1.2.6牙周膜干细胞Osterix、OPN、ERK1/2、p-ERK1/2、Runx2蛋白水平测定 采用Western blot测定牙周膜干细胞Osterix、OPN、ERK1/2、p-ERK1/2、Runx2蛋白水平。将上述3组细胞接种到6孔板中加入相应成分的成骨诱导液成骨诱导1周后,提取各组细胞总蛋白,测定各组总蛋白浓度,加入上样缓冲液上样,制备SDS-PAGE胶,进行电泳、转膜、脱脂奶粉封闭、洗膜,加入一抗过夜孵育,加入二抗孵育2 h,加入ECL发光剂,BioRad图像分析系统分析牙周膜干细胞Osterix、OPN、ERK1/2、p-ERK1/2、Runx2蛋白水平,目标蛋白水平=目标蛋白条带灰度值/β-actin条带灰度值。

2 结果
2.1牙周膜干细胞分离培养 原代培养第3天,可见细胞从牙周膜组织块边缘爬出(黑色为组织块,浅色区域为爬出细胞),培养第8天时,牙周膜组织周围细胞达80%~90%融合时进行传代,细胞传代至第3代时,细胞生长良好、形态单一、轮廓清晰,呈长梭形。见图1。
2.2牙周膜干细胞鉴定 流式细胞仪鉴定结果显示:CD90阳性率为94.23%,CD105阳性率为91.15%,CD31阳性率为0.46%,CD45阳性率为0.53%。表明培养细胞为牙周膜干细胞[8]。见图2。
2.33组牙周膜干细胞ALP和茜素红染色情况 ①ALP染色情况:与对照组比较,TNF-α组染色程度低,激动剂组染色程度介于两者之间。②茜素红染色情况:3组细胞中均见红褐色矿化结节,与对照组比较,TNF-α组染色浅、数量少、面积小,激动剂组染色介于对照组和TNF-α组之间,见图3、4。3组细胞ALP活性和矿化结节定量比较:与对照组比较,TNF-α组和激动剂组ALP活性和矿化结节降低(P<0.05),与TNF-α组比较,激动剂组ALP活性和矿化结节升高(P<0.05)。见表1。
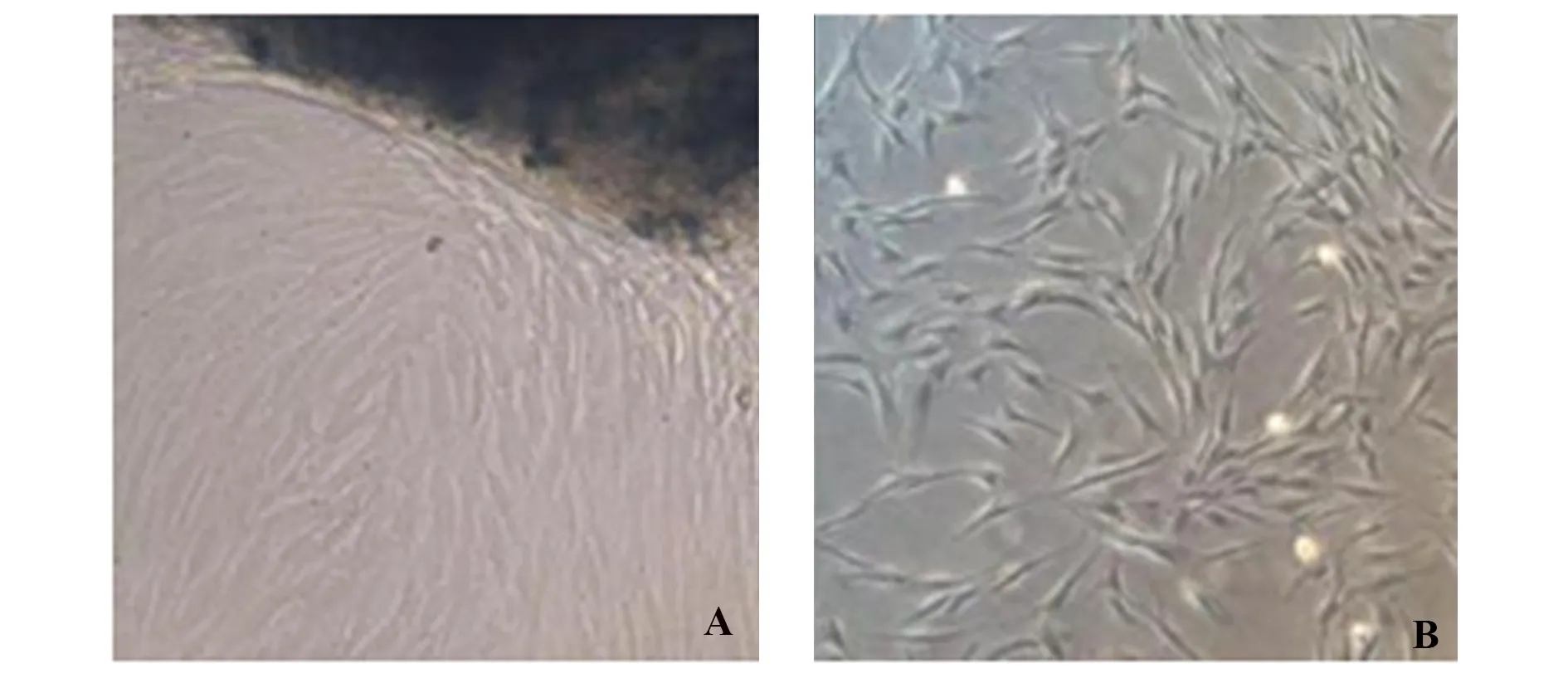
图1 牙周膜干细胞原代和第3代细胞形态(×100)Fig.1 Primary and third-generation cell morphology of periodontal ligament stem cells (×100)Note: A.The third day of primary culture;B.The third generation of passage.
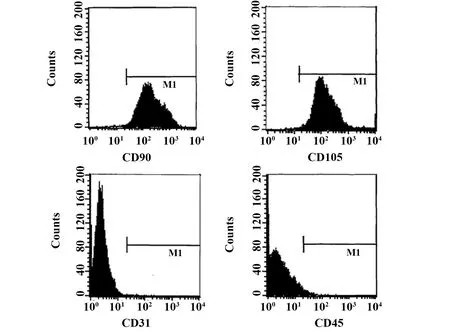
图2 流式细胞仪鉴定牙周膜干细胞表面标记物Fig.2 Flow cytometry identifies surface markers of periodontal ligament stem cells
2.43组牙周膜干细胞Osterix和OPN蛋白水平比较 与对照组比较,TNF-α组和激动剂组Osterix和OPN蛋白水平降低(P<0.05),与TNF-α组比较,激动剂组Osterix和OPN蛋白水平升高(P<0.05)。见表2和图5、6。
2.53组牙周膜干细胞ERK1/2、p-ERK1/2、Runx2蛋白水平比较 3组牙周膜干细胞ERK1/2蛋白水平比较差异无统计学意义(P>0.05),与对照组比较,TNF-α组和激动剂组p-ERK1/2、Runx2蛋白水平降低(P<0.05),与TNF-α组比较,激动剂组p-ERK1/2、Runx2蛋白水平升高(P<0.05)。见表3和图7、8。

图3 3组牙周膜干细胞ALP染色Fig.3 Three groups of periodontal ligament stem cells ALP stainingNote: A.Control group;B.TNF-α group;C.Agonist group.

图4 3组牙周膜干细胞茜素红染色Fig.4 Three groups of periodontal ligament stem cells Alizarin red stainingNote: A.Control group;B.TNF-α group;C.Agonist group.
表1 3组牙周膜干细胞ALP活性和矿化结节比较(n=7)
Tab.1 Comparison of ALP activity and mineralized nodules in three groups of periodontal ligament stem cells (n=7)

GroupsALP activityMineralized nodules(%)Control group0.44±0.07100.02±6.57TNF-α group0.15±0.041)56.32±4.751)Agonist group0.36±0.051)2)87.46±5.381)2)F52.344112.283P<0.001<0.001
Note:Compared with the control group,1)P<0.05;compared with the TNF-α group,2)P<0.05.
表2 3组牙周膜干细胞Osterix和OPN蛋白水平比较(n=7)
Tab.2 Comparison of Osterix and OPN protein levels in three groups of periodontal ligament stem cells(n=7)

GroupsOsterix proteinOPN proteinControl group0.69±0.090.74±0.10TNF-α group0.18±0.051)0.22±0.071)Agonist group0.37±0.081)2)0.39±0.091)2)F82.06564.187P<0.001<0.001
Note:Compared with the control group,1)P<0.05;compared with the TNF-α group,2)P<0.05.

图5 3组牙周膜干细胞Osterix和OPN蛋白水平Western blot电泳图Fig.5 Western blot analysis of Osterix and OPN protein levels in three groups of periodontal ligament stem cellsNote: A.Control group;B.TNF-α group;C.Agonist group.
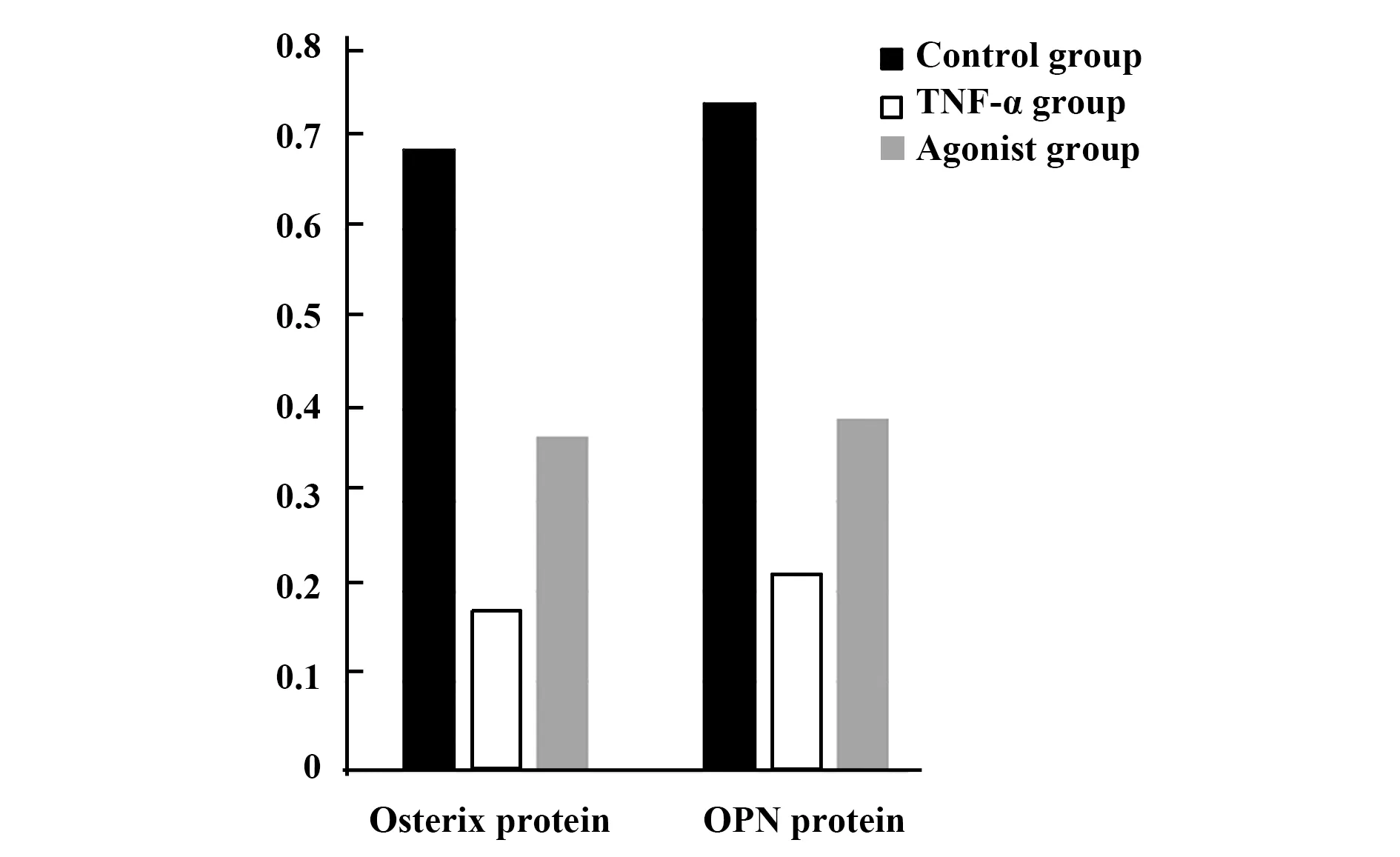
图6 3组牙周膜干细胞Osterix和OPN蛋白水平比较Fig.6 Comparison of Osterix and OPN protein levels in three groups of periodontal ligament stem cells
表3 3组牙周膜干细胞ERK1/2、p-ERK1/2、Runx2蛋白水平比较(n=7)
Tab.3 Comparison of ERK1/2,p-ERK1/2,Runx2 protein levels in three groups of periodontal ligament stem cells (n=7)
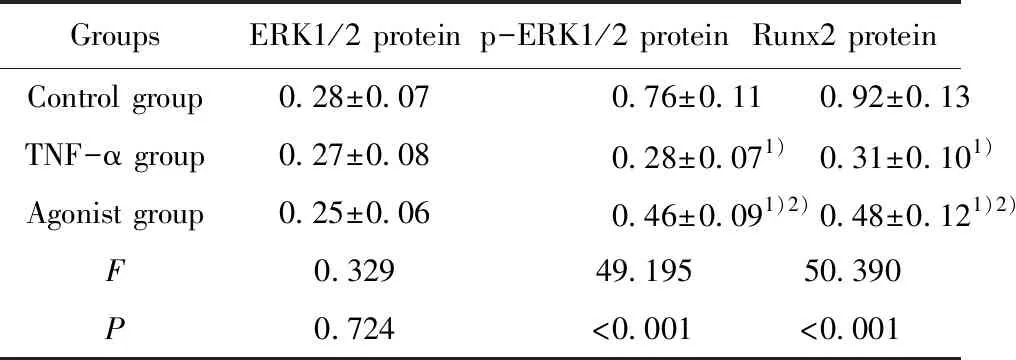
GroupsERK1/2 proteinp-ERK1/2 proteinRunx2 proteinControl group0.28±0.070.76±0.110.92±0.13TNF-α group0.27±0.080.28±0.071)0.31±0.101)Agonist group0.25±0.060.46±0.091)2)0.48±0.121)2)F0.32949.19550.390P0.724<0.001<0.001
Note:Compared with the control group,1)P<0.05;compared with the TNF-α group,2)P<0.05.
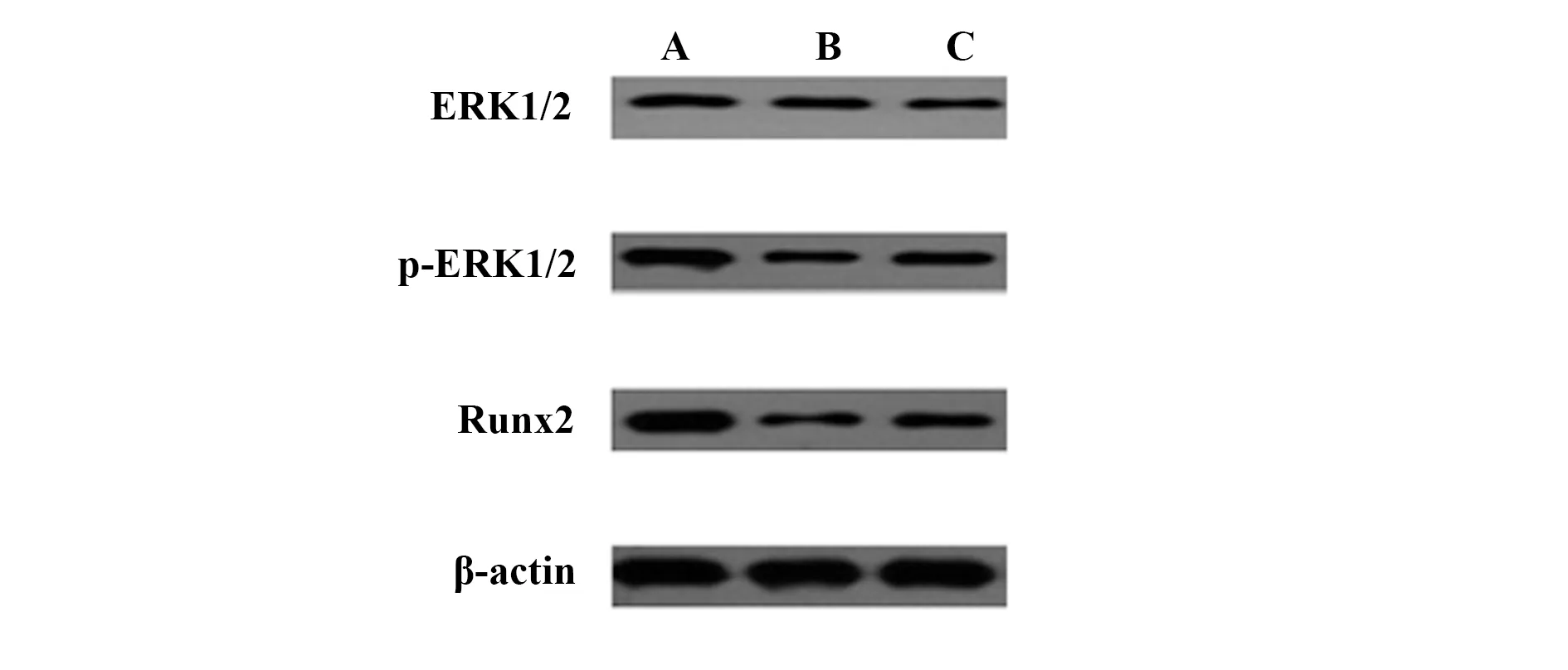
图7 3组牙周膜干细胞ERK1/2、p-ERK1/2、Runx2蛋白水平Western blot电泳图Fig.7 Western blot analysis of ERK1/2,p-ERK1/2 and Runx2 protein levels in three groups of periodontal ligament stem cellsNote: A.Control group;B.TNF-α group;C.Agonist group.
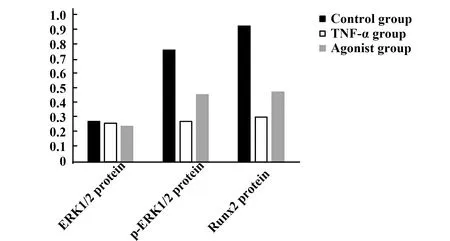
图8 3组牙周膜干细胞Osterix和OPN蛋白水平比较Fig.8 Comparison of Osterix and OPN protein levels in three groups of periodontal ligament stem cells
3 讨论
TNF-α作为炎症细胞因子和干细胞的成骨分化关系密切[9,10],如在骨质疏松条件下,TNF-α可抑制骨髓间充质干细胞的成骨分化[11];不同浓度的TNF-α对根尖乳头干细胞的增殖具有促进作用,对根尖乳头干细胞的矿化和成牙成骨向分化具有抑制作用[12]。牙周炎时牙周膜干细胞会暴露在炎性环境中,炎性环境直接影响牙周膜干细胞的功能,牙周炎时的炎性环境包含多种炎性细胞因子,以TNF-α为主。TNF-α等炎性细胞因子刺激可引起牙周膜干细胞生物学特性的改变,降低牙周膜干细胞的成骨能力,从而影响骨组织的再生。本研究发现TNF-α与牙周膜干细胞共同培养,可减弱牙周膜干细胞的ALP和茜素红染色程度,降低ALP活性和矿化结节,降低牙周膜干细胞Osterix和Runx2蛋白水平。ALP为早期成骨标志,可促进细胞成熟和钙化,ALP水平可反映成骨细胞分化水平,ALP活性越高表明成骨细胞分化越明显[13,14]。钙化结节是成骨细胞分化成熟的标志,也是成骨细胞行使成骨功能的形态学表现,观察钙化结节是研究成骨细胞分化的主要手段之一[15,16]。Osterix为调节成骨细胞分化的重要转录因子,Osterix水平可作为成骨细胞分化程度的标志,其水平降低表明成骨分化能力下降[17,18]。OPN在多种组织中合成和分泌,是成骨细胞成熟分化的标志[19,20]。因此本研究表明TNF-α可抑制牙周膜干细胞的成骨分化。
ERK1/2的激活和多种细胞行为关系密切,在细胞增殖和分化中发挥信号网络核心的作用,ERK1/2被上游的激酶激活后可激活其下游转录因子,从而对细胞的增殖和分化的靶基因进行调控,最终调控细胞的增殖和分化等[21]。研究发现Runx2为ERK1/2通路下游重要的靶基因之一,其转录水平受ERK1/2信号通路的调控,ERK1/2活化后可激活Runx2蛋白,使Runx2蛋白在脯氨酸-丝氨酸-苏氨酸部位发生磷酸化,从而使Runx2具有转录活性,具有转录活性的Runx2通过调控下游靶基因的表达发挥促进成骨细胞分化的作用[22]。骨基质分泌和矿化的主要细胞为成骨细胞,Runx2是公认的成骨细胞特异性转录因子,Runx2可与多种成骨基因启动子上顺式作用元件特异性结合,促进成骨靶基因转录表达;Runx2是联系胞内成骨细胞功能分化和胞外成骨诱导因素的信号通路枢纽[23,24]。本研究发现:TNF-α与牙周膜共同培养可降低牙周膜干细胞p-ERK1/2、Runx2蛋白水平;给予ERK通路激动剂处理后,可改善TNF-α对牙周膜干细胞p-ERK1/2、Runx2蛋白水平的抑制作用,并可改善TNF-α对牙周膜干细胞成骨分化的抑制作用。因此分析TNF-α可能通过抑制ERK1/2-Runx2信号通路的激活,从而抑制成骨靶基因的转录表达,发挥抑制牙周膜干细胞成骨分化的作用。
综上所述,TNF-α对牙周膜干细胞成骨分化的抑制作用可能与ERK1/2-Runx2信号通路有关,激活ERK1/2-Runx2信号通路可改善TNF-α对牙周膜干细胞成骨分化的抑制作用。本研究为牙周病的治疗提供了新的治疗靶点。

