GATA4在肝癌细胞中的表达及其对肝癌细胞增殖、迁移和侵袭能力的影响
王 炼,乔 昕,张轶西,刘 斌,孙轶夫,汪 宏,乔士兴*
(1.吉林大学第二医院 肝胆外科,吉林 长春130041;2.首都医科大学附属北京朝阳医院 麻醉科,北京100020;3.中山大学附属第一医院 肝胆外科,广东 广州510080)
肝细胞癌(HCC)是全世界死亡率排第三位的恶性肿瘤,每年大约50-60万人死于肝癌[1,2]。 HCC发展是由遗传易感性、环境因素、代谢综合征、酒精和黄曲霉毒素B1等和病毒感染相互作用产生的[3]。近年来,随着治疗手段的不断改进,根治性手术切除对早期肝癌患者效果较好,而对于中、晚期肝癌患者即使根治切除,5年生存率仍然非常低[4]。因此,肝癌的早期诊断对提高肝癌患者的总体生存率具有十分重要的意义。目前影像学检查是肝癌诊断的常用方法,而血清标志物具有易检测、可重复等优点,在肝癌诊断中占有重要地位。甲胎蛋白(AFP)是全世界应用最广泛的肝癌肿瘤血清标志物[5],但敏感性、特异性并不理想[6]。因此,探索敏感性和特异性更高的肝癌早期诊断标志物成为目前研究热点。
GATA4是转录因子GATA家族的成员之一,GATA4 主要在内胚层和中胚层来源的组织和器官中表达。研究证实,GATA4 在小鼠的胚胎发育中有着调节发育以及具有组织特异性表达的特点。在小鼠的胚胎发育过程中GATA4 的mRNA 可在多种器官中检测到,如心脏、肠、生殖腺、肝脏,内脏以及腔壁内胚层等[7]。在肝脏的发育过程中,GATA4起到非常重要作用[8]。在HCC中GATA4介导的反式激活可抑制肝细胞上皮分化功能[9]。GATA4在肝癌细胞中高表达,并能促进正常肝细胞增殖,促进FTF、AFP的表达,可能参与肝癌的发生、发展[10]。此外,GATA4的转录活性与肝癌细胞的分化程度密切相关[11]。然而,部分研究证实GATA4在肝癌中低表达[9,12,13]。总之,GATA4在肝癌中的表达模式至今还存在争议。 本文旨在探讨GATA4在肝癌细胞中表达模式,并验证GATA4表达改变对肝癌细胞增殖、转移的影响。以期为肝癌的早期诊断和治疗提供数据支持。
1 材料与方法
1.1 材料GATA4兔抗人多克隆抗体购自abcam公司,GAPDH兔抗鼠单克隆抗体、山羊抗鼠IgG(H+L)和山羊抗兔IgG(H+L)购自碧云天。本实验所有细胞(正常肝细胞HL-7702、肝癌细胞株HepG2、SMMC-7721、Hep3B和肾上皮细胞293T)均由吉林大学公共卫生学院惠赠。TRIzol、可替代LIPO2000、MTT试剂盒均购自美伦生物科技有限公司。GATA4过表达慢病毒购自上海吉凯基因化学技术有限公司。GATA4干扰质粒、GATA4引物和GAPDH引物均购自生工生物工程(上海)股份有限公司。RT-PCR试剂盒购自TaKaRa。
1.2 方法
1.2.1细胞培养 本实验采用人类正常肝细胞(HL-7702)、肝癌细胞株(HepG2、SMMC7721、Hep3B)用含10% 胎牛血清的1640、DMEM和MEM培养液(其中HL-7702用1640培养液,HepG2和Hep3B用MEM培养液、SMMC7721用DMEM培养液),在37 ℃、5% CO2恒温培养箱进行培养。用于转染的293T 细胞用含10% 胎牛血清的DMEM 培养液,在37 ℃、5%CO2恒温培养箱进行培养。
1.2.2RT-PCR法检测GATA4mRNA的表达水平 用TRIzol提取总RNA。2 μg纯化的RNA按逆转录试剂说明书在PCR仪中合成cDNA。根据RT-PCR试剂说明书进行实时定量PCR检测,GATA4上游引物5’-CTGGCCTG TCATCTCACTAC-3’,下游引物5’-TTACGCAGTGAT TATGTCCC C-3’;内参GAPDH上游引物5’-GTATCGTGGAAGGACTCATGAC-3’,下游引物 5’-ACC ACCTTC TTGATGTCATCAT-3’。反应条件:95℃预变性,酶激活(30 s)95℃变性(5 s),60℃(30 s),40个循环。最后所得Ct值用2-ΔΔCt法进行分析。PCR反应每个样本设3个复孔,最后取平均值。
1.2.3GATA4高表达和沉默模型制备 GATA4过表达慢病毒(GATA4)由上海吉凯基因化学技术有限公司合成,GATA4-siRNA干扰质粒(GATA4-siRNA#1正义链5’-GGCAGAGAGUGUG UCAACUTT-3’,反义链5’-AGUUGACAC AUCUCUGCCTT,GATA4-siRNA#2正义链5’-GCCUCUU GCAAUGCGG AAATT-3’,反义链5’-UUUCCGCAUUGCAAGAG GGCTT-3’)由生工生物工程(上海)股份有限公司合成,并提供合成结果。过表达模型制备,实验分为两组:(1)对照组(Vector组),(2)实验组(GATA4组)。用293T细胞进行慢病毒包装,用病毒液感染HepG2细胞,嘌呤霉素筛选2周,GATA4过表达细胞用Western Blot检测。沉默模型制备,本实验分为两组:(1)对照组(NC组),(2)实验组(GATA4-siRNA组)。Hep3B用1 μg GATA4-siRNA质粒和转染试剂(可替代LIPO2000)进行瞬时转染,24 h后用Western Blot 进行检测。
1.2.4增殖实验 用MTT试剂检测细胞增殖率,该实验完全按照MTT试剂说明书进行操作。在96孔板中种植细胞2000个,每个样本种5个复孔,用含10%FBS的MEM培养基,5%CO2,37℃孵育。第2天每孔加入10 μl MTT溶液(5 mg/ml),继续培养4 h。4 h后加入150 μl二甲基亚砜(DMSO)使结晶溶解,用酶标仪在490 nm处测定其吸光值,根据测得吸光度值(OD)来判断活细胞数量。
1.2.5划痕实验 先用Marker笔在6孔板背后,均匀划横线,大约每隔0.5-1 cm划一道,每孔至少5条线。在6孔板种植细胞(5×105个细胞/孔),每种细胞种植3个复孔。至细胞铺满后,用枪头和直尺,垂直于后面的横线在细胞中划痕,用PBS洗掉划下的细胞,加入无血清的培养基放入37℃5%CO2培养箱培养,按0、24、48 h取样拍照。
1.2.6Transwell侵袭实验 用BD公司的Matrigel1∶8稀释,包被Transwell 小室底部膜的上面,至37℃1 h使Matrigel聚合成凝胶。消化细胞,将细胞浓度调整到5×105/ml,取100 μl细胞悬液加入小室。24孔板下室加入600 μl含20%FBS的MEM培养基,24 h后取出小室,弃去孔中培养液,用无钙PBS洗两遍,多聚甲醛固定30 min,将小室风干,0.1%结晶紫染色20 min,用棉签擦掉上层未迁移的细胞,显微镜下观察计数。
1.2.7Western Blot 用细胞裂解液提取细胞中的总蛋白,BCA试剂盒(碧云天)严格按说明书操作测蛋白浓度。每孔加入30-50 μg标准化蛋白样品,在加满Tris-Glycine电泳液的垂直电泳槽内,浓缩胶80 V恒压电泳至分离胶界面时,调至120 V继续电泳至溴酷蓝分离胶底部。转移至聚PVDF膜,用指定的一抗室温孵育2 h或4℃孵育过夜。 TBST洗5 min共3次,加入二抗室温孵育1 h。取出PVDF膜,洗5 min共3次;吸干膜上液体,于洁净保鲜膜上加ECL工作液反应2-5 min;暗室内压片、显像,结果使用Quanlitiy one 分析。
1.3 数据分析数据采用SPSS19.0软件进行分析:计量资料组间差异采用t检验,计数资料组间差异采用卡方检验或Fisher精确检验,双侧P<0.05为差异有统计学意义。
2 结果
2.1 mRNA水平GATA4在肝癌细胞中高表达,蛋白质水平低表达
用RT-PCR检测GATA4在正常肝细胞和肝癌细胞系中的表达,结果发现GATA4在正常肝细胞(HLLP-7702)和肝癌细胞(HepG2)中低表达,在肝癌细胞系(Hep3B和SMMC7721)中高表达(图1A)。用western blot检测GATA4蛋白在正常肝细胞和肝癌细胞系中的表达,结果发现GATA4蛋白在正常肝细胞(HL-7702)和肝癌细胞系(HepG2、Hep3B和SMMC7721)中均低表达(图1B)。
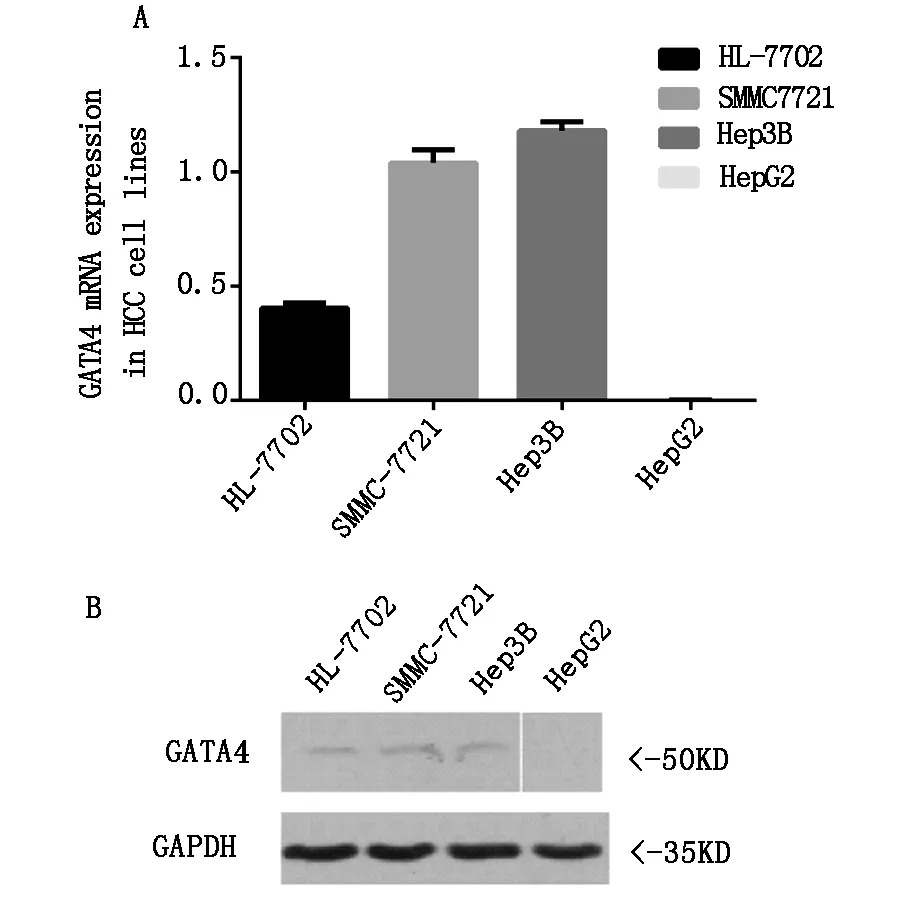
注:A:用RT-PCR检测GATA4在正常肝细胞和肝癌细胞中的表达,GATA4在正常肝细胞和肝癌细胞HepG2中低表达,在肝癌细胞SMMC721和Hep3B中高表达;B:Western Blot检测GATA4在正常肝细胞和肝癌细胞系中的表达,GATA4在正常肝细胞(HL-7702)和肝癌细胞(HepG2、Hep3B和SMMC7721)中低表达。
图1 mRNA水平在肝癌细胞(SMMC7721和Hep3B)中高表达,在蛋白质水平在肝正常细胞和肝癌细胞中低表达
2.2 转录因子GATA4抑制肝癌细胞增殖
体外构建GATA4高表达模型,用载有GATA4 DNA的质粒转染肝癌细胞HepG2,用western blot 检测GATA4表达,HepG2-GATA4细胞GATA4蛋白高表达(图2A)。相反,在体外构建GATA4沉默模型,用siRNA转录肝癌细胞Hep3B,用westetn blot 检测干扰效率,结果发现,siRNA#1和siRAN#2都成功干扰GATA4在肝癌细胞Hep3B中的表达(图2B)。用MTT实验检测GATA4高表达细胞或低表达肝癌细胞增殖能力,结果发现,GATA4高表达肝癌细胞(HepG2)增殖能力减弱,相反GATA4低表达肝癌细胞(Hep3B)增殖能力增强(图2C)。这些结果表明GATA4抑制肝癌细胞(HepG2、Hep3B)增殖。
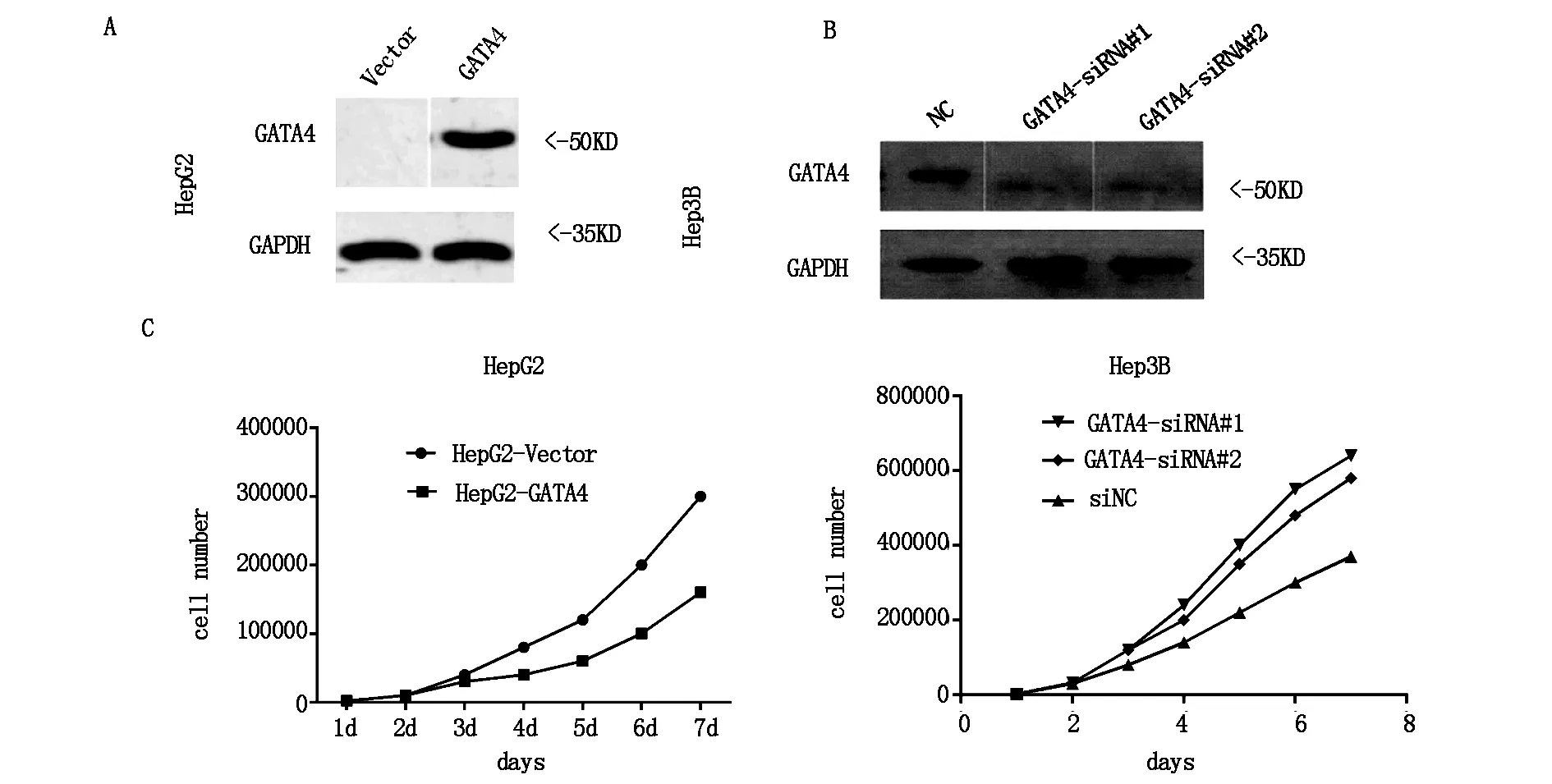
注:A:用载有目的基因的质粒转染肝癌细胞HepG2,用western blot检测GATA4蛋白质表达;B:用siRNA质粒转染肝癌细胞Hep3B,由western blot检测GATA4蛋白表达;C:用MTT实验检测GATA4高表达或低表达对肝癌细胞增殖的影响。
图2 GATA4抑制肝癌细胞的增殖
2.3 GATA4抑制肝癌细胞迁移和侵袭
如前所述,体外分别构建GATA4高表达或沉默模型。用细胞划痕实验和transwell侵袭实验检测GATA4高表达或低表达对细胞迁移和侵袭的影响。结果表明,GATA4高表达抑制肝癌细胞(HepG2)迁移,低表达促进肝癌细胞(Hep3B)迁移(P<0.05)(图3A)。GATA4高表达抑制肝癌细胞(HepG2)侵袭,低表达促进肝癌细胞(Hep3B)侵袭(P<0.05)(图3B)。这些结果表明,上调GATA4表达抑制肝癌细胞(HepG2、Hep3B)迁移和侵袭,相反,下调GATA4表达促进肝癌细胞(HepG2、Hep3B)迁移和侵袭。
3 讨论
肝癌发病机制复杂,目前认为肝炎病毒感染(以乙肝病毒、丙肝病毒为主)、黄曲霉素、酒精、亚硝胺类物质、肝硬化等均可导致肝癌发生[3]。近年来,众多学者从基因及蛋白质层面对肝癌进行研究,发现多种基因及其蛋白质直接或间接参与了肝癌的发生和发展。
GATA4是含有440个氨基酸蛋白质,分子量约为50 kD,其在3个胚层的发育中均发挥作用,目前研究较多的是其在中胚层的作用。GATA4由于启动子甲基化[14]或核-浆转运异常导致的异位表达及其蛋白功能缺失[15,16],在肺癌、消化道肿瘤和卵巢癌中很常见。并且研究还发现,在胃癌细胞中GATA4 启动子的甲基化与幽门螺旋杆菌的感染有一定的联系。Hellebrekers 等将GATA4的表达质粒转入RKO 和HCT1116 细胞,结果发现GATA4过表达能明显抑制结肠癌细胞的增殖,迁移[17]。Agnihotri 等[18]研究发现,多数分级较高的多形性恶性胶质瘤细胞存在着GATA4 的表达缺失,并且患者的生存期较短;并且GATA4 除了能在体外抑制胶质瘤细胞的增殖,在小鼠体内也能抑制癌细胞的生长及转移,其机制可能与GATA4抑制细胞周期抑制性蛋白P21有关。此外,GATA4在早期乳腺发展中起重要作用[19],并且在乳腺癌组织和乳腺癌细胞系中GATA4的表达明显降低[19],GATA4的低表达水平预示着不良预后[19,20]。以上结果表明GATA4在大多数恶性肿瘤中低表达,并且在很多肿瘤发展过程中扮演着重要角色。

注:A:用划痕实验检测GATA4高表达或低表达对细胞迁移的影响,GATA4高表达抑制肝癌细胞迁移,低表达增强肝癌细胞迁移;B:用transwell 侵袭实验检测GATA4高表达或低表达对肝癌细胞侵袭性的影响,GATA4高表达抑制细胞侵袭,GATA4低表达增强细胞侵袭。*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
图3 GATA4抑制肝癌细胞迁移和侵袭
然而,GATA4在肝癌细胞及组织中的表达至今尚存在争议,部分研究[10]表明GATA4在肝癌细胞系和组织中高表达,并且促进正常肝细胞增殖,可能参与肝癌发生发展。另有部分研究证实GATA4在肝癌细胞系和组织中低表达[9,12,13]。本研究结果发现,GATA4 mRNA在肝癌细胞系(Hep3B和SMMC7721)中高表达,在肝癌细胞系(HepG2)和正常肝细胞(HL-7702)中低表达,GATA4蛋白在肝癌细胞系(Hep3B、SMMC7721 和HepG2)和正常肝细胞(HL-7702)中均低表达,和李艺伟的研究[21]结果不尽相同,但是从蛋白水平两项实验结果相同,至于本研究为什么会出现GATA4mRNA高表达,而蛋白水平低表达可能有以下几个原因:①本研究采用肝癌细胞株种类较少,不能代表总体趋势,②GATA4只在转录水平参与肝癌细胞的调控,并未合成相应的蛋白质,具体机制还需后续进一步研究。通过转染建立体外高表达或沉默模型,发现上调GATA4表达抑制肝癌细胞(HepG2、Hep3B)增殖、迁移和侵袭能力,相反,下调GATA4表达促进肝癌细胞(HepG2、Hep3B)增殖、迁移和侵袭能力,而肝癌细胞的迁移和侵袭能力主要反应肿瘤的转移能力,因此,这些结果表明GATA4可能与肝癌的增殖和转移相关。本实验结果和GATA4在大部分肿瘤中的研究结果一致,因此,GATA4蛋白在肝癌细胞和组织中低表达 ,可能与GATA4启动子高甲基化和核-浆转录异常相关。GATA4高表达抑制肝癌细胞中增殖、迁移和侵袭与GATA4在结肠癌和脑胶质瘤研究结果一致,可能与GATA4能诱导细胞周期抑制蛋白P21的表达相关,其具体机制还需后续进一步研究证实。
综上所述,通过本研究我们证实,GATA4 mRAN在部分肝癌细胞(Hep3b、SMMC-7721)中高表达,其蛋白在肝癌细胞系和正常肝细胞中均低表达,GATA4蛋白在肝癌细胞中表达下调可能与GATA4启动子高甲基化和核-浆转录异常导致其表达缺失有关。并发现GATA4表达上调能抑制肝癌细胞增殖、迁移和侵袭能力,这些抑制作用可能与其诱导细胞周期抑制性蛋白P21的表达相关,但其具体机制需后续进一步研究证实。

