控制性低中心静脉压技术在肝脏手术中的临床进展
杨雪芳,张 策,冷亚书,韩阳东
(吉林大学中日联谊医院 麻醉科,吉林 长春130033)
目前,肝疾病患病率处于增长阶段,肝切除术量也随之增长,越来越多的临床医生关注如何提高患者术后生存率。肝作为人体内重要器官组织之一,组织脆弱 ,血管分布复杂,血流丰富,肝切除术后死亡率与术中出血量及输血密切相关[1],大量失血和输血会直接影响患者治疗效果,增加术后并发症(包括传染性疾病,急性呼吸窘迫综合征,凝血功能障碍和多发性器官衰竭等),同时对免疫系统的抑制作用会引起术后的肿瘤复发[2]。外科医生一般采用Pringle (PM;portal triad clamping)操作来控制流入肝脏的血液来减少术中出血量。研究表明术中失血量也与中心静脉压(central venous pressure, CVP)高低有关[3,4],因此麻醉医生通过控制性低中心静脉压(control low central venous pressure,CLCVP)技术来减少肝切除期间的出血量。其效果明显,广受肝胆外科医师们的青睐,并且越来越多应用于临床工作。本文主要从技术的原理,方法及应用出发,阐述了其对机体的影响并且总结分析了其他的可替代CVP监测指标。
1 CLCVP的原理
临床上一般将CVP<5 cmH2O或低于基础值的40%称为低中心静脉压(low central venous pressure ,LCVP)。CLCVP技术的原理是通过药物和手术方式来达到LCVP状态,这不仅降低了下腔静脉压(inferior vena cava pressure,IVCP)和肝静脉压力,从而使得肝窦内和肝静脉的压力降低以及血管壁内外的压力梯度减少,而且缩小了血管半径,减少了肝脏切除时的出血量。根据泊肃叶层流公式:
可知,肝静脉血管损伤引起的出血量与肝静脉血管壁内外压力差(Δp)和血管半径的4次方(r^4)成正比。在横断肝实质时出血量与肝窦内压力和血管半径有关,根据血流方向,肝门静脉入肝后逐渐分支形成肝窦(肝毛细血管),汇入肝窦的血液集合成肝静脉后入下腔静脉,肝窦压力与肝静脉压是直接相关的;肝静脉压是受IVCP影响的[5],两者联系密切;同时研究已证实IVCP与CVP具有良好的相关性[6,7]。因此,肝窦内压力是与CVP是有联系的,在横断肝实质时通过降低患者CVP可以降低肝静脉压以减少术中出血量。
2 CLCVP的方法及应用
通常实现患者LCVP状态的非手术方法主要是术中麻醉管理(intraoperative anesthetic control:IAC),包括液体控制,血管扩张药或利尿剂的使用,全麻联合椎管内麻醉,特伦德伦伯体位(Trendelenburg position),低潮气量通气,呼气末正压降低)等;手术方法一般是采用肝下腔静脉阻断术(intrahepatic inferior vena cava clamping :IIVC)。在临床上,大多是将几种方法联合应用以达到LCVP。
2.1 CLCVP非手术方法
在过去肝脏手术中多是采用限制液体输入的方法来达到患者LCVP,这也是CLCVP的核心步骤。但对不同患者需要采用个体化的方法。在麻醉诱导后到肝实质横断分离完成时,需维持CVP<5 cmH20,液体输注速度必须严格控在1-3 ml/kg/h,并且在该阶段需保持收缩压(Systolic blood pressure, SBP)>90 mm Hg且尿量高于25 ml/h。Wang 等人[8]通过研究发现大多数患者在术中静脉液体输注减少至75 ml/h时,CVP<5 cmH2O,能显著的减少术中失血和输血且不影响肾功能。
液体容量限制往往需要时间,在肝切除开始前不能快速降低CVP,有些患者需要静脉泵入硝酸甘油或硝普钠等扩静脉血管药物快速降压,剂量为1-3 mg/h,同时在LCVP期间应用小剂量的多巴胺(3 μg/kg·min)或甘露醇将有助于肾功能的保护。Zatloukal J等人[9]把接受两个或更多肝段切除术的患者随机分为绝对液体限制组(AR,n=17)和相对体积再分布组(RR,n=17),其中AR组术中静脉液体输注速度为1 ml/kg/h,RR组通过加深麻醉和静脉应用血管扩张药达到LCVP。这两种降低CVP的方法均安全有效。但是在健康患者肝移植供体中维持LCVP通常需要特殊的血管扩张剂和利尿剂等[13]。H.-G.Ryu 等[10]研究发现在肝移植术中从诱导直至肝叶切除完成期间输注米力农(0.5 mcg/kg/min)使得患者能够快速达到血流动力学稳定性和低CVP的状态,能减少失血量,改善手术视野,有利于术后恢复。
全麻联合椎管内麻醉也可成功实施CLCVP。比如,Archna Koul等人[11]对104例右叶活体供肝切除患者接受硬膜外镇痛处理进行回顾性分析,发现全麻下行联合椎管内麻醉不仅提供了术中和术后镇痛,而且血管扩张有助于在肝切除术中维持低CVP,减少患者术中失血量及输血。Feltracco et al.等人[12]也证实肝移植供体中的胸外硬膜外镇痛对降低CVP和减少手术失血具有重要作用。
除上述非手术方法以外,还包括体位和控制通气。然而研究表明这两种方法对减少肝血流作用轻微。比如体位的改变可导致CVP的显著变化,但是这并没有改变肝静脉压[13]。Hasegawa[14]等人发现潮气量减少引起CVP变化小,约0.5 mmHg,对减少失血或输血无明显影响。L.Sand[13]等人研究发现呼末正压通气从5 cmH2O逐渐增加到10 cmH2O,中心静脉压和肝静脉压约增加1 mmHg,对术中失血量的改变无明显差异。
2.2 CLCVP常用的手术方法
近年来,CLCVP常用手术方法是IIVC。有研究表明与IAC相比, IIVC降低 CVP程度更为简单有效,能更快速实现LCVP,控制出血效果更好[15,16]。但是IIVC也有不足之处,Rahbari NN[17]等人的研究发现 IVCC实验组肺空气栓塞的发生率略高于IAC对照组,IIVC与栓塞的相关性高。同时IIVC可能涉及到静脉循环的开放和奇静脉血压的升高,可诱发心脏病的发生。IIVC这项技术更适合肝硬化,药物耐受和LCVP下血流动力学不稳定的患者。
在实际的临床应用上,CLCVP主要是通过IAC联合IVCC来实现的。Liang等[18]回顾性分析了IVCC和IAC达到LCVP的临床效果,其临床结果无显著差异,两种方式都显著降低总出血量、总手术时间和肝脏横断时间。Zhi li等[19]评估了包括283例肝切除手术在内的5组CLCVP随机对照实验,在本研究分析中,实验组通过联合使用调整体位,输注血管扩张药,利尿剂,控制输液速度及IIVC等方法将 CVP控制在5 mmH2O以下,与对照组相比,失血量、输液需求和手术时间都显著减少。
3 CLCVP技术的使用对机体的影响
相比常规肝切除而言使用CLCVP技术,麻醉诱导之后血压会比基础血压低,保持平均动脉压(mean arterial pressure,MBP)>60 mmhg可保证组织的基本灌注是足够的。众多学者对于CLCVP技术在肝切除和肝移植中对机体肝肾功能及凝血功能的影响持有不同意见,需要进一步研究探索。监测肝功能和肾功能的相关指标,包括丙氨酸转氨酶(ALT)、天冬氨酸氨基转移酶(AST)和血尿素氮(BUN)等,发现这些指标在术后3天可基本恢复至正常范围[19]。Feng等人[20]对共86例肝移植患者LCVP组和对照组研究,发现两组血肌酐(CR)值和BUN在术后1到7天无明显差异,LCVP组术后并没有发生肾功能不全,同时两组中预期凝血酶原(PT)值,氧供指数(DO2I),氧耗指数(VO2I)无统计学差异,LCVP组的血乳酸浓度低于对照组但仍在正常范围。Correa-Gallego C 等[21]人研究发现2116例患者在LCVP下进行肝切除术,大多数患者的评估肾小球滤过率(Estimated glomerular filtration rate,eGFR)基线较低;大多数患者术后eGFR的变化是短暂的,且对临床影响是有限,实验数据表明,临床相关的术后肾功能不全的发生是一个低概率事件。然而Schroeder 等人[22]发现肝移植患者使用CLCVP技术,CR高于正常值,术后出现肾衰。
有研究显示,凝血酶原时间国际标准化比值(Prothrombin time-international normalized ratio,PT-INR)在肝切除术后第5天仍高于术前值,但术后PT-INR延长的临床意义仍不清楚[23,24]。PT-INR升高,接受肝切除的患者表现出短暂的高凝状态,随后基于血栓弹力图(Thrombelastography, TEG)显示凝血功能正常,这些数据引起了人们根据PT-INR的升高指导肝切除术后输血和预防性抗凝时机的质疑[25]。理论上PT-INR升高的临床意义是多方面的,肝切除术后PT-INR升高需输注新鲜冷冻血浆(FFP)同时PT-INR升高可能伴随有深静脉血栓(DVT)形成和肺栓塞(PE)的危险等。肝叶切除,肝合成功能的短暂下降,肝合成的凝血因子和调节蛋白的减少,非肝合成因子(第VIII因子和Willenbrand’s因子)上调,可使凝血系统维持近乎正常的凝血状态。临床工作并没有证据表明患者因PT-INR的升高而持续出血,虽然术后PT-INR(0.8-1.2)最高值达到1.4,但一些肝胆外科医生认为这个数值在临床上意义并不重要。所以肝切除术后促凝血因子和抗凝血因子合成障碍导致凝血功能异常,对机体是否具有严重的危害,就目前而言这都是不确定的。
由于CVP监测受胸腔内压,心肌收缩力,静脉充盈情况,体位和腹腔压力等因素影响,对液体反应性比较缓慢,不能及时快速的反映机体血容量状态。在肝叶切除和止血完成时,需要进行液体复苏,输注液体过快易引起缺血再灌注损伤,输注速度过慢易引起末梢组织灌注不足,这对患者都是不利的。
4 替代CVP监测的优良监测指标—每搏变异度(stroke volume variation, SVV)
肝切除术围术期优化血流动力学的管理非常复杂,中心静脉压监测并不能及时准确的预测液体反应性,评估患者血容量情况,而且中心静脉置管还涉及气胸,神经穿刺,大出血,感染和形成静脉血栓等并发症的风险。近年来,大量研究表明功能性动态监测指标如SVV可以准确且敏感的评估患者血容量状态,指导术中液体治疗。
4.1 SVV的简介
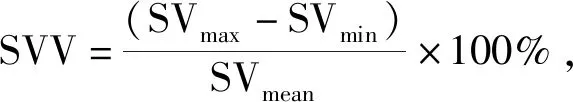
4.2 SVV监测肝叶切除患者血容量状况,指导临床容量治疗
对于肝切除手术而言,患者血流动力学稳定、预负荷优化和正确的液体治疗至关重要,需要可靠的预测心输出量对血容量扩张反应的动态指标--SVV。在机械通气患者中,动态预负荷指数SVV比静态负荷指数CVP更能准确地预测液体的反应能力;SVV能直接测量心输出量的变化,而不是通过动脉压的变化来估计。SVV能预测心脏对液体反应作用的理论基础是:采用负荷试验,增加前负荷,观察SV的变化,SVV可提示患者容量状态所在Frank Starling曲线的位置。若患者血容量不足,处于Frank Starling曲线上升段,通过补液心室舒张末期容积增加,左右心室SV增加;血容量充盈时处于Frank Starling曲线平台期,快速补液则不会增加心室舒张末容积,SV变化不明显[27]。因此,可以根据 SVV 的大小来判断血容量状况,通过容量治疗可以维持有效血容量,保证组织灌注和细胞氧合,有利于患者预后[28]。
相比CVP监测患者血容量变化而言,SVV具有较佳的特异性和灵敏度[29]。Zhang Z等人[30]研究共分析了包括来自23项研究的568名患者:SVV基线与液体反应性相关,综合相关系数为0.718;在所有研究背景中,发现SVV的诊断优势比为18.4,预测液体反应的敏感性为0.81,特异性为0.80。肝切除术常常会出现大出血,以致患者血流动力学不稳定,在这种情况下SVV依然能准确反映心指数(CI) 、心输出量(CO)和SV的变化情况,这使得SVV 监测比CVP监测拥有更广的范围。Erik M等人[31]研究表明在肝切除术期间,CVP-1到1之间与SVV18到21有显著相关性,SVV监测可作为肝切除术中CVP监测的替代方法,在失血量和肝实质横断时间方面具有同等的效果。Zatloukal J等人[9]的实验得出SVV>10%可预测其低CVP,敏感性为81.4%,特异性为77.1%,该研究表明高SVV可以替代低CVP 。SVV不仅可以作为预测液体状态的动态指标,而且避免有创操作中心静脉置管术(Central venous catheterization,CVC)以及发生CVC相关并发症的风险。综上所述,使用动脉压力波形引起的SVV被认为是一种侵入性较小的替代方案,它可以作为肝切除术中CVP监测的良好替代监测指标。
5 总结
有效控制术中出血是肝切除手术的关键,CLCVP技术是肝切除术中减少失血和输血的一种简单有效的方法。这不仅有利于暴露手术视野,而且缩短手术时间,减少术后发病率和死亡率;特别是复杂或困难的手术,使用CLCVP技术是必要的。CLCVP的出现,虽然避免了容量超负荷的危险,但CVP受多种因素影响,对机体容量变化反应稍差,SVV监测则能及时准确的评估肝叶切除患者血容量变化,预测患者液体反应性,满足术中液体需求,实现加速康复外科所要求的个体化容量治疗目标的要求。

