MKRN3基因与儿童中枢性性早熟
石玉兰12,贵子豪1,郭冰冰1,徐高生1,莫中成
(1.南华大学衡阳医学院应用解剖与生殖医学研究所,南华大学 岳阳市妇幼保健院基础与临床协同研究生培养创新实践基地,组织学与胚胎学教研室,湖南 衡阳 421001;2.邵阳学院附属第二医院儿科,湖南 邵阳 422000)
中枢性性早熟(central precocious puberty,CPP)是指女性在8岁前,男性在9岁前内、外生殖器官提前快速发育,并出现第二性征的一种常见儿科内分泌疾病。CPP发生的机制可能与下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal axis,HPGA)提前被激活有关。近年来,环指蛋白3(makorin ring finger protein 3,MKRN3)基因已被确定为CPP的易感基因,MKRN3基因缺失突变导致HPG轴过早激活。Bo Ram Yi研究了103名女孩和70名男孩MKRN3的多态性,确定其与男孩的性早熟有关,但与女孩无关[1]。Erina Suzuk等人对24名患者(22名日本患者和2名中国患者)的核苷酸取代进行分析,发现在19名日本患者中发现了DNA甲基化缺陷和拷贝数改变,但仅有一名女性发生MKRN3核苷酸取代[2]。同时,研究报告表明,MKRN3缺陷在亚洲人群中很少见,故推测这种罕见突变可能存在种族差异。本文将综述MKRN3基因与中枢性性早熟之间关系。
1 MKRN3基因结构和功能
MKRN3 基因位于Prader-Willi综合征关键区域的染色体15q11.2 上,仅有外显子,不含内含子,是一种母系印记基因。MKRN基因家族用特定的锌指基序阵列编码核糖核蛋白[3-4]。MKRN3 蛋白具有2个N末端C3H 锌指模体,1个MKRN 特异性Cys-His 结构域,1个C3H4 RING 锌指模体和1个C 末端C3H 锌指模体[5](图1)。该蛋白参与细胞信号转导过程及蛋白质的泛素化过程,但目前关于它的具体功能以及突变是如何导致中枢性性早熟的研究还不明确。
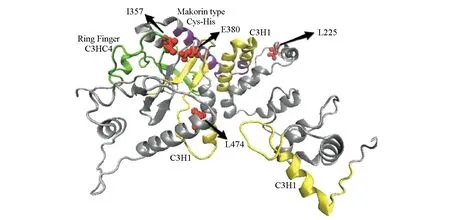
图1 MKRN3蛋白三维结构模式图[5]
2 MKRN3基因的突变
在MKRN3基因的研究中共发现了33个突变,其中14个是移码突变,17个错义突变和2个无义突变[6-7]。最近,刘璐等人在2个散发病例和5个家系病例中发现4种新的基因突变,分别为:c.1138G>A(p.Glu380Lys )、c.1420T>A (p.Leu474Met)、c.673C>G (p.Leu225Val)、c.1071C>G(p.Ile357Met)[5](详见表二)Macedo D对健康和中枢性早熟女孩进行甲基质谱分析,也发现在CPP患者启动子区域的4个罕见突变4-nt deletion (c.-150_-147delTCAG;-38 to -41nt),这些突变会使MKRN3启动子活性显著降低,并认为其是导致CPP[8]的重要原因。
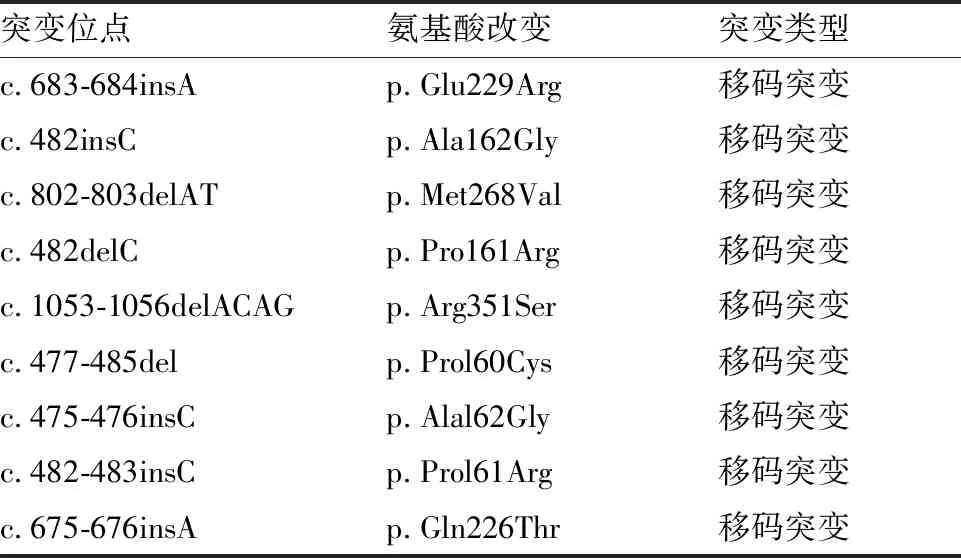
表1 已证实的MKRN3基因突变
续表

突变位点氨基酸改变突变类型c.766-767delAp.Glu256Gly移码突变c.637delCp.Arg213Gly移码突变c. 1171-1172insAp.Tyr391 ∗移码突变c.441-44ldeJGp.Hisl48Thr移码突变c.331G>Tp.Glull l ∗移码突变c.1095G>Tp.Arg365Ser错义突变c.1018T>Gp.Cys340Gly错义突变c.1249T>Ap.Phe4171Je错义突变c.1260T>Gp.His420Gln错义突变c.1188C>Ap.Ser396Arg错义突变c.699G>Cp.Lys233Asn错义突变c.677A>Cp.Gln226Pro错义突变c.611T>Cp.Ile204Thr错义突变c.298A>Tp.Ile100Phe错义突变c.587G>Tp.Gly l 96V al错义突变c.1034G>Ap.Arg345His错义突变c.737A>Gp.Tyr246Cys错义突变c.1118C>Tp.Pro373Leu错义突变c.89C>Tp.Pro30Leu错义突变c.982C>Tp.Arg328Cys错义突变c.943A>Gp.Met 315Yal错义突变c.935G>Ag.Gly312Asp错义突变c.1071C>Gp.11e357Met错义突变c.1138G>Ap.Glu380Lys错义突变c. l420T>Ap.Leu474Met错义突变c.673C>Gp.Leu225Val错义突变E298∗p.Glu298Ter无义突变c.841C>Tp.Gln281∗无义突变
3 MKRN3基因突变与性别的关系
有研究发现,女孩的CPP发病率高于男孩[9-11],但最近Lee HS等人报道韩国女孩中枢性性早熟的MKRN3突变率较低[12]。与先前报道的女性数据相比,男性中MKRN3突变的频率较高[13]。然而,当仅考虑CPP患者时,男性患者(17.6%)中MKRN3突变的患病率高于女性患者(5.0%)(P=0.05)[14]。女孩的青春期年龄比男孩小,但男孩的发病率较高[14],有可能表明儿童期GnRH的抑制作用弱于女孩,使女孩对青春期发病的紊乱更敏感。MKRN3基因在小鼠下丘脑弓状核中的表达没有性别差异,这表明在青春期前,MKRN3在两性中都有抑制作用[15-16],但不排除有性别特异性作用的可能。
4 MKRN3基因对青春期时间的影响
4.1 MKRN3基因和LIN28B可能协同调节青春期的时间而影响性早熟
目前发现MKRN3与青春期定时相关基因编码的20种蛋白质相互作用,其中LIN28B是研究最成熟的青春期相关基因之一[17-18]。LIN28B与月经初潮年龄、成年身高和儿童期生长有关[19-20],并且现已知该基因是let-7 microRNA的负调节因子[21],其调节青春期时间的机制尚不清楚[22-24]。在大鼠和非人类灵长类动物中,在青春期时LIN28B的表达在下丘脑中下降[25],并且在小鼠中,LIN28B和MKRN3的表达在青春期前降低[26-27]。
然而,Yi等分析了LIN28B中的两个单核苷酸多态性(single nucleotide polymorphisms,SNPs)(rs314276和rs314280),发现它们与男孩和女孩的性早熟均没有明显的相关性[1]。但对患者进行基因检测发现rs314280和rs314276与性早熟显著相关[28-29],不过这种相关性并不能在SNPs中显示出来[30-31],推测造成这一结果的原因可能是样本数较少或存在种族差异。
以小鼠为研究对象,通过过表达LIN28B对LIN28-Let-7途径进行遗传修饰可增加小鼠体重并延缓青春期的开始[32],但LIN28B对于人类青春期时间的调控方式仍待进一步研究。Venkatram Yellapragada通过质谱分析(Mass spectrometry ,MS)发现人类LIN28B和MKRN3存在相互作用,并且推测它们很有可能协同调节青春期的时间[33]。
4.2 MKRN3基因不能通过抑制促性腺激素释放激素而调节青春期时间
促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)是由下丘脑弓状核分泌的一种十肽激素,由十种氨基酸组成。GnRH可与垂体促性腺激素细胞膜表面的GnRH受体(GnRHR)结合,形成配体-受体复合物进入细胞。垂体收到复合物刺激会周期性分泌促性腺激素如黄体生成素(luteinizing hormone,LH),卵泡刺激素(follicle-stimulating hormone,FSH)。黄体生成素和卵泡刺激素会促进性腺分泌性激素,进而对骨骼,肾上腺皮质,乳腺和甲状腺的生长有重要作用。在婴儿期,GnRH的分泌较活跃,但在儿童期停止,进入青春期后,脉冲式GnRH的分泌被重新激活导致促性腺激素的分泌增加,从而刺激性腺。而MKRN3可以抑制GnRH的分泌,而MKRN3的功能缺失性突变会导致其失去对于GnRH分泌的抑制作用,使儿童提前进入青春期。
Jeong发现一些CPP患者表现出较高的MKRN3水平,高水平的MKRN3抑制GnRH脉冲分泌通路,但并不直接抑制GnRH分泌[34]。相反,GnRH脉冲分泌增加也不能负反馈调节MKRN3的水平,这些结果表明,MKRN3不是调节GnRH分泌的唯一因子。Venkatram使用CRISPR /Cas9技术生成的两个双等位基因MKRN3 KO克隆细胞系(Del 1和Del 2)检查了MKRN3对GNRH1表达的作用,并将这些细胞系分化成表达GNRH1的神经元。结果显示,Del 1和Del 2细胞系都可以成功地分化为表达GNRH1的神经元,这表明MKRN3对于分化并不是必要的。有趣的是,Del 1和Del 2细胞系的GNRH1表达与对照组没有差异,这表明MKRN3不直接改变GNRH1表达。虽然MKRN3在他们的模型中不影响GnRH神经元分化或它们表达GNRH1的能力,但MKRN3可能通过其他机制调节GnRH神经元功能。例如,GnRH神经元活性的调节主要是通过下丘脑中的Kisspeptin和KNDy神经元进行的,而MKRN3对这些神经元的作用尚不清楚。不能排除其他MKRN补偿Del 1和Del 2细胞系中MKRN3缺失的可能性。基于人类多能干细胞(human pluripotent stem cells ,hPSC)的疾病模型是模拟人类神经元疾病的最接近的方法[35],但并没有关于MKRN3的小鼠模型的相关报道。总之,结果表明MKRN3并不是GnRH神经元分化过程和人多能干细胞分化期间的GNRH1表达的必要因素。此外,GnRHa治疗并不会改变女性CPP患者MKRN3水平[34]。
5 MKRN3基因可抑制Nptx1神经元的活性影响性早熟
Nptx1是神经元发育的重要分泌蛋白,虽然目前并没有直接证据表明Nptx1在GnRH神经元活动中发挥作用,但在研究中发现在GnRH神经元的诱导下Nptx1是最早激活的细胞外信号之一[36]。MKRN3 基因编码E3泛素-蛋白连接酶 makorin 3 (E3 ubiquitin-protein ligase makorin-3),有研究发现Nptx1需要该酶进行泛素化修饰。
有研究结果表明,在青春期之前和青春期时,小鼠下丘脑MKRN3和Nptx1呈负相关,MKRN3可抑制Nptx1的活性。MKRN3通过Ring finger结构域与Nptx1相互作用,Ring finger结构域是E3泛素连接酶域,可抑制Nptx1表达。由于到目前为止从未报道过Nptx1的泛素化,有研究推测Nptx1作为一种分泌蛋白,不仅可以通过MKRN3进行泛素化,而且可以在青春期开始时和其他E3泛素连接酶进行泛素化修饰[36]。MKRN3在幼年期通过泛素化对Nptx1发挥抑制作用。当青春期开始时,MKRN3沉默,导致GnRH神经元开始激活Nptx1等信号分子。
6 总结与展望
MKRN3因突变而功能丧失导致幼年期的对GnRH的抑制作用缺乏,进而导致CPP,但具体机制及其与其他青春期发病相关锌指基因的相互作用尚不清楚[37]。高水平的MKRN3会抑制GnRH脉冲分泌通路,但并不直接抑制GnRH分泌,表明MKRN3不直接改变GNRH1表达,可能存在调节MKRN3和GnRH分泌的上游因子。此外,MKRN3还可以作用于神经系统,通过抑制Nptx1 的活性而抑制神经元发育,但其确切的机制仍有待进一步研究。鉴于MKRN3在儿童青春期中的作用,补偿MKRN3可能是治疗CPP的潜在方法,但具体疗效及可能机制尚需要更深入的研究和考证。

