结缔组织病相关肺间质病变肺组织中TIMP-1表达及其TGF-β1/Smad3途径调控作用分析
周海艳1,李静云2,殷松楼3
(1.徐州医科大学研究生学院风湿科,江苏 徐州 223000;2.徐州医科大学附属沭阳医院风湿科,江苏 徐州223600;3.徐州医科大学附属医院风湿免疫科,江苏 徐州223000)
结缔组织病相关肺间质病变主要由自身免疫异常所致[1],病理过程为:炎性细胞弥漫性浸润,间质细胞及胞外基质成分在肺间质大量沉积,损伤肺泡及毛细血管,肺间质组织反复的修复及损伤导致肺结构重塑,引发肺纤维化[2]。虽然对结缔组织病相关肺间质病变发病机制的认知不断深入,但间质性肺疾病仍是临床中的难治病,尚无特效疗法[3]。相关研究显示,基质金属蛋白酶(MMPs)及多种细胞因子参与了肺间纤维化的病理过程[4];基质金属蛋白酶组织抑制因子(TIMPs)是MMPs的特异性抑制剂,在基质降解调节中发挥重要平衡作用[5];其中TIMP-1广泛分布于体液及多个组织中,多种细胞因子均可诱导分泌,但TIMP-2、TIMP-3、TIMP-4具有很强的特异性[6]。转化生长因子(TGF)-β1是目前研究最广泛的致纤维化细胞因子,可通过经典TGF-β1/Smad3信号通路发挥促纤维化效应[7];Smad33与P300结合在TGF-β1/Smad3信号通路活化的重要步骤之一[8]。本研究分析了结缔组织病相关肺间质病变肺组织中TIMP-1表达水平,并进一步探讨TIMP-1与TGF-β1之间的关系,以及TIMP-1在结缔组织病相关肺间质病变中作用的分子机制。
1 资料与方法
1.1 研究对象
选取2016年10月至2018年10月间本院收治的结缔组织病相关肺间质病变患者74例为观察组,均行CT引导下经皮肺穿刺活检,其中男性16例,女性58例;年龄35~63岁,平均年龄(48.40±3.94)岁。另取40例无感染和吸烟史的肺癌患者远离癌症病灶的正常肺组织为对照组,其中男性11例,女性29例;年龄38~65岁,平均年龄(50.21±5.80)岁。两组患者性别、年龄间差异无统计学意义(P>0.05)。本研究经当地伦理委员会批准,参检患者均签署知情同意书。
1.2 主要试剂
胎牛血清、DMEM培养基购于上海素尔生物科技有限公司;人重组TGF-β1细胞因子购于美国PeproTech公司;鼠抗人TIMP-1单克隆抗体、兔抗人P300单克隆抗体、HRP标记的山羊抗鼠IgG、山羊抗兔IgG购于迈威(上海)生物科技有限公司;PCDNA3.1(+)/Smad3真核过表达载体由上海生工生物工程技术服务有限公司构建合成。
1.3 方法
1.3.1 肺组织中TIMP-1表达的免疫荧光检测 取两组患者的新鲜肺组织放入EP管中,加入液氮,-80 ℃保存待用。切片前将切片机提前预冷,取出肺组织后用OCT冰冻切片包埋剂包埋,0.3 μm连续切片,丙酮固定后,-80 ℃保存待用。检测前取出切片,磷酸缓冲液洗涤后,使用0.5%细胞通透剂室温下反应30 min,加入5%BSA封闭液室温下静置30 min,滴加鼠抗人TIMP-1单克隆抗体(1∶500),4 ℃过夜,次日滴加HRP标记的山羊抗鼠的IgG(1∶2 000),室温下避光反应2 h,封片后在共聚焦荧光显微镜下观察拍照,测定450 nm波长处的荧光强度。
1.3.2 人肺成纤维细胞分离与培养 取对照组正常肺组织,放入75%乙醇溶液中浸泡3~4 s,转入含磷酸缓冲液的平皿中,使用无菌手术剪剪成直径为1 mm的正方体小块,将组织块转入6孔板中,每孔放入5~6块,加入含10%胎牛血清的DMEM培养基至浸没组织块,放入37 ℃ 10%CO2培养箱,当细胞从组织块周围爬出形成细胞岛时弃去组织块;4~5天更换一次细胞培养液,当细胞完全覆盖6孔板后进行消化传代,取第10~15代的细胞用于实验。
1.3.3 TGF-β1刺激后人肺成纤维细胞中TIMP-1 mRNA表达的RT-PCR检测 取第10~15代的人肺成纤维细胞,按6×105/孔的密切加入6孔板中,继续培养48~72 h,观察细胞铺满80%以上培养孔板底后,加入含不同浓度TGF-β1(0、1、3、5、10、15 μg/L)的无胎牛血清DMEM培养基继续培养24 h;或加入10 μg/L TGF-β1的无胎牛血清DMEM培养基分别培养0、12、24、48 h。Trizol法提取人肺成纤维细胞总RNA,逆转录得到cDNA。TIMP-1、GAPDH引物序列由上海启因生物科技有限公司设计合成。TIMP-1上游5′-GTCACT TCCACCACTTC G-3′,下游5′-GTAGTCGGCACAGATAAGG-3′;内参GAPDH上游5′-TCTGCCGTCCAGTCCAGGTG-3′,下游5′-TGTCGCTGTG GGTGAGGA GG-3′。反应条件:95 ℃ 10 min,95 ℃ 30 s,56 ℃ 30 s,共40个循环,延伸72 ℃ 20 s。扩增产物行2%琼脂糖凝胶电泳,计算TIMP-1 mRNA的相对表达量。
1.3.4 TGF-β1刺激后人肺成纤维细胞中TIMP-1蛋白表达的Western blot检测 人肺成纤维细胞铺板、计数、TGF-β1刺激同RT-PCR实验。细胞中加入全蛋白提取液,离心收集上清,BCA蛋白定量,收集目标蛋白,行SDS-PAGE凝胶电泳,转膜至PVDF,5%脱脂奶粉封闭2 h,滴加鼠抗人TIMP-1单克隆抗体(1∶500)、鼠抗人GAPDH单克隆抗体(1∶1 000),4 ℃过夜,次日滴加HRP标记的山羊抗鼠的IgG(1∶2 000),室温静置2 h,ECL显色,暗室中显影、采集图像并分析各条带灰度值。
1.3.5 Smad3过表达对细胞TIMP-1、P300 mRNA和蛋白检测 取第10~15代的人肺成纤维细胞,分别使用PCDNA3.1(+)/Smad3真核过表达载体、空质粒载体转染细胞,同时设置空白对照组,转染24 h后收集细胞。RT-PCR和Western blot检测细胞中TIMP-1、P300 mRNA和蛋白表达水平。
1.4 统计学分析
本实验数据以均数±标准差表示,进行t检验,使用SPSS23.0分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 TIMP-1在两组肺组织中荧光表达比较
共聚焦荧光显微镜下观察显示,TIMP-1为绿色荧光表达于肺组织间质,观察组荧光强度为(6.95±0.80)A.U,明显高于对照组的(1.82±0.37)A.U(P<0.05)。见图1。

图1 共聚焦荧光显微镜观察肺组织中TIMP-1荧光表达(n=6,200×)A:对照组;B:观察组
2.2 不同浓度TGF-β1对人肺成纤维细胞TIMP-1 mRNA和蛋白表达的影响
TGF-β1浓度3、5、10、15 μg/L作用于人肺成纤维细胞24 h后,TIMP-1 mRNA和蛋白相对表达量明显高于0 μg/L(P<0.05);TGF-β1浓度1μg/L作用于人肺成纤维细胞24 h后,TIMP-1 mRNA和蛋白相对表达量与0 μg/L相比差异无统计学意义(P>0.05)。见表1,图2,图3。
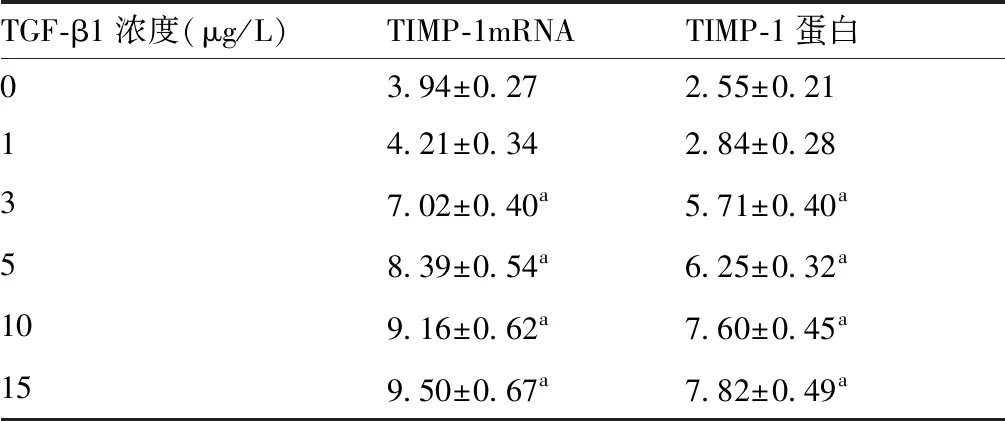
表1 不同浓度TGF-β1对人肺成纤维细胞TIMP-1 mRNA和蛋白表达的影响
与TGF-β1浓度0 μg/L比较,aP<0.05(n=6)

图2 不同浓度TGF-β1对人肺成纤维细胞TIMP-1 mRNA表达的影响(n=6)注:1~6分别为TGF-β1浓度0、1、3、5、10、15 μg/L

图3 不同浓度TGF-β1对人肺成纤维细胞TIMP-1蛋白表达的影响(n=6)注:1~6分别为TGF-β1浓度0、1、3、5、10、15 μg/L
2.3 TGF-β1不同作用时间对人肺成纤维细胞TIMP-1 mRNA和蛋白表达的影响
使用10 μg/L TGF-β1作用24、48 h时,TIMP-1 mRNA和蛋白相对表达量明显高于作用0 h时(P<0.05);使用10 μg/L TGF-β1作用12 h时TIMP-1 mRNA和蛋白相对表达量与作用0 h时差异无统计学意义(P>0.05)。见表2,图4。

表2 TGF-β1不同作用时间对人肺成纤维细胞TIMP-1 mRNA和蛋白表达的影响
与TGF-β1作用0 h比较,aP<0.05(n=6)
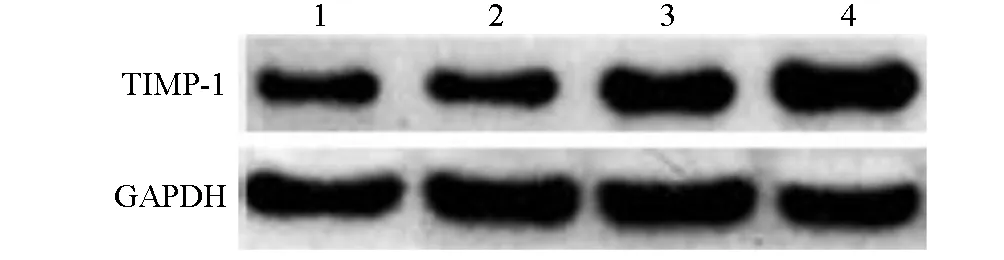
图4 TGF-β1不同作用时间对人肺成纤维细胞TIMP-1蛋白表达的影响(n=6)注:1~4分别为10 μg/L TGF-β1作用0、12、24、48 h
2.4 Smad3过表达对人肺成纤维细胞TIMP-1、P300 mRNA和蛋白表达的影响
Smad3真核过表达载体组TIMP-1、P300 mRNA和蛋白相对表达量明显高于空质粒转染组、空白对照组(P<0.05);空质粒转染组、空白对照组TIMP-1、P300 mRNA和蛋白相对表达量之间差异无统计学意义(P>0.05)。见表3,图5。
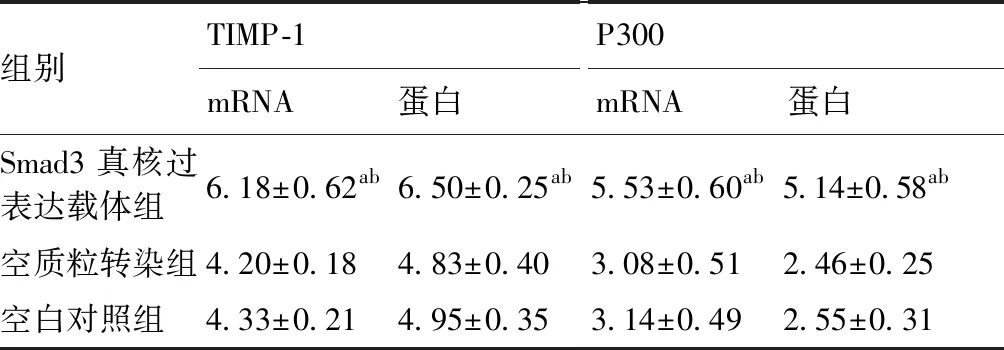
表3 TIMP-1表达对人肺成纤维细胞Smad3、P300 mRNA和蛋白表达的影响
与空质粒转染组比较,aP<0.05;与空白对照组比较,bP<0.05(n=6)
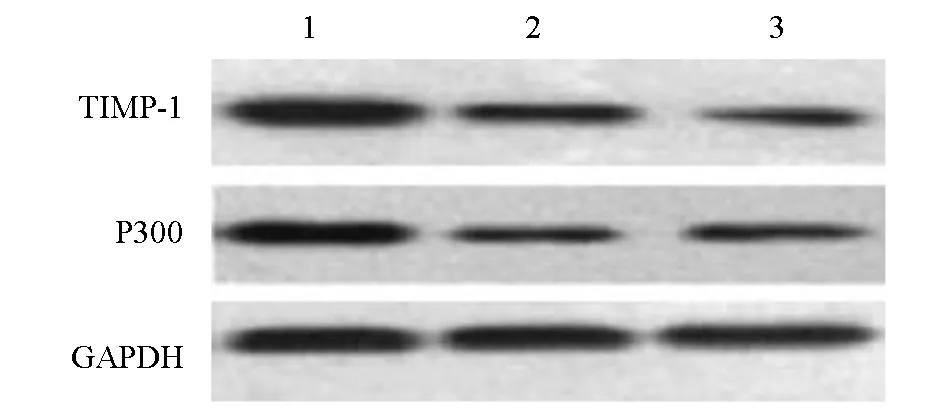
图5 各组人肺成纤维细胞TIMP-1、P300蛋白表达水平(n=6)注:1 Smad3真核过表达载体组;2空质粒转染组;3空白对照组
3 讨 论
研究者发现,MMPs与肺间质纤维明显相关[9]。基础研究显示,大鼠矽肺模型中早期MMP-9、MMP-13、TIMP-1等表达明显提升,晚期仅存在TIMP-1表达升高[10]。TIMPs是MMPS的特异性抑制因子,可降低基质溶解活性,引发胶原沉积,导致肺间质纤维化的发生[11];但在结缔组织病种的研究较少。本研究中,TIMP-1表达于肺组织间质,结缔组织病相关肺间质病变肺组织中TIMP-1表达水平明显高于正常肺组织。提示TIMP-1表达与结缔组织病相关肺间质病变相关,有可能成为治疗的潜在靶点,下调TIMP-1表达可能抑制结缔组织病相关肺间质病变。
TGF-β是胶原合成最有效的促进剂,可有效促进细胞外基质的合成与沉积,在成纤维细胞增殖中也发挥重要调控作用[12]。相关研究显示,以纤维化病变为主的结缔组织病相关肺间质病变患者外周血单核细胞中TGF-β mRNA表达水平较正常对照组明显升高[13];TGF-β1是TGF-β中活性最强、所占比例最高的亚型[14];为探究TGF-β1与TIMP-1表达的关系,本研究在体外原代培养人肺成纤维细胞,使用不同浓度的TGF-β1进行刺激,通过RT-PCR和Western blot法检测细胞中TIMP-1 mRNA和蛋白的表达水平,结果显示,随着TGF-β1浓度增加,人肺成纤维细胞中TIMP-1 mRNA和蛋白的表达水平明显升高;进一步分析TGF-β1作用不同时间对细胞中TIMP-1 mRNA和蛋白表达的影响显示,随着TGF-β1作用时间的延长,人肺成纤维细胞中TIMP-1 mRNA和蛋白的表达水平明显升高。上述结果表明,TGF-β1可上调TIMP-1表达,是TIMP-1的正向调节剂,能够促进结缔组织病相关肺间质病变的发生与发展。
相关研究显示,TGF-β1/Smad3信号通路在肺纤维化进展中发挥重要调控作用[15],其中Smad3复合物与SBE序列结合、Smad3活化与聚集均于双重效应的P300有关[16]。在肺成纤维细胞中加入TGF-β1刺激后Smad3、P300表达水平明显提升,Smad3与P300的结合也明显增加,TGF-β1/Smad3信号通路被激活,促进肺纤维化的发展[17]。本研究中Smad3真核过表达质粒转染后人肺成纤维细胞高表达P300,提示TGF-β1/Smad3信号通路被激活;且TGF-β1/Smad3真核过表达载体组TIMP-1 mRNA和蛋白表达水平明显高于空质粒转染组、空白对照组,提示TIMP-1可能通过TGF-β1/Smad3信号通路参与结缔组织病相关肺间质病变的发生与发展。

