走马胎的离体培养与快速繁殖
蔡时可,梅 瑜,顾 艳,谢梅新,王继华
(广东省农作物遗传改良重点实验室/广东省农业科学院作物研究所,广东 广州 510640)
【研究意义】走马胎(Ardisia gigantifolia)又名大叶紫金牛,为紫金牛科(Myrsinaceae)紫金牛属(Ardisia)多年生小灌木植物,其干燥根及根茎是我国传统中药材,药用历史悠久,具有很高的药用价值,是一种药用和观赏价值极高的野生植物,主要分布于广西、广东、江西和福建等地,具有很大的开发潜力[1-2]。走马胎味辛、性温,具有祛风湿、壮筋骨和活血祛痕的功效,广泛应用于跌打损伤、风湿骨痛、产后血痕和痈疽溃疡的治疗[3]。走马胎主要药用化学成分为三萜皂苷类、岩白菜素类、香豆素类、甾醇类和挥发油类等,其中三萜皂苷类和岩白菜素类在抗肿瘤、抗氧化、抗血栓等方面具有重要意义,也是目前研究的热点[4-5]。走马胎也是民间食疗的原材料,保健产品的开发不断扩展[6]。目前,市场上的走马胎主要来源于野生采挖,随着需求量的增大,导致货源紧缺,近年来市场上有用杜鹃花科和马鞭草科植物的根或茎加工混充[7-8]。而且,过度的采挖使野生资源日益缺乏、枯竭,所以急需开展走马胎的人工种植[6]。【前人研究进展】走马胎种群的分布、对光线的响应、合适的种植条件已有研究[6,9-10],但尚未见走马胎茎段繁育的报道,生产上以自然采摘的走马胎种子作为种源,多混杂,极易造成质量不稳定[6]。随着植物组织培养技术的普及,多种名贵中草药种苗已由植物工厂进行快速繁殖,如岗梅[11]、铁皮石斛[12-13]、牛大力[14]等。利用走马胎嫩叶为外植体,诱导出愈伤组织和不定芽分化途径的培养方法已成功[15],但利用茎段繁殖并开展工厂化生产走马胎种苗还未见报道。【本研究切入点】走马胎的种苗是限制其发展的根本原因,本研究对走马胎的茎段组织培养参数,外植体的消毒方法、增殖和生根培养基进行探索和优化,建立走马胎的离体培养与快速繁殖技术体系,为开展工厂化生产提供参,为人工种植提供了种苗基础缓解当前种苗不足的现状。【拟解决的关键问题】组培苗的工厂化生产影响因素主要是外植体的消毒、增殖效率和移栽成活率,获得这3个环节的最佳参数是走马胎组培苗生产的关键。
1 材料与方法
1.1 试验材料
2018年夏季在广东南雄选取生长健壮的野生走马胎植株,在广东省农作物遗传改良重点实验室培养。
1.2 试验方法
1.2.1 培养基与培养条件 (1)丛芽诱导与增殖培养基:在改良MS培养基(在原MS培养基中增加54.8 mg/L FeSO4·7H2O和8 mg/L抗坏血酸)中添加适量的6-BA、KT和IBA。(2)生根培养基:在1/2改良MS培养基中添加适量IBA及NAA。所有培养基附加蔗糖30 g/L、琼脂5.5 g/L,pH值调至5.8(±0.2),经121 ℃高压灭菌20 min。培养条件:温度28(±2)℃,光照度1 900~2 100 lx,光照时间14 h/d。
1.2.2 外植体消毒 选取健康的走马胎植株幼嫩的枝条作为外植体,将枝条切成单芽茎段,先用70%酒精浸泡30 s,用无菌水冲洗3次,每次1~3 min;再用含有吐温的0.1% HgCl2溶液处理5~11 min(设 5、7、9、11 min 4个处理),用无菌水洗涤3~5次,每次5 min。用无菌的滤纸上将茎段上的水吸干,得到消毒外植体备用。切除茎段的两端接触HgCl2溶液的部位,插入诱导培养基(改良MS+ 6-BA 0.5 mg/L +KT 0.5 mg/L +IBA 0.2 mg/L)中,每个消毒处理10个芽,培养15 d后统计污染率和萌芽率。
1.2.3 丛芽增殖 将走马胎不定芽从外植体上切下来,接种于含有不同激素浓度和种类的丛芽增殖培养基,用于继代增殖,其激素组合见表1,在继代培养基上培养20~25 d,得到走马胎的无菌丛苗。比较不同激素组合对走马胎丛芽增值的效果,统计10个芽的增殖情况。培养基以改良MS培养基为基础添加6-BA、KT和IBA。
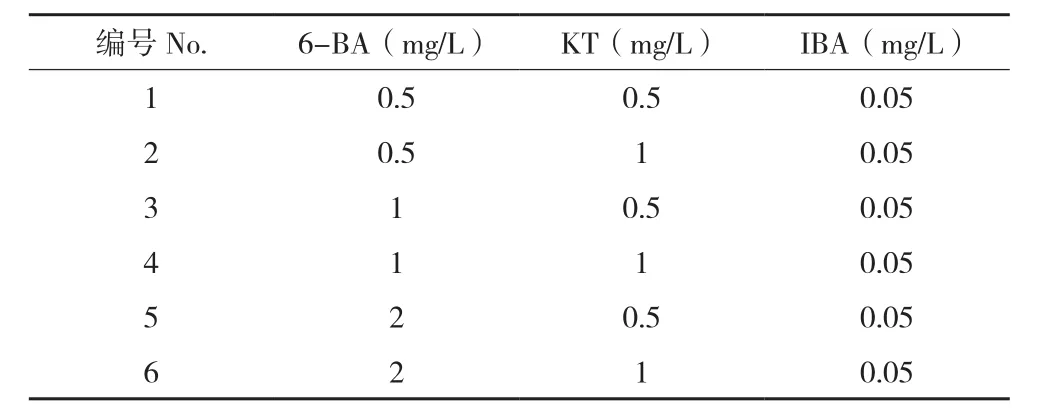
表1 不定芽不同诱导激素组合Table 1 Different hormones combination for adventitious bud induction
1.2.4 生根诱导 从增殖的丛芽上切下带有2~3个芽的茎段,插入生根培养基中,深度约0.5 cm左右。培养基以1/2改良MS为基础,添加不同浓度的NAA和IBA,浓度组合配制见表2。生根诱导培养40~50 d,统计20株的根数量和长度。
1.2.5 种植 取根长0.5 cm以上、苗高3 cm以上的走马胎再生植株进行炼苗、移栽。在室内炼苗培养3~7 d,再用自来水冲洗干净根部的培养基,0.1%多菌灵溶液中浸泡10 min,最后将苗种在消毒过的泥炭土中,保持环境湿度。

表2 根诱导激素配方Table 2 Different hormones combinnation for rooting induction
2 结果与分析
2.1 不同方法对外植体消毒效果
经过消毒处理后的走马胎茎段外植体在诱导培养基上培养7~10 d后,大部分腋芽逐渐开始恢复、出现萌动,少部分出现褐化,长出细菌和真菌,对污染率、萌芽率和死亡率进行统计,结果(表3)表明,走马胎外植体进行消毒处理5~10 min,均能获得无菌的外植体,但成功率有差异。真菌是主要的污染源,其分布在腋芽内而消毒液无法渗入,导致消毒不彻底[1]。随着消毒时间的延长,HgCl2溶液接触外植体的面积越大,消毒也越彻底,污染率略有下降,但其对外植体的伤害却迅速增加,主要表现在外植体中出现真菌的数量越来越少,但萌芽率逐渐降低,萌芽时间滞后,而且褐化、死亡率则不断上升。走马胎外植体污染率在20%~60%之间,其中消毒9和11 min 的污染率较低,为20%;消毒11 min对走马胎的毒害最为严重,萌芽率为30%,比处理10 min低100%;消毒时间7~9 min,获得无菌外植体的成功率可达到40%~60%,满足在生产上的需求。在本研究中处理1~4均能得无菌外植体,结合萌芽率和污染率等综合分析,70%酒精预处理30 s 结合0.1% HgCl2处理7~9 min的消毒方法比较合适走马胎外植体的消毒。
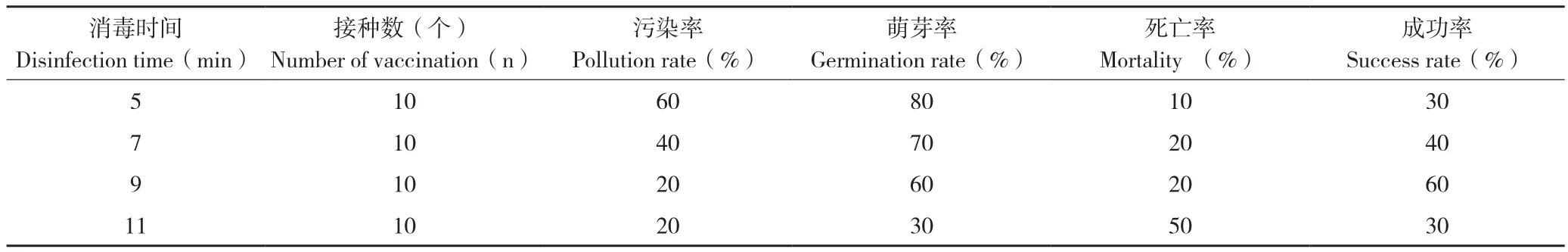
表3 不同方法对外植体消毒的效果Table 3 Effect of explants disinfection by different methods
2.2 走马胎丛芽诱导与增殖效果
通过对丛生芽继代、增殖培养,能在短期内迅速提高种苗的数量,增值效率的高低决定种苗生产的成本,是进行组培苗工厂化育苗的关键。从表4、图1可以看出,6-BA、KT和IBA的激素组合都能诱导走马胎不定芽增殖,增殖效率与培养基中6-BA浓度正相关,随着浓度的升高,走马胎的增殖效率增加,在6-BA浓度2 mg/L时增殖系数达到12左右。但是此时组培苗的不定芽数目较多,导致过于密集和细弱,质量不高,不适合进行下一代的增殖。加入KT和IBA可以改善苗的均匀性,以1 mg/L NAA、1 mg/L KT和0.05 mg/L IBA的组合较适合走马胎的增殖。

表4 不同激素组合和浓度对不定芽增殖的影响Table 4 Effect of different hormones combination and concentration on adventitious bud proliferation

图1 走马胎离体增殖结果Fig.1 Buds proliferation in vitro of Ardisia gigantifolia
2.3 生根培养效果
将含有2~3个芽的茎段接入生根培养基中,进行组培苗的生根诱导。在培养40 d后,统计生根率和根的长度。结果(表5图2)表明,采用IBA和NAA的激素组合均能诱导走马胎的生根,但是和其他草本植物相比,走马胎的生根较慢,且多为主根,侧根较少。在低浓度的激素水平下,随着激素浓度的增加根的数量也相应增加,根长增长。添加0.2 mg/L NAA和0.3 mg/L IBA的处理能促进根的数量、提高根的质量,但是随着NAA和IBA浓度的增加,走马胎诱导生根的时间也增加。表明NAA浓度增加,根数量也增加,但直径略变小,其中0.5 mg/L NAA处理比0.1 mg/L NAA处理诱导的根数量增加1.25倍,长度增加46.15%,而根直径没有明显的差异。结合出根时间和根的质量,以0.2 mg/L NAA和0.3 mg/L IBA诱导的组培苗根系较好,适合后期的移栽。
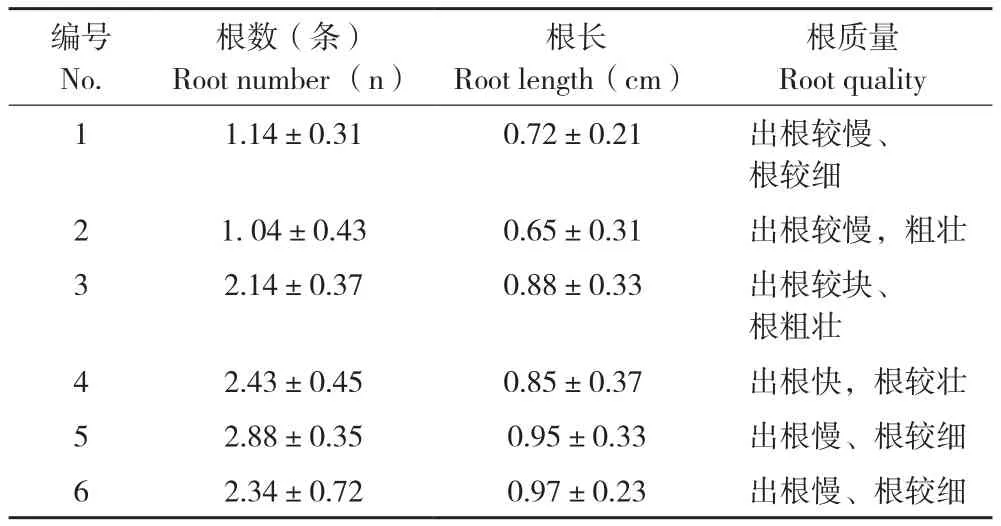
表5 不同激素对走马胎根诱导的效果Table 5 Effect of different hormones on rooting induction of Ardisia gigantifolia

图2 走马胎离体诱导生根情况Fig.2 Rooting in vitro of Ardisia gigantifolia
2.4 炼苗及移栽
生根诱导培养40~60 d,走马胎幼苗的根长0.7 cm、株高3 cm左右。通过练苗,组培苗叶片变厚,质地变硬。在移栽5 d后植株挺拔,成活率在85%以上。
3 讨论
随着人口的增长和社会对中医药事业的重视,中药材的需求日益增加,但是大量的中药材还没有开展人工栽培,大多以自然采挖为主,导致野生资源被掠夺性开发,资源濒临枯竭,同时也很难满足现代中医药产业的需求[2]。近年来,中药农业逐渐兴起,特别是在中草药的人工驯化、选育和标准化种植,不断提升了中草药的质量,缓解中药原料短缺,将产生良好的生态和经济效益[3-4]。走马胎作为一种药用历史悠久中药材,同时兼具观赏价值,但由于其生长缓慢,繁殖系数较低,建立走马胎种苗的人工快速繁殖技术可缩短育苗周期,保障种苗的质量,促进走马胎规模化、标准化种植,彻底市场紧缺的困境[5],同时,也有效保护野生走马胎的种子资源,有助于走马胎资源的稳定。
持续提供大量的种苗是进行规模化种植的基础,在走马胎生产上具有重要的意义[6]。目前植物组织培养快速繁殖在技术上非常成熟,在种苗生产中,种性稳定,保持母本优良性状是进行工厂化生产的前提,器官发生途径的变异要较愈伤组织途径低,因而在生产上大多采用茎段繁殖[7]。在生产中,无菌外植体的获得和高增殖效率是制约组培快繁的两个主要因素[8]。HgCl2在外植体消毒中应用最为广泛,但是受到环境保护的限制,酒精、84消毒液和次氯酸钠等消毒剂的应用频率开始增加[9-11]。在中草药植物的组培中,材料纤维化程度、表面是否有绒毛、蜡质,特别是生理状态等因素都会影响外植体消毒的效果[12-14]。走马胎和其他木本植物植物一样,嫩茎在0.1%HgCl2处理7~9 min进行消毒较适合。6-BA和KT是在增殖过程中常用的细胞分裂素,在生根诱导方面则主要为生长素。不同的植物对激素的敏感性存在较大差异,一般通过梯度设计得到适合的配方[15,16]。本试验结合以往的研究,通过设置6-BA和KT的浓度,得到走马胎的增殖体系。生长素中的NAA和IBA较为稳定,常用与生根诱导,两者的配合使用可以大大改善根的形态,诱导得到健壮的走马胎的根[17]。组织培养快繁技术能提供大量优质的走马胎种苗,满足市场需求,保护野生资源不受破坏,促进其在中医药产业中更好的应用。
4 结论
本研究建立的走马胎组培苗生产技术体系,包括嫩茎经过70%酒精处理30 s结合0.1% HgCl2处理7~9 min的消毒方法,优化了改良MS培养基+ 6-BA 1.0 mg/L+KT1 mg/L +IBA 0.05 mg/L的不定芽的增殖培养基和1/2改良MS培养基+ NAA 0.2 mg/L +IBA 0.3 mg/L的生根培养基配方。通过建立走马胎的离体培养与快速繁殖方法,能够开展工厂组培苗的生产,为人工种植提供充足的种苗,满足生产需求。

