芬必得对大鼠腰椎间盘突出症模型的疗效评价*
陈迪新 李瑞鹏 欧慧瑜 邵珍怡 郭秋平
(1.广州医药研究总院有限公司药物非临床安全评价研究中心,广州 510240)(2.中国中医科学院博士后科研流动站,北京 100700)(3.广州医药集团有限公司博士后科研工作站,广州 510130)
椎间盘由纤维环、髓核和软骨终板构成一个无血管、低氧、低营养、低细胞结构和酸性的环境[1]。遗传易感性、不适当的负重、营养缺失、肥胖或者其他疾病导致了髓核细胞凋亡、纤维环破裂,炎性因子和基质金属蛋白酶(Matrix metalloproteinases,MMPs)增多,免疫细胞浸润,神经增生和血管增生,最终造成腰椎间盘的退化。其中,髓核细胞凋亡、髓核细胞和纤维环炎性因子和基质金属蛋白酶表达上调,免疫细胞浸润是病变的关键进程。临床研究标明,腰椎间盘突出症(Lumbar Disc Herniation,LDH)神经根症状不仅与椎间盘突出的位置、大小有关,也和炎症反应程度密切相关[2]。炎症被认为是诱发神经根症状的重要因素,炎症因子的增加,COX-2/PGE2(cyclooxygenase-2/Prostaglandin E2)通路的激活,增加了神经的敏感性,从而导致过敏性疼痛[3-4]。病人椎间盘组织PGE2含量明显升高,与LDH神经根症状呈正相关。在临床中使用COX抑制剂通过抑制COX活性减少前列腺素的合成,起到缓解疼痛,改善椎间盘退化作用,被较多地用于椎间盘突出症患者的保守治疗[5]。目前LDH患者治疗情况常常比较复杂,临床干预研究方法难以准确反应COX抑制剂对LDH的影响。因此选取合适的腰椎间盘突出症动物模型,用于评价COX抑制剂对疾病的疗效,对临床COX抑制剂的选用有指导性意义[6-8]。本模型使用的是压迫与炎性刺激共存型,即使用压迫与炎性刺激共存的方法对大鼠进行建模,能够较贴切地模拟人类腰椎间盘突出症的发病机制[9-11]。此类模型可以较好地诱导出大鼠神经行为的改变,对大鼠损伤小,更加接近于临床。
1 材料与方法
1.1 材料及试剂
0.5%羧甲基纤维素钠(CMC-Na)(分析纯),生产厂家为天津市大茂化学试剂厂。芬必得,生产厂家为中美天津史克制药有限公司。PGE2、COX-2、IL-1、IL-6、NO试剂盒,购买自武汉伊莱瑞特生物科技股份有限公司。戊巴比妥钠:规格为25 g/瓶,德国默克公司(北京华美生物科技技术有限公司分装)。
1.2 方法
1.2.1大鼠腰椎间盘突出症模型构建:实验选用雄性、体质量为(180±20)g的SPF级SD大鼠60只(购于湖南斯莱克景达实验动物有限公司),SPF级动物房常规饲养3 d后,分为3组(20只/组),分别为假手术组、模型组、模型加芬必得给药组(简称芬必得组)。模型组与芬必得组分组后,大鼠腹腔注射2%戊巴比妥钠(3 mL/kg)麻醉,俯卧固定,碘酒、酒精依次消毒,以L5/L6棘突间隙为中心,取后背正中切口约4 cm,逐层切开皮肤及皮下组织,分离腰椎旁肌,深达椎板,暴露L5的横突和椎间孔[12-13]。将直径为0.8 mm,长度为4 mm的L形钛棒在L5椎间孔以背中线约30°~40°和-10低于椎体水平线15°角度约4 mm进入椎间孔。当钢棒压迫神经节,同侧后肢肌肉通常表现出一、两次轻微的抽搐。另在大鼠背正中以腰椎L5~L6为中心切口,以手术刀做一长约2 cm 纵形切口,组织钳向切口两侧牵开皮肤及皮下组织,以血管钳分离显露鼠尾2个节段的椎间纤维环。以手术刀尖于纤维环上做一切口,挤压鼠尾椎间,可见清亮胶冻状髓核组织于纤维环切口处突出。用刮匙刮出2节段髓核,移除大鼠背部伤口覆盖物,以镊子夹持髓核组织小心移植于L5椎间孔内。放置后,对背部肌肉和皮肤逐层进行缝合,且对尾部切口也进行缝合。假手术组动物仅不取出、放置尾部椎间盘髓核及不放置L型钢棒,其余操作与模型组与芬必得组相同。造模完成,每只动物的右侧肌肉均连续注射3 d青霉素,以防感染。造模期间(T1~T7),对每只动物的左下肢进行运动功能评分;造模第8天(T8),选用运动功能评分≥1的动物进行灌胃给药(每组选择16只动物);否则剔除。试验期间,对每只动物的左下肢定期进行运动功能评分、机械刺激回缩反应测定、大腿周径测量。连续给药28 d,末次给药后1 h全部麻醉后放血处死,取L4~L6腰椎及其神经、用4%甲醛溶液进行固定后进行病理组织学检查或进行组织炎性细胞因子检测。
1.2.2运动功能评分观察:按表1,对造模动物的左后肢(造模足)的运动功能进行观察并评分。
1.2.3机械性缩足反射阈值的测定:用von Frey细丝以up-and-down 法推算50%缩足阈值:将动物置于金属筛网上,安静5 min后使用不同克数的Von Frey 纤维细丝(1、1.4、2、4、6、8、10、15、60 g等)垂直刺激大鼠左后肢手术侧足底中部,持续时间≤4 s,大鼠出现抬足或舔足行为视为阳性反应,反之为阴性反应。测定首先从2 g开始,当此力度的刺激不能引起阳性反应,则给予相邻大一级力度的刺激;如出现阳性反应则给予相邻小一级力度的刺激,如此连续进行,直至出现第1次阳性反应和阴性反应的交界值,再连续测定4次。若动物的足部反应>60 g,均以60 g计;若动物的足部反应<1 g,均以1 g计[14]。

表1 动物运动功能评分表Table 1 Animal motor function score sheet
1.2.4坐骨神经功能评价:
A.大腿关节周径测定:采用游标卡尺,测量各组动物左右后肢的大腿关节周径。
B.SFI(坐骨神经功能指数):先进行步态测量:自制大鼠足印行走箱[15]:选用一个规格为80 cm×12 cm×15 cm亚克力透明盒子(上部开放),然后选用一个规格为70 cm×20 cm的镜子,倾斜45°放在中间。将大鼠放在行走箱一端,让大鼠自行走向箱的另一端,若大鼠中途停止,重新放置起点让其自行走。在上述自制装置的正前方约1.5 cm处,调整好高度使镜子反射出的图像正好与高清数码相机平行,然后拍摄大鼠的行走视频。获取SFI参数:将录制的视频用Photoshop软件打开,然后缓慢拖动视频时间轴直到出现清晰的大鼠后足底部时用软件中“测量工具”测量其长度、足宽度和中间趾宽度,计算其SFI (Sciatic nerve function index)。
SFI=-38.3(EPL-NPL)/NPL+109.5(ETS-NTS)/NTS +13.3(EIT-NIT)/NIT-8.8(E:实验侧足;N:正常侧足;PL(足趾长度):足跟到足尖的最长距离;TS(足趾宽度):第1~5趾连线的最长距离;IT(中间足趾距离):第2~4趾连线的最长距离。)
1.2.5血清PGE2、COX-2、IL-1β (Interleukin-1β)、IL-6 (Interleukin-6)、NO (Nitric oxide)检测:腹主动脉取血。采血管的采血量应多于4 mL,血液在室温存放30 min至1 h,将采血管用2 000 g相对离心力,20 ℃离心15 min取血清。采用ELISA进行浓度测量。
1.2.6椎间管神经根PGE2、COX-2、IL-1、NO检测:取压迫处椎间管神经根(约1 cm)进行组织匀浆,ELISA进行浓度检测。
1.2.7对造模处神经根及椎间盘进行制片:组织标本经取材、固定、(椎间盘脱钙)、修块、流水冲洗、脱水、透明、浸蜡、石蜡包埋后,石蜡切片,HE染色、封片。镜检:采用BX43型OLYMPUS®生物显微镜观察和记录背根神经节及椎间盘组织结构及细胞形态(背根神经节×400,椎间盘×40)。
1.3 统计方法
2 结果
2.1 压迫L5背根神经节及移植自体髓核诱导大鼠腰椎间盘突出症相关症状
如图1所示,用L型钢棒压迫大鼠L5背根神经节,并移植自体髓核至背根神经节进行造模,模型大鼠在术后表现出坐骨神经过敏性疼痛相似表现:造模侧后爪经常从地板上抬起,在静息状态常见舔造模侧后爪的行为,在行走时造模侧后爪缓慢放置,移动缓慢。严重时造模侧后爪外翻,可出现拖行及抬起造模侧后爪跳走的行为。

图1 压迫与炎性刺激构建腰椎间盘突出症大鼠模型注:A:腰椎间盘突出症大鼠模型构建方法示意图;B:假手术组(Sham)大鼠左后肢 vs.腰椎间盘突出症模型组(LDH)大鼠左后肢Fig.1 Compression and inflammatory stimulation to construct a rat model of lumbar disc herniationNote:A,schematic diagram of the construction method of rat model of lumbar disc herniation;B,left hind limb of sham operation group (Sham)rat vs.lumbar disc herniation model group (LDH)
2.2 芬必得降低腰椎间盘突出症大鼠的运动功能评分
运动功能评分用于描述模型大鼠的运动功能状态,评分越高,动物运动功能状态越差。如图2所示:造模第8天(T8),假手术组、模型组、芬必得组的运动功能评分分别是0.00±0.00、1.69±0.70、1.63±0.81。与假手术组相比,造模动物的运动功能评分均明显升高(P<0.05),造模动物各组运动功能评分无明显差异。T22和T34,与模型组(T22和T34∶1.31±0.48、0.75±0.68)相比,芬必得(T22和T34∶0.75±0.86、0.31±0.48)显著降低运动功能的评分(P<0.05)。

图2 芬必得对腰椎间盘突出症大鼠运动功能评分的影响注:Tn表示造模后第n天;n=16;*P<0.05Fig.2 Effect of Fenbid on motor function score in rats with lumbar disc herniationNote:Tn indicates the nth day after modeling;n=16;*P<0.05
2.3 芬必得提高腰椎间盘突出症大鼠的机械性缩足反射阈值
机械性缩足反射阈值作为常用的神经病理性疼痛行为学的观测指标,能够反映动物机械性刺激诱发的过敏疼痛程度,阈值降低,说明动物产生机械性过敏性疼痛。如图3所示:造模第8天,与假手术组(16.46±7.00 g)相比,造模动物(模型组、芬必得组)的机械性缩足反射阈值均明显降低(P<0.05),分别是(5.02±2.00)g、(6.02±2.47)g,造模动物各组机械性缩足反射阈值无明显差异。T34,与模型组(7.32±1.06)g相比,芬必得(8.98±2.68)g显著升高模型动物的机械性缩足反射阈值(P<0.05)。

图3 芬必得对腰椎间盘突出症大鼠机械性缩足反射阈值的影响注:Tn表示造模后第n天;n=16;*P<0.05Fig.3 Effect of Fenbid on the mechanical paw withdrawal reflex threshold in rats with lumbar disc herniationNote:Tn indicates the nth day after modeling;n=16; *P<0.05
2.4 芬必得提高腰椎间盘突出症大鼠的坐骨神经功能
压迫型腰椎间盘突出症模型通过压迫背根神经节从而影响动物的坐骨神经功能。大腿周径比值(造模侧/对侧)是评价坐骨神经功能的间接指标。大腿周径比值(造模侧/对侧)下降,说明坐骨神经损伤,坐骨神经支配肌肉群萎缩。如图4 A所示:造模第22天,与假手术组(0.99±0.0)相比,造模动物的大腿周径比值(造模侧/对侧)明显降低(P<0.05)。T34,与模型组(0.82±0.10)相比,芬必得(0.89±0.05)显著升高模型动物的大腿周径比值(造模侧/对侧)(P<0.05)。
步态测量实验中坐骨神经功能指数(SFI)用于评价坐骨神经的损伤。SFI=0为正常,-100为完全损伤。如图4B所示:造模第8天,与假手术组(-11.97±2.8)相比,造模动物的SFI值明显降低(P<0.05)。T22和T34,与模型组(T22和T34:-43.20±10.80、-43.37±22.51)相比,阳性药芬必得(T22和T34:-30.67±11.64、-20.33±29.30)显著升高模型动物的SFI值(P<0.05)。

图4 芬必得对腰椎间盘突出症大鼠坐骨神经功能的影响注:Tn表示造模后第n天;n=16;*P<0.05Fig.4 Effect of Fenbid on the sciatic nerve function in rats with lumbar disc herniationNote:Tn indicates the nth day after modeling;n=16;*P<0.05
2.5 芬必得改善腰椎间盘突出症大鼠的神经根病变及椎间盘病变
2.5.1背根神经节病理检查结果;如图5A所示,假手术组背根神经节结构完整,节细胞呈圆形或卵圆形,胞核大而圆、核仁清晰,胞浆内可见较多尼氏小体;节细胞周围可见扁平或椭圆形卫星细胞环绕,节细胞间可见神经纤维及少量结缔组织、小血管。模型组可见不同程度节细胞及轴突变性,主要表现为节细胞体积减小、嗜酸性增强、排列疏松,部分节细胞核膜模糊,尼氏小体细小、稀疏,个别节细胞胞质内见较大圆形空泡;节细胞周围巨噬细胞数量增加,轴突嗜酸性增强、呈空泡状、排列疏松。芬必得组可见节细胞及轴突变性,病变与模型组相似,但程度较轻。
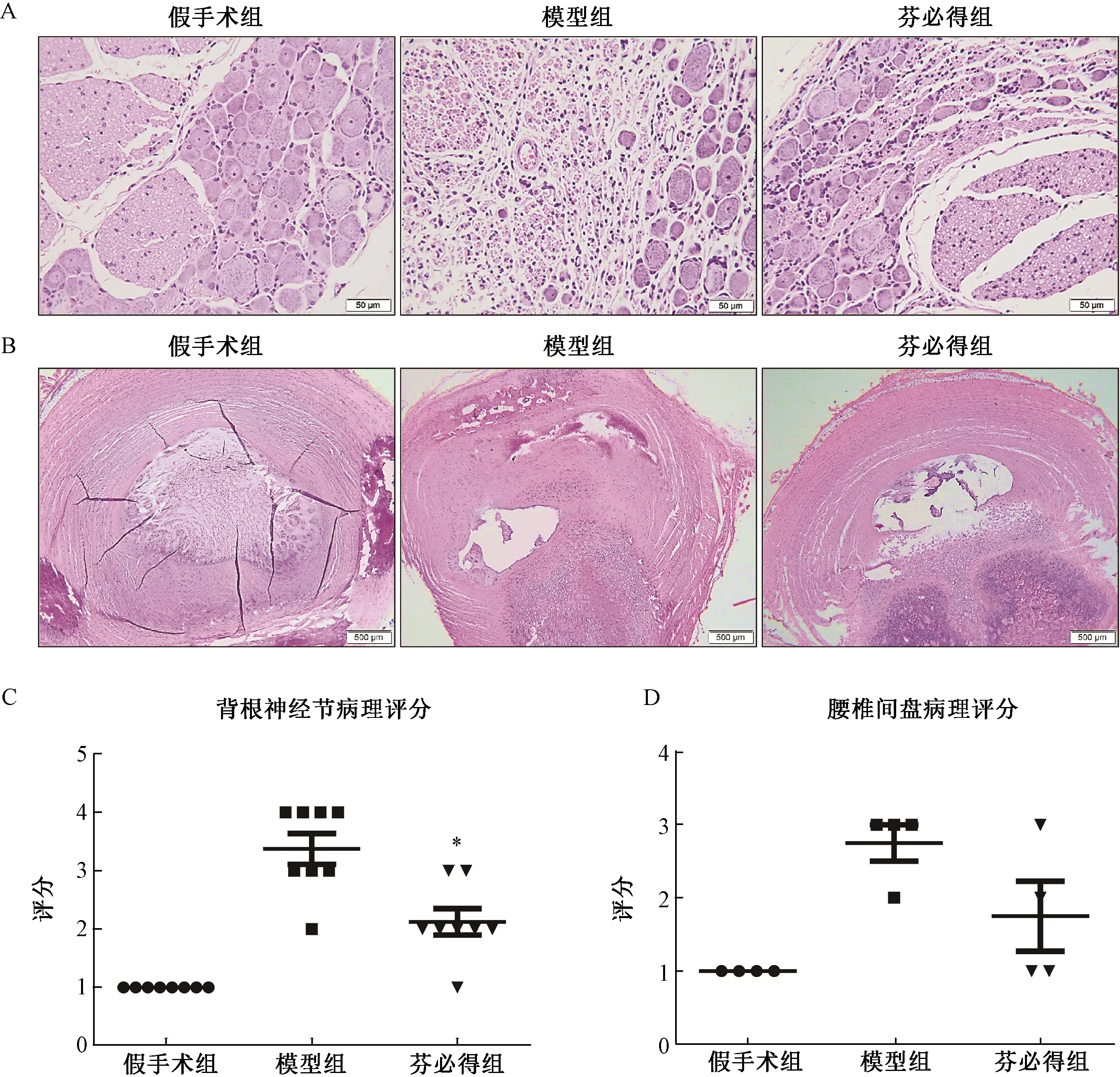
图5 芬必得对腰椎间盘突出症大鼠神经根及椎间盘病理变化的影响注:A:各组大鼠背根神经节组织HE染色结果;B:各组大鼠椎间盘组织HE染色结果;C:各组大鼠背根神经节组织病理评分,n=8;*P<0.05;D:各组大鼠椎间盘组织病理评分,n=4Fig.5 Effect of Fenbid on the pathological changes of nerve root and intervertebral disc in rats with lumbar disc herniationNote:A:HE staining results of dorsal root ganglion tissue in each group of rats;B:HE staining results of intervertebral disc tissue in each group of rats;C:Histopathological score of dorsal root ganglion in each group,n=8; *P<0.05;D:Histopathological score of intervertebral disc in each group,n=4
2.5.2椎间盘病理检查结果:如图5B所示,假手术组椎间盘结构完整,纤维环排列整齐、呈同心圆状环绕于髓核外,两者界线清晰;髓核内见大量黏液样基质及脊索细胞、少量软骨样细胞。模型组可见不同程度退行性变化,主要表现为髓核体积减小、基质成分及脊索细胞减少、类软骨细胞数量增加,部分动物可见髓核位置偏移、局部凸出、压迫纤维环,被压迫部位纤维环排列紊乱。芬必得组检查可见不同程度退行性变化,病变与模型组相似,但程度较轻。
2.6 芬必得降低腰椎间盘突出症大鼠的血清炎性相关因子
组织损伤及炎性反应可通过促炎因子等促进COX-2在损伤的局部组织和全身大量表达,诱导PGE2上调,相反COX-2/PGE2通路的激活也会导致炎性细胞因子IL-1β、IL-6等表达上调。如表2所示:与假手术组相比,模型组动物血清的COX-2、PGE2、IL-1β、IL-6、NO浓度明显升高(P<0.05)。与模型组相比,阳性药芬必得组动物血清的COX-2、PGE2、IL-1β、IL-6、NO浓度明显降低(P<0.05)。
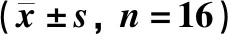
表2 芬必得对腰椎间盘突出症大鼠的血清IL-1β、IL-6、NO、COX-2、PGE2的影响Table 2 Effect of Fenbid on serum IL-1β,IL-6,NO,COX-2 and PGE2 in rats with lumbar disc
注:与假手术组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01
Note:compared with the sham operation group*P<0.05,**P<0.01;compared with the model group,#P<0.05,##P<0.01
2.7 芬必得降低腰椎间盘突出症大鼠的背根神经节病变处炎性相关因子
如表3所示:与假手术组相比,模型组动物背根神经节病变处的COX-2、PGE2、IL-1β、NO浓度明显升高(P<0.05)。与模型组相比,阳性药芬必得动物背根神经节病变处的COX-2、PGE2、IL-1β、NO浓度明显降低(P<0.05)。
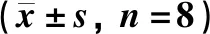
表3 芬必得对腰椎间盘突出症大鼠的背根神经节病变处IL-1β、NO、COX-2、PGE-2的影响Table 3 Effects of Fenbid on IL-1β,NO,COX-2 and PGE2 in the dorsal root ganglion lesions of rats with lumbar disc n=8)
注:与假手术组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01
Note:compared with the sham operation group*P<0.05,**P<0.01;compared with the model group,#P<0.05,##P<0.01
3 讨论
腰椎间盘突出症最基本的病因是腰椎间盘的退行性改变,在退行性改变的基础上,由于劳累、外伤等因素使腰椎间盘发生结构等改变,纤维环破裂,髓核向外膨出或脱出,压迫神经根或脊髓导致腰腿疼痛等症状。目前报道的LDH模型有多种,包括纤维环针刺损伤建模、手术损伤脊椎结构建模、化学损伤法、单纯炎性刺激型模型、压迫背根神经节模型、及压迫与炎性刺激共存型。其中压迫与炎性刺激共存型能够较贴切地模拟人类腰椎间盘突出症的发病机制。本实验通过L型钢棒经椎间孔对背根神经节进行压迫,同时使用自体尾椎髓核移植到背根神经节处,成功构建了压迫与炎性刺激共存型大鼠腰椎间盘突出症模型。模型大鼠表现出行为学评分变化、过敏性疼痛、坐骨神经功能指数下降及椎间盘病理性变化。利用此模型可用于缓解疼痛及改善退行性变药物的评价。
腰椎间盘突出症(Lumbar Disc Herniation,LDH)所致坐骨神经痛等过敏性疼痛症状与炎症反应程度密切相关。研究表明PGE2含量明显升高,与LDH神经根症状呈正相关。前列腺素E2(PGE2)是一种主要的增强疼痛的炎症介质,由花生四烯酸通过一系列酶包括环氧合酶(COX)产生。组织损伤和炎症导致COX-2(诱导型COX诱导型异构体)局部大量诱导表达。另外,外周炎症通过IL-1β诱导COX-2在脊髓背角神经元中的中枢作用。COX-2/PGE2通路的激活,增加了神经的敏感性,从而导致过敏性疼痛。临床上NSAIDs (非甾体类抗炎药,Non-Steroid Anti-Inflammtory Drugs)和COX-2抑制剂能减轻部分急性下腰痛患者的疼痛。另外COX-2也参与退化过程的PGE2的产生,该过程可能促进腰椎间盘退行性变。因此在临床中使用COX抑制剂通过抑制COX活性减少前列腺素的合成,起到缓解疼痛,改善椎间盘退化作用,被较多地用于椎间盘突出症患者的保守治疗。本实验对COX抑制剂芬必得治疗腰椎间盘突出症的疗效进行了评价,结果显示COX抑制剂可改善腰椎间盘突出症模型大鼠的过敏性疼痛及椎间盘退行性变,与文献报道一致。

