小鼠慢性肝损伤周期性病变研究
孟 霞 李 梦 翟亚南 卢 静
(首都医科大学实验动物部,北京 100069)
CCl4是经典的实验性肝损伤外源性化合物,低剂量反复刺激可诱导慢性肝损伤[1-2]。目前关于CCl4慢性肝损伤模型的机制研究很多[3-6],但是对于成模后肝损伤变化规律的研究很少,是持续性损害加深还是阶段性的损害与修复交替变化,对于CCl4慢性肝损伤模型的实际应用至关重要,直接关系到相关机制研究和药性评价的可靠性。通常情况下CCl4慢性肝损伤模型的研究多参考CCl4急性肝损伤模型的研究方法,慢性染毒一段时间后,当血清、组织学等发生病变时即确定造模成功,继而研究相关机制及药效评价[7]。但是这种方法忽略了慢性染毒本身的特点:一方面,CCl4慢性肝损伤模型注射的CCl4浓度、剂量小,造成的肝损伤程度小,病程长;另一方面,肝脏是人体最大的解毒器官,具有很强的自愈再生能力。因此,在慢性染毒造模的几周内,肝损伤所致的血清、病理学改变是持续性稳定增长,还是出现时而病变严重时而自愈缓解式的波动性变化就显得至关重要。如果肝损伤是波动性变化,那么CCl4慢性肝损伤模型所反映出的将是一个明显的“损伤—修复”交替主导的复合模型,与CCl4急性肝损伤模型所反映的以损伤为主导的单一模型将有很大区别。在损伤期内,病理变化以炎性细胞浸润和肝细胞变性坏死为主,病理机制以损伤为主导,适合进行与炎性反应、细胞损伤坏死有关机制研究;在修复期内,病理变化以肝细胞再生为主,病理机制以细胞增殖再生为主导,适合进行与肝细胞增殖再生有关机制研究。这就导致在选用该模型进行研究肝脏损伤或者修复机制研究、药物筛选过程中,必须选取相应的病理变化主导期进行评价,才能确保实验结论的真实有效性。基于以上思考,开展相关实验,现报道如下。
1 材料与方法
1.1 实验动物
SPF级BALB/c小鼠125只,雄性,体质量18~20 g,购于北京维通利华实验动物科学技术有限公司[SCXK(京)2012-0001],在首都医科大学实验动物部屏障环境 [SYXK(京)2015-0012] 饲养。所有实验操作程序均经过首都医科大学实验动物伦理委员会批准(批准号为AEEI-2015-020)。
1.2 实验试剂
CCl4溶液购自北京现代东方精细化学品有限公司。Masson 染色试剂盒购自南京建成科技有限公司,20100318。
1.3 模型制备
正常BALB/c小鼠常规饲养1周后,腹腔注射0.5% CCl4溶液(0.75 mL CCl4原液加入149.25 mL花生油),10 μL/g体质量,1次/3天,持续10周。注射第2、4、6、8、10周后,随机抽取小鼠,取血检测血清ALT、AST,取肝脏固定后HE、Masson染色,观察小鼠肝脏结构、细胞形态、纤维化程度。
1.4 样本处理
注射第2、4、6、8、10周后,随机抓取小鼠(n=25)腹腔注射1%戊巴比妥钠麻醉(40 mg/kg体质量);麻醉后,眼眶静脉丛采血法采血;采血后,离心取血清(3 000 g/min,10 min);采血后,颈椎脱臼安乐死并摘取肝脏;剪取肝脏最大叶,置于4%多聚甲醛溶液中固定,常规方法脱水、透明、包埋后制成蜡块并切片备用。
1.5 AST、ALT检测
日立7180全自动血生化仪检测AST、ALT血清浓度。
1.6 肝脏组织石蜡切片HE染色及Masson染色
将肝脏组织石蜡切片进行水化处理后,分别使用常规法进行HE染色处理及Masson染色试剂盒进行Masson染色处理,中性树胶封片后使用Nikon数字显微照相机拍摄照片。
1.7 肝纤维化程度评判
Masson染色半定量分析:Masson染色切片,50 μm倍光镜下,使用Nikon数字显微照相机进行吸光度(IOD)测量,每组随机选取10个视野。
1.8 肝组织炎性细胞浸润、坏死肝细胞(玻璃样变)、正常肝细胞测定方法
HE染色半定量分析:HE染色切片,50 μm倍下光镜拍照,使用ipp6.0图像分析软件进行分析。
1.8.1炎性细胞、正常肝细胞测定:炎性细胞与正常肝细胞细胞核在HE染色下均为深蓝染,但二者细胞核大小差异较大,选取蓝染区域后,限定选取区域像素为0~600可在点选蓝染范围内筛选出炎性细胞;限定选取区域像素为800~3 000可在点选蓝染范围内筛选出正常肝细胞,然后计算点选区域细胞核总像素。
1.8.2坏死肝细胞(玻璃样变)测定:玻璃样变为明显深红色均质染色,点选深红染色区域后,计算点选区域总像素。
1.9 统计方法
2 结果
2.1 血清ALT、AST变化
注射CCl4溶液2周后,小鼠ALT、AST轻度升高,提示肝细胞轻度损伤;注射4周后ALT、AST升高极为显著,提示肝细胞损伤严重;注射6周后ALT、AST基本恢复正常;注射8周后ALT、AST再次轻度升高,提示肝细胞轻度损伤;注射10周后ALT、AST再次极显著性升高,提示肝细胞损伤严重,见图1。

图1 B/c小鼠血清ALT、AST浓度(IU/L)注:两组间比较,**P<0.01Fig.1 B/c mouse serum levels of ALT and AST(IU/L)Note:compared with two groups,**P <0.01
2.2 病理学观察
HE染色显示在注射CCl4溶液0~10周的时间内,小鼠肝细胞出现明显周期性损害,分别依次出现肝细胞变性期、坏死期、缓解期、肝细胞变性期、坏死期。2周时,肝细胞损害以变性为主,表现为肝细胞不典型空泡样变性和大量炎性细胞浸润;4周时,肝细胞损害以坏死为主,表现为大量深红色玻璃样变性及炎性细胞浸润减少;6周时,肝细胞损害明显缓解,仅存少量玻璃样变性及炎性细胞浸润;8周时,肝细胞损害再次以变性为主,表现为肝细胞大量空泡样变性和炎性细胞浸润;10周时,肝细胞损害再次以坏死为主,表现为大量深红色玻璃样变性及炎性细胞浸润减少,见图2~5。

图2 B/c小鼠肝组织HE染色注:(A、B、C、D、E为100 μm,a、b、c、d、e为50 μm),A、a是2周,B、b是4周,C、c是6周,D、d是8周,E、e是10周)Fig.2 Histology of the B/c mouse liver tissues.HE staining.Note:(A,B,C,D,E:100 μm.a,b,c,d,e:50 μm).A,a:2 weeks.B,b:4 weeks.C,c:6weeks.D,d:8weeks.E,e:10 weeks
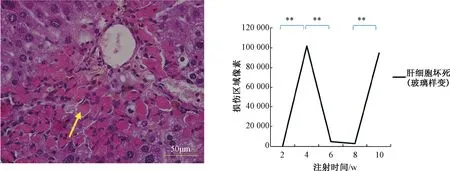
图3 B/c小鼠肝脏肝细胞坏死注:两组间比较,**P<0.01;箭头指示为肝细胞玻璃样变性Fig.3 B/c mouse hepatocyte necrosisNote:compared with two groups,**P<0.01;the arrow indicates hyaline degeneration of hepatocytes

图4 B/c小鼠肝脏肝细胞注:两组间比较,**P<0.01;箭头指示为正常肝细胞Fig.4 B/c mouse hepatocyteNote:compared with two groups,**P <0.01;the arrow indicates normal hepatocytes
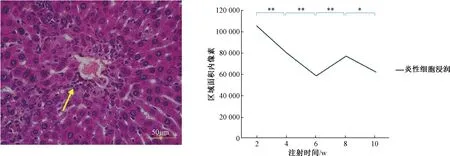
图5 B/c小鼠肝脏炎性细胞浸润注:两组间比较,**P <0.01,*P <0.05;箭头指示为炎性细胞浸润Fig.5 B/c mouse inflammatory cell infiltration of the liverNote:compared with two groups,**P <0.01,*P <0.05;the arrow indicates inflammatory cell infiltration
Masson染色显示在注射CCl4溶液0~10周的时间内,小鼠肝组织内胶原蛋白、纤维沉积随肝细胞损害出现明显周期性变化。2周时,当肝细胞损害以空泡变性为主时,损伤区域出现淡蓝染胶原蛋白沉积;4周时,当肝细胞损害以坏死为主时,损伤区域淡蓝染胶原蛋白沉积逐步积聚为深蓝染条索状胶原纤维沉积;6周时,当肝细胞损害明显缓解时,深蓝染条索状胶原纤维逐渐向淡蓝染胶原蛋白转化;8周时,当肝细胞损害再次以脂肪变性为主但未发生坏死时,胶原纤维继续向胶原蛋白弱化;10周时,当肝细胞损害再次以坏死为主时,胶原蛋白开始逐步向胶原纤维沉积强化,见图6~7。

图6 B/c小鼠肝组织Masson染色注:A、B、C、D、E为100 μm,a、b、c、d、e为50 μm,A、a是2周,B、b是4周,C、c是6周,D、d是8周,E、e是10周Fig.6 Histological changes of the B/c mouse liver tissues.Masson stainingNote:A,B,C,D,E:100 μm.a,b,c,d,e:50 μm.A,a:2 weeks.B,b:4 weeks.C,c:6weeks.D,d:8weeks.E,e:10 weeks
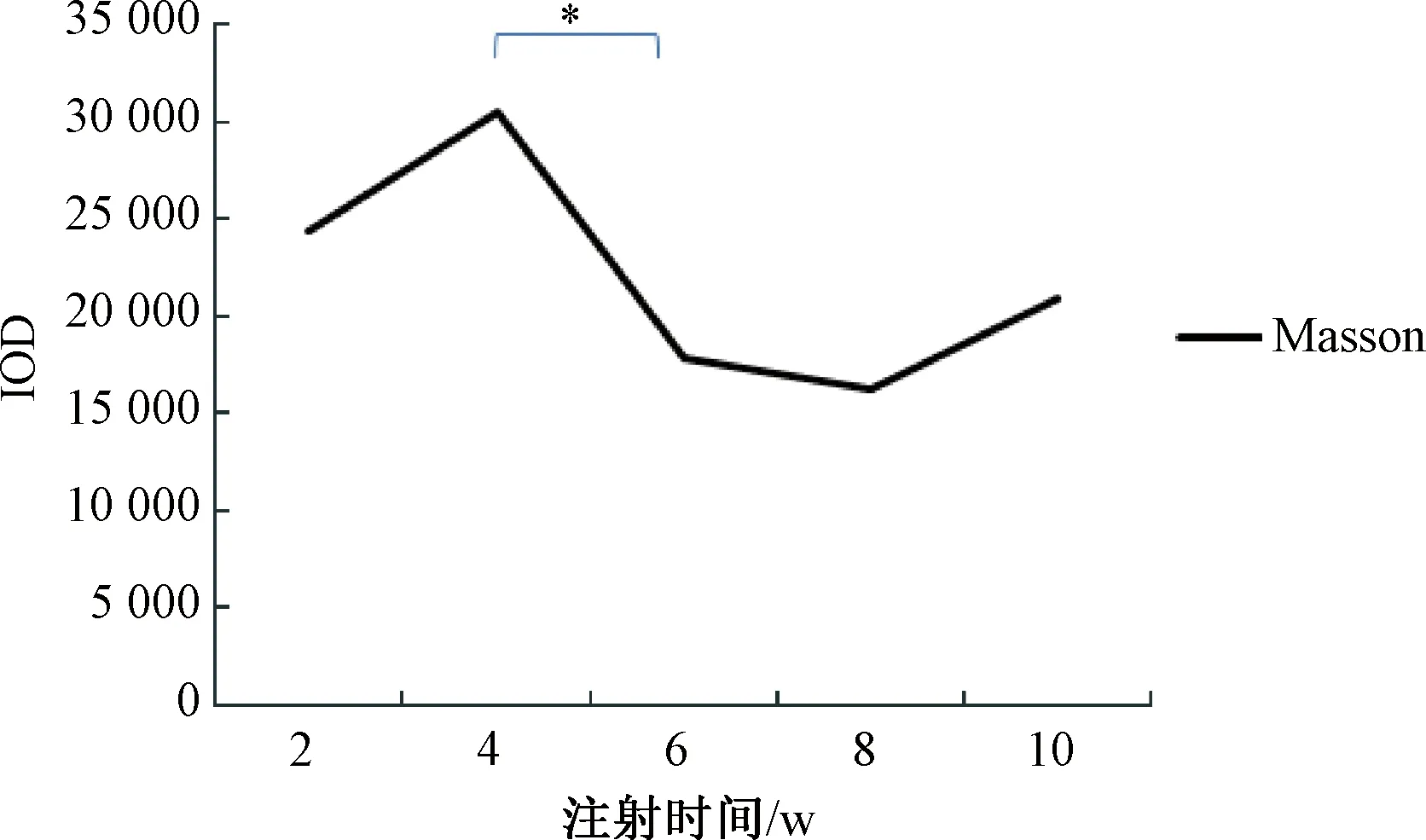
图7 B/c小鼠肝脏Msson染色注:两组间比较,*P<0.05Fig.7 Histological changes of the B/c mouse liver tissues.Masson stainingNote:compared with two groups,*P<0.05
3 讨论
本实验结果显示,在注射CCl4溶液0~10周的时间内,小鼠肝细胞出现明显周期性损害,分别依次出现变性期、坏死期、缓解期。变性期以肝细胞变性为主,伴随大量炎性细胞浸润,此时肝细胞虽然受损但未发生坏死,因此ALT、AST仅轻度升高;随着肝细胞变性加重及炎性细胞作用,变性期过渡到坏死期,损伤的肝细胞出现大量坏死,表现为大量无结构的红色均染玻璃样变性,ALT、AST急剧升高,肝细胞、炎性细胞浸润明显较少;当坏死的肝细胞残余被逐步吞噬吸收,坏死期开始向缓解期过度,炎性细胞浸润进一步减少,玻璃样变体大量消失,新生肝细胞增多,ALT、AST基本恢复正常;之后继续按照此顺序发生周期性病变。本实验共观察到1.5个周期性损害变化。
由此可见,在持续低剂量染毒过程中,同一周期内不同的表现期,CCl4慢性肝损伤的作用机制不同,变性期、坏死期以损伤机制为主导,缓解期以修复机制为主导,是一种近似“损伤—修复”交替出现的模型。在损伤机制主导期,反映出类似CCl4急性肝损伤模型的病理变化,是研究CCl4导致肝损伤诸多机制的最佳窗口期;而在修复机制主导期,则反映出CCl4急性肝损伤模型不具备或者不显著的肝细胞再生表现,是研究肝损伤后机体诸多修复自愈机制的最佳窗口期。因此我们认为选择不同的窗口期,对于评价抑制肝细胞损伤或者促进肝细胞再生两大类药物的疗效至关重要。
肝纤维化是伴随肝损伤出现的胶原纤维沉积,一般认为是不可逆的过程。但是Ebrahimkhani等人研究发现,该过程或许存在逆转的可能,其逆转的关键就是肝细胞再生,肝纤维化的形成,需要肝星状细胞转变为肌成纤维细胞,表达α-平滑肌动蛋白、合成细胞外基质,而肝星状细胞的转变需要激活其表面的5-羟色胺2B受体(5-HT2B),进而激活转化生长因子b1(TGF-b1)信号通路而完成,然而TGF-b1是肝细胞增殖强有力的抑制剂,当选择性拮抗5-HT2B时能够有效抑制肝星状细胞TGF-b1表达,明显减少肝星状细胞转化,在降低急、慢性肝损伤模型小鼠肝纤维化程度的同时,大量促进肝细胞再生[8]。本实验也发现类似趋势:在变性期时,肝细胞损害以脂肪变性为主,此时肝细胞虽然受损但未发生坏死,细胞结构大致完整,因此仅在变性肝细胞周围沉积淡蓝染胶原蛋白;随着损伤加重,变性期过渡到坏死期,出现大量肝细胞坏死后形成的无细胞结构的玻璃样变体,因此该区域内胶原蛋白逐步积聚为深蓝染条索状胶原纤维沉积;到缓解期时,坏死肝细胞极显著减少,肝细胞大量增殖再生,不仅胶原蛋白的沉积数量显著减少,形态也从条索样积聚弱化为分泌样表现。这是CCl4慢性肝损伤模型区别于CCl4急性肝损伤模型的又一表现,要利用好CCl4慢性肝损伤模型研究肝纤维化逆转机制、评价抗纤维化药物疗效,明确其周期性损伤变化、选择好优势窗口期势必至关重要。
值得注意的是,与建立CCl4急性肝损伤模型不同,我部选用不同批次同一来源种群的B/c小鼠建立CCl4慢性肝损伤模型时,虽然“损伤—修复”这一典型肝损伤病理表现周期性交替出现,但是这一循环性病变出现的时间点以及强度(ALT、AST)却存在差异[9]。国外研究也有过类似发现,同一来源近交系小鼠会因装运、笼具、个体持续性差异导致检测结果出现显著差异[10]。我们推测这与CCl4慢性肝损伤模型的病理特点密切相关,正是由于在染毒过程中剂量小和肝脏自愈再生能力强两大特点,导致成模过程出现“损伤—修复”机制交替主导的复杂过程,为个体原本微小差异的持续性进展提供了可能。而这种近交系个体间固有的微小差异在CCl4急性肝损伤模型造模中基本不会表现出显著差异,因为在急毒实验中,大剂量CCl4根本不会给肝脏自愈任何机会,展现出完全的压制性肝损伤病理表现。因此,在应用CCl4慢性肝损伤模型进行研究时,应着眼于对“损伤—修复”的周期性病变规律的影响,而不是对肝损伤出现的时间及强度的干预。
综上所述,CCl4慢性肝损伤模型的制备与研究源于CCl4急性肝损伤模型,其肝组织损伤变化与急性模型相近而又有区别,具有明显的周期性损害变化,在损伤期内,病理变化以炎性细胞浸润和肝细胞变性坏死为主,病理机制以损伤为主导;在修复期内,病理变化以肝细胞再生为主,病理机制以细胞增殖再生为主导,是一种近似“损伤—修复”交替出现的模型,“损伤期”适合进行与炎性反应、细胞损伤坏死有关机制研究,“缓解期”适合进行与肝细胞增殖再生有关机制研究。因此在使用CCl4慢性肝损伤模型进行肝损伤或修复机制研究或药效评价时,应重视该模型周期性的病变规律与特点,有针对性地选择相应“窗口期”,从而得到更为客观有效的实验数据。

