猪肉成分胶体金检测试纸条的制备研究
冯永巍,汪振炯
(1.无锡市食品安全检验检测中心,江苏无锡214100;2.南京晓庄学院食品科学学院,江苏南京211171)
利用相对廉价的猪肉冒充牛羊肉的现象近年来偶有发生,不仅破坏了市场公平,而且也成为威胁食品安全的重要隐患[1]。为了有效识别肉类掺假行为,建立一套高效、准确掺假鉴别方法,从肉制品中识别出猪源性成分是十分必要的。国内外的研究以猪肉蛋白、猪DNA 为检测指标建立了一些猪源性成分的检验方法[2-15]。其中以(polymerase chain reaction,PCR)技术为代表的核酸检测技术以其检测的准确性高,灵敏度高,抗干扰强等优点得到了研究人员的广泛接受[16-21],但也存在设备昂贵、操作繁琐、对操作人员要求高等缺点,推广和应用仍存在一定的局限性。
基于胶体金的可视化检测为猪源性成分掺假鉴定提供了一个崭新的技术平台。胶体金粒子具有高电子密度的特性,当与胶体金颗粒结合的大分子在相应的配体处大量聚集时,会形成肉眼可见的红色或者粉红色斑点。胶体金试纸条将各种反应试剂以条带固定在试纸条上,样本溶液从试纸条的一端通过毛细管作用向另一端移动,样品中的待测物同层析材料上针对待测物的受体发生特异性反应。结合胶体金的待测样本被截留、聚集在层析材料的一定区域,通过目测可直观得到显色[22-25]。本研究利用胶体金试纸条的原理,通过共价修饰有猪特异性核酸序列的胶体金颗粒与硝酸纤维素(nitrocellulose filter,NC)膜上固定的生物素修饰的互补核酸序列相互作用,开发快速检测猪肉成分的试纸条及检测方法,为肉类种源成分快速鉴定技术的研发,进行有益的探索。
1 材料与方法
1.1 试验仪器
紫外可见分光光度计(UV-2600):日本岛津公司;透射电镜(H7000):日本日立公司;电磁搅拌加热器(C-MAG HS7):德国IKA 公司;微量移液器(F-10):德国BRAND 公司。
1.2 试验材料
氯金酸,柠檬酸三钠,氯化钠,乙二胺四乙酸(Ethylenediaminetetraacetic acid disodium salt,EDTA),十二烷基硫酸钠(Sodium dodecyl sulfate,SDS),三羟甲基氨基甲烷(2-Amino-2-(hydroxymethyl)-1,3-propanediol,Tris),盐酸等(以上均为分析纯);蛋白酶K(Proteinase K):购于sigma 公司。
1.3 猪特异性核酸探针的选择
根据Genebank 公布的猪线粒体基因的保守序列(GenBank:AF039170.1),选择了“CAA CTA GAT ACA TCT ACA TGA TTC ATT AC”这一能代表猪种属的特异性序列片段,片段长度为29 bp,约10 nm。该片段修饰巯基得到可以与胶体金粒子共价结合的探针A,以及将该序列的互补片段修饰生物素,得到可以固定在NC 膜上的探针B,探针序列见表1。

表1 探针序列Table 1 Sequences of probes
1.4 胶体金溶液的制备
取浓度0.01%氯金酸溶液100 mL,搅拌(100 r/min)加热至沸腾并持续2 min,逐滴加入1%柠檬酸三钠溶液2 mL,继续搅拌加热6 min,直至溶液呈透亮的酒红色。冷却至25 ℃,装入分子量12 000 MW 的透析袋透析2 d,得到浓度约为3 nmol/L 胶体金溶液。在透射电镜下观察溶液中胶体金粒子的大小是否均匀一致,有无椭圆形及多角形金粒子存在,并测量金粒子直径。
1.5 核酸探针与胶体金的偶联
取1 mL 制备好的胶体金溶液,分别加入不同体积的0.1 mmol/L 的猪特异性核酸探针A,37 ℃水浴中温育12 h,得到胶体金-探针A 复合物[26]。再分别加入100 μL 浓度为10%的NaCl 溶液,观察各管的颜色变化,筛选最佳DNA 用量,探针A 的添加量见表2。

表2 核酸探针A 与胶体金偶联试验方案Table 2 Scheme of coupling of probe A and colloidal gold particles
1.6 样品DNA 提取
称取剪碎的熟肉样品100 mg,置于1.5 mL EP 管中,加入1 mL 组织裂解液[10 mmol/L Tris-HCl(pH 7.5)],100 mmol/L NaCl,10 mmol/L EDTA,0.5 % SDS,0.4 mg/mL proteinase K),将EP 管置于沸水中煮15 min,然后5 000 r/min 离心10 min,吸取上清。将提取的DNA 样品进行紫外检测,确认A260/A280的数值在1.8~1.9 左右,并用超纯水调节DNA 浓度,使其A260=1,此时DNA 浓度约0.1 mmol/L。
1.7 试纸的组装与测试
将不同浓度的探针B 喷在硝酸纤维素膜中间位置,喷涂量为30 μL。37 ℃干燥2 h 后贴在黏性塑料背板上,并在上下两端分别贴上玻璃纤维膜和吸收滤纸,裁切成3 mm 宽度,即为检测试纸。取30 μL 金标探针A 溶液分别与系列浓度探针B 的试纸按照表3的方案进行反应,通过显色强度筛选探针B 的最佳浓度,探针B 的浓度如表3 所示。
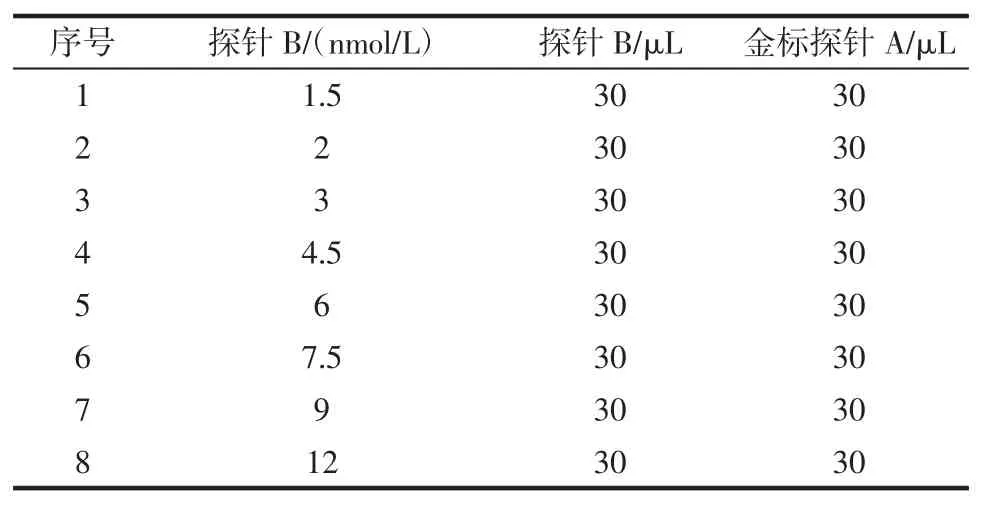
表3 探针B 最低浓度试验方案Table 3 Concentration gradient scheme of probe B
1.8 检测方法的实施
试纸的检测过程见图1。

图1 猪源性成分快速比色检测原理Fig.1 The schematic of development of a colloidal gold lateral flow strip assay for pork identification
吸取提取的DNA 样品30 μL,加至100 μL 金标探针A 体系中混匀,37 ℃温育5 min。将试纸条的玻璃纤维膜一端插入反应体系,探针溶液在毛细作用下,开始向试纸条上端流动,等待3 min,判断显色情况。如样品中不含猪肉DNA,则修饰有胶体金米粒子的探针A 会与硝酸纤维素膜上的互补序列进行特异性结合,大量金粒子堆积在探针B 处,出现红色可见条带;反之样品中含有猪肉DNA 时,则该DNA 会优先与胶体金粒子表面的探针A 特异性结合,形成双链DNA 结构,胶体金粒子探针就不会再与试纸条上的互补DNA发生结合,此时硝酸纤维素膜上就不会出现可见条带,说明检测的样品中含有猪肉DNA。
1.9 检出限
取适量纯牛肉,分别添加0%、2%、5%、10%、20%的猪肉,混合搅碎,按照1.7 的方法进行检测,观察试纸条检测结果,确定最低检出限。
2 结果与分析
2.1 胶体金溶液的表征
采用柠檬酸三钠还原法制备了胶体金溶液,溶液呈酒红色。溶液的透射电镜结果见图2。

图2 胶体金粒子的透射电镜图Fig.2 TEM image of colloidal gold particles
如图2 所示,在透射电镜下观察到金粒子的大小基本一致,分散性比较好,无多角形的金粒子,也没有聚集现象。通过随机挑选电镜照片上10 个金颗粒,测量其平均直径大小在30 nm 左右。通常胶体金试纸的金粒子直径在10 nm~40 nm,试纸检测的信号是由于金粒子聚集而产生的,金粒子太小就不能产生足够的颜色信号差异。在本研究中金粒子表面要修饰巯基,因此在制备过程中控制胶体金粒子直径约为30 nm 左右。
2.2 特异性核酸探针选择
为了得到特异性检测结果,从GenBank 公布的猪线粒体基因保守序列(GenBank:AF039170.1)中选择核酸片段作为检测目标探针。探针A 通过巯基与胶体金粒子表面形成的金-硫键结合在一起,金-硫键的结合比较牢固,能保证胶体金-探针复合物在试纸条上运动的过程中保持结构稳定。探针B 生物素偶联使得整体分子量变大,从而利用疏水键作用固定在NC 膜上。在检测过程探针B 通过特异性结合对探针A 进行截留,最终金粒子-探针A 复合物在探针B 处聚集显色。核酸探针的长度对检测方法的特异性和灵敏度有较大影响,探针过短既不利于对金粒子的保护,也不利于互补反应的发生。而过长的序列则会增加反应的空间位阻从而降低检测灵敏度。本研究最终选择的片段长度为29 bp,约10 nm。
2.3 核酸与胶体金偶联的最佳量
胶体金粒子在试纸上的聚集依靠DNA 的互补结合,偶联的核酸越多反应越容易发生,但过多的核酸又会增加反应的空间位阻导。本研究通过核酸在盐溶液中对胶体金的保护试验确定核酸的最适合用量。核酸探针A 与胶体金偶联的目测结果见表4。
从表4 可以看出,1 管~4 管由于偶联核酸的量不足,不能稳定胶体金,均呈现出由红变蓝的聚沉现象。从第5 管开始,胶体金的颜色基本一致,说明偶联的核酸量达到或超过了稳定胶体金的最低量。因此最适DNA 用量为在第5 管(50 μL)基础上再增加20%,即为实际核酸用量为60 μL。

表4 目测法确定最适用量Table 4 Optimum amount of probe A labeled with colloidal gold by visual inspection
2.4 探针B 喷涂的最适浓度
检测试纸采用的是竞争法检测原理,即待测样品与探针B 竞争结合探针A,通过显色差异判定结果。既要求探针A 和探针B 结合显色清晰,且探针的量又不能太高,探针量的增加意味着需要更多的样品量,方法的检出限也随之升高。探针B 最低喷涂浓度筛选的结果见表5。

表5 探针B 喷涂量的筛选Table 5 Screening of the concentration of probe B
从表5 可知,当序列B 核酸浓度达到7.5 nmol/L时开始有明显显色,选定这一浓度作为探针B 的最适喷涂浓度。
2.5 检出限
提取得到的DNA 样品需要首先进行浓度鉴定,并调节DNA 浓度至0.1 mmol/L 左右,使得在检测过程中样本DNA 含量相对于探针A 是过量的,确保探针A全部被反应掉,检测方法有最佳的敏感度。分别测定了含有0%、2%、5%、10%、20%猪肉成分的样品,检测结果见表6。
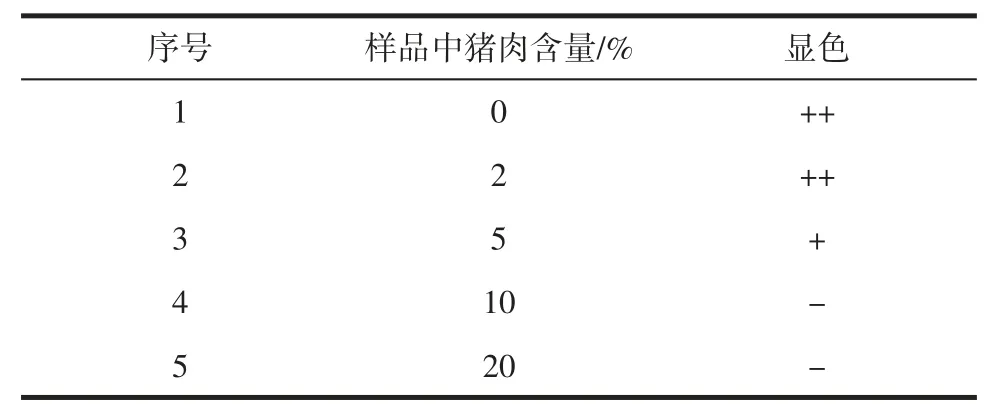
表6 猪肉检测试纸条检测结果Table 6 Visual result of test strip for pork identification
当样品中不含有猪肉成分时,检测线处的红色条带清晰可见。随着样品中猪肉含量的提高,检测线处的条带颜色随之变浅。当猪肉含量达到5%时,测试线显色与背景之间的反差已不明显,且各平行样品之间略有差异。当猪肉含量达到10%以上时,检测线处已无明显的肉眼可辨别的显色。一般来讲,肉类掺假以牟利为目的,掺假量通常都比较高,过低的检出限在应用实践中意义不大。本研究采用肉眼观察检测结果,不同测试者对临界结果的判断会有较大差异,因此选择猪肉含量10%作为方法的检出限。
3 结论
本文利用共价修饰有猪特异性核酸序列的胶体金颗粒与硝酸纤维素(NC)膜上固定的生物素修饰的互补核酸序列相互作用,开发了一种用于鉴别猪肉成分的胶体金试纸条及快速检测方法,研究结果表明探针A 与胶体金偶联的最佳用量为60 μL(0.1 mmol/L),探针B 喷涂的最佳浓度是7.5 nmol/L,试纸条的检出限为10%。该方法简单有效,有着较好的应用前景。

