甜米酒酒曲微生物分离和菌种鉴定
蔡海莺,张婷,沈灵智,彭佩莹,戴璟,张琪,罗洁,毛克羽,蔡成岗,毛建卫,*
(1.浙江省农产品化学与生物加工技术重点实验室,浙江科技学院,浙江杭州310023;2.浙江省农业生物资源生化制造协同创新中心,浙江杭州310023)
甜米酒是我国的传统酒种,历史悠久,主要以优质糯米为原料,在自然环境中通过微生物混合发酵而成。米酒柔和绵长,香气宜人,是我国百姓饮食文化中必不可少的部分。我国南方大米产区素有在家酿造独特风味米酒的传统[1]。另外,米酒的营养价值同样引人关注,除原料自身营养成分外,还包含米酒传统酿制过程中产生的低聚糖、多肽、氨基酸、维生素等易于被人体消化吸收成分[2]。甜米酒虽然功效众多,但国内甜米酒市场整体呈现产品质量参差不齐,市场规模不大,强势领导品牌较少,缺乏产品和技术创新等。米酒的酿制为多种微生物混合自然发酵的过程,酒曲为发酵过程中微生物的主要来源。酒曲起源约6000 年以前的中国,最早的文字记载可追溯到1700 多年前北魏贾思勰的《齐民要术》[3]。
我国传统酒曲的制作受使用原料、空气温度和湿度、环境微生物等多种因素的影响,酒曲稳定性很难保证。微生物菌种可谓发酵的灵魂,酒曲中微生物多样性和数量以及微生物互作等对米酒最终的质量、风味和营养功能都有着重要影响[4-5]。不稳定的酒曲意味着发酵米酒品质和风格也无法稳定,因为利用自然界种类和性质未知的微生物进行发酵,技术流程的标准化难以实现,同时未知菌种还可能带来食品安全上的风险[6]。因此,获得安全和稳定性高甜米酒酒曲是发展甜米酒产业化道路的必经之路。随着科技水平的飞速发展,对酒曲微生物在传统米酒的发酵过程、微生物功能的认识有了长足的进步,包括酵母酒化、酵母生香、根霉的糖化作用、红曲霉增强酯化作用以及厌氧异养菌、己酸菌、乳酸菌等的米酒风味形成作用等[7-9],均表明酒曲微生物对米酒风味和风格的形成以及米酒的功能营养有着重要作用。然而,人们对甜米酒酒曲微生物的分离鉴定和多样性的研究仍然较少。
本研究鉴于甜米酒酒曲微生物对米酒发酵过程、功能性、风味和生物安全性等的潜在影响,通过收集来源不同的酒曲样品,进行细菌和真菌微生物的分离、形态学观察和分子生物学鉴定,对酒曲微生物进行多样性分析,为甜米酒酿制提供了生物资源的选择依据和参考,同时有利于对揭示米酒微生物的作用机制和提高米酒的品质、稳定性等方面具有重要理论和现实意义。
1 材料与方法
1.1 材料与试剂
酒曲分别源于孝感、苏州、丽水、南宁、黔东、达州、阜阳、岳阳和绍兴等地,编号见表1。
1.2 仪器与设备
SW-CJ-2FD 超净工作台:苏州安泰空气技术有限公司;DHG-9240A 鼓风干燥箱、BPH-9162 恒温培养箱:上海慧泰仪器制造有限公司;LDZF-30KB 灭菌锅:上海申安医疗器械有限公司;DYY-6C 电泳仪:北京六一生物科技有限公司;Mastercycler pro 聚合酶链式反应(polymerase chain reaction,PCR)仪:艾本德中国有限公司;Bio-rad Gel Doc XR+凝胶成像分析系统:美国伯乐公司。

表1 米酒酒曲编号及来源Table 1 Sources and codes of Chinese sweet rice wine starters
细菌基因组DNA 提取试剂盒、酵母基因组DNA提取试剂盒:天根生化科技(北京)有限公司。
1.3 培养基的配制
鲁里亚贝塔尼(luria-bertani,LB)细菌培养基:0.5 %酵母提取物,1%胰蛋白胨,1%氯化钠,蒸馏水1 L,121 ℃高压灭菌20 min。固体LB 培养基:LB 细菌培养基添加1.5%琼脂粉。
酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:1%酵母粉,2%蛋白胨,2%葡萄糖,蒸馏水1 L,pH6.0,115 ℃湿热灭菌20 min。固体培养基:对应培养基中添加1.5%琼脂粉。
1.4 酒曲微生物的分离纯化
细菌和真菌的分离和培养[10]:取12 种酒曲每种样品1 g,分别溶解于10 mL 灭菌生理盐水中,依据样品菌含量调整稀释倍数,取终浓度是10-3、10-4、10-5g/mL 和10-6g/mL 的酒曲样品溶液0.1 mL,均匀涂布于LB 和YPD 培养基(YPD 含终浓度0.1 mg/L 四环素和链霉素)培养皿上,分别用于细菌和真菌微生物的分离和培养。将涂布好的LB 和YPD 培养基培养皿,分别置于37 ℃和28 ℃,细菌培养1 d~2 d,真菌培养2 d~4 d。挑取培养皿上长出的单菌落,转移到相对应的新LB 和YPD 培养皿中分离纯化培养,分离的单菌落转移到LB 和YPD 液体培养基,分别在37 ℃和28 ℃,200 r/min 摇床培养16 h 和24 h,直到培养液完全浑浊。
1.5 细菌和真菌菌株的分子生物学鉴定
细菌菌种DNA 提取采用细菌基因组DNA 提取试剂盒。细菌采用16S rRNA 基因片段进行分子生物学鉴定。细菌菌株16S rDNA 序列扩增:16S rRNA 基因片段扩增采用通用引物27F 和1492R[11]:5'-AGAGTTTGATCCTGGCTCAG-3' 和5'-GGTTACCTTGTTACGACTT-3'。PCR 扩增以菌株提取的细菌基因组DNA 为模板,PCR 反应体系(50 μL)条件:正向和反向引物各2 μL、模板DNA 1 μL、高保真DNA 聚合酶KOD 2 μL、10 倍酶缓冲液5 μL 和超纯水38 μL。PCR 反应程序为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃复性0.5 min,72 ℃延伸1min,30 个循环;72 ℃末端补齐延伸10 min。
真菌菌种DNA 提取采用酵母基因组DNA 提取试剂盒。真菌采用rRNA 基因ITS 序列片段进行分子生物学鉴定。ITS 扩增引物为ITS1 和ITS4[12]:5'-TCCGTAGGTGAACCTGCGG-3' 和5'-TCCTCCGCTTATTGATATGC-3'。PCR 扩增体系和反应程序同细菌16S rRNA 片段PCR 扩增。PCR 扩增效率用1%的琼脂糖凝胶电泳确认,将目的片段送至江苏金维智生物技术有限公司测序。
1.6 微生物多样性系统发育分析
测序结果用于微生物多样性分析和系统发育树构建。将菌株DNA 扩增片段序列上传至NCBI 数据库在线软件BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi),获得与目的菌株片段序列相似性较高的细菌16S rRNA和真菌ITS 基因序列。进一步用MEGA7 软件构建系统发育树,分析分离菌株的种属及其的系统发育关系。
2 结果与分析
2.1 细菌和真菌分离和形态观察
米酒的品质、风味、安全性和生产效率与酒曲中微生物有重要关系。本研究从12 种酒曲中分离到46株细菌和54 株真菌,编号分别为细菌bM-N 和真菌M-N(M 分别为12 种酒曲样品编号1~12,N 分别为同一样品中微生物序号)。甜米酒细菌和真菌分离种类统计见表2。
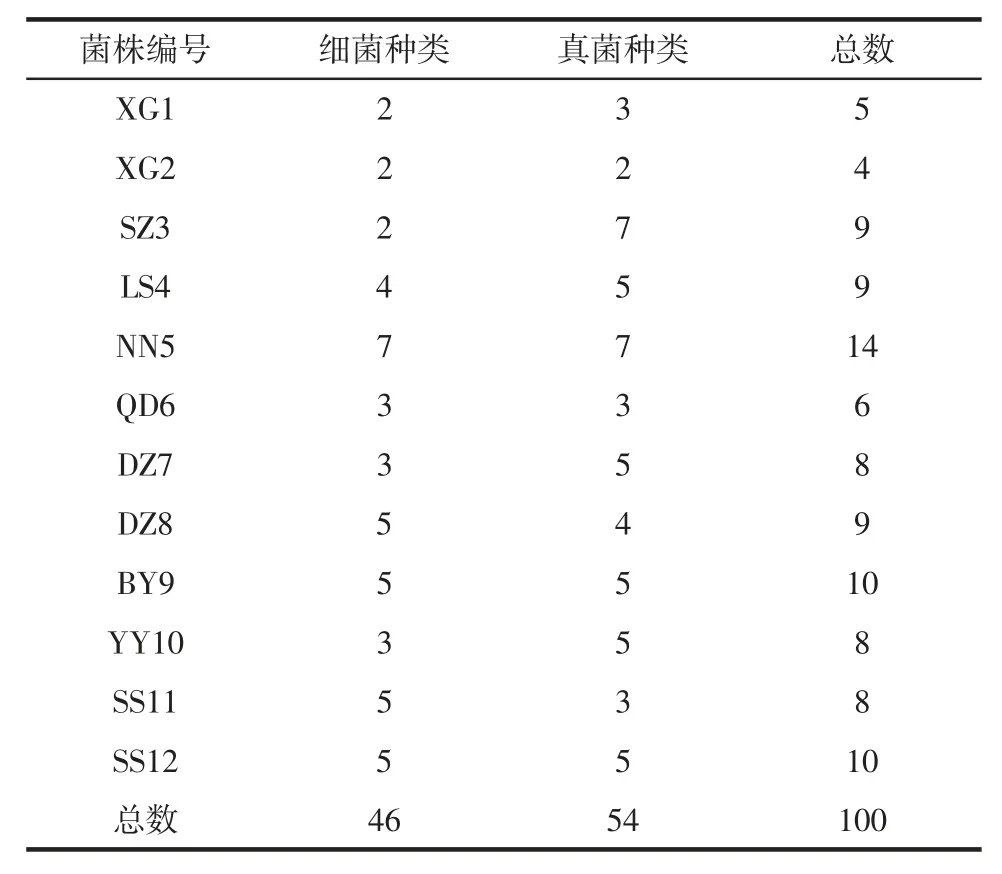
表2 甜米酒细菌和真菌分离种类统计Table 2 Numbers of bacterialand fungal species isolated from Chinese sweet rice wine
酒曲微生物的分离鉴定结果表明,从12 种不同来源的酒曲分离到46 株细菌和54 株真菌。不同来源的酒曲微生物种类数量有较大差异,NN5 酒曲分离到14种微生物,BY9 和SS12 也分离到10 种微生物,而XG2 和XG1 仅分别分离到4 种和5 种。根据培养基来源、菌落形态和细胞形态观察,分离的真菌中以酵母为主,少量丝状真菌,表明甜米酒中的酒精主要来源于酵母。另外,分离得到的细菌种类与真菌种类接近,表明细菌也在甜米酒酿制过程中起重要作用,和丝状真菌一样,部分细菌分泌淀粉水解酶系分解淀粉生成葡萄糖,另外,细菌在该微生态体系中代谢所产生的酸、酯、醇、酮等物质对米酒的风味形成意义重大。然而,酒曲中菌株种类的多少和微生物总数量并无直接关系,微生物总数量主要由种群中优势菌种的数量决定,从菌落微生物计数结果表明,XG1、XG2、SS11 和SS12 有较高的菌数[4]。不同微生物种类和组成构成的微生物菌群,通过共生、竞争和拮抗等相互关系调节米酒酿制过程中的微生态,从而改变了米酒最终的产品品质和风味[13-14]。米酒酒曲微生物的鉴定工作由来已久,最初由于条件的限制,对米酒中微生物的认识仅限于能够在实验室条件下能分离培养的微生物,如李健容等[9]从酒曲中分离了3 类酵母菌(酒香酵母属、假丝酵母属和毕赤酵母属)和2 类根霉菌(米根霉和华根霉);研究者还从米酒酒曲中筛选了功能性的微生物,如产γ-氨基丁酸的多种微生物[15],产凝乳酶的微生物菌株[16]等。随着生物组学的发展,对米酒酿制过程中的微生物的认识也更加深入[17-19],这类米酒生物多样性的研究也为米酒微生物的分离提供了参考。
2.2 细菌和真菌分子生物学鉴定
传统发酵食品是筛选微生物资源的重要来源。通过分子生物学特征基因片段的序列比对,结合形态学观察,是目前常用的快速菌种鉴定手段。本研究选择筛选到的46 株细菌和16 株长势良好的酵母形态和丝状真菌的真菌,对其基因组DNA 进行PCR 扩增。细菌16S rRNA 基因V3~V4 区扩增结果见图1。

图1 细菌16S rRNA 基因片段PCR 扩增电泳结果Fig.1 Electrophoresis of PCR products of bacterial 16S rRNA gene fragment
由图1 可知,仅少量菌株没有明显目的条带,其余41 个样品PCR 扩增均获得约1.5 kb 大小的目的片段,用于目的基因测序。然而,与细菌不同,真菌中获得目的基因ITS 序列的PCR 扩增条带的很少,并且扩增条带大小有一定差异,在约0.75 kb 到1.5 kb 之间。其中,2 株扩增条带明显,14 株显示有少量扩增。表明真菌在DNA 提取和PCR 扩增效率较细菌明显偏低,可能受到细胞壁破碎难度较大和真菌自身次级代谢产物的影响。对41 株细菌和16 株真菌PCR 扩增产物进行测序,获得了细菌16S rRNA 基因V3~V4 区和真菌18S rRNA 基因ITS 序列。
2.3 进化树和多样性分析
DNA 测序结果经BLAST 在线软件比对,并用MEGA7 软件构建了酒曲中细菌和真菌的系统发育树。酒曲中分离的芽孢杆菌菌株系统发育树和其他细菌菌株系统发育树见图2 和图3。
酒曲微生物中存在大量芽孢杆菌属(Bacillus),鉴定出的细菌中有8 株与贝莱斯芽孢杆菌(Bacillusvelezensis) 同源关系最近,10 株与枯草芽孢杆菌(Bacillus subtilis)同源关系最近,3 株与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)同源关系最近,2 株(b7-2 和b7-3)与萎缩芽孢杆菌(Bacillus atrophaeus)同源关系最近,b4 -3 与地衣形芽孢杆菌(Bacillus licheniformis)同源关系最近,1 株(b4-4)与蜡样芽孢杆菌(Bacillus cereus)同源关系最近,还有2 株与枯草芽孢杆菌(Bacillus subtilis)有一定的同源性,还有5 株仅能鉴别到芽孢杆菌属(Bacillus)。酒曲的制作通常是通过淀粉含量较高的食品为固体原料(如小麦粉和米饭等),在有氧条件微生物自然发酵而成。酒曲从有氧环境富集微生物的这一特性导致酒曲微生物中含有大量芽孢杆菌。然而芽孢杆菌在米酒的酿制过程中可提供少量淀粉酶和风味物质前体,在后期酒精浓度较高时生长受到抑制,乳酸菌的含量会相对较高[4]。蜡样芽孢杆菌是常见的腐败菌,赵东在研究西藏青稞酒酒曲微生物多样性也鉴定出该菌种[20]。除芽孢杆菌外,酒曲微生物中还分离到溶血性葡萄球菌(Staphylococcus haemolyticus)、阪崎氏肠杆菌(Cronobacter sakazakii)、埃希氏菌属(Escherichia)、肺炎克雷伯菌(Klebsiella pneumonia)等的同源微生物,其中溶血性葡萄球菌和肺炎克雷伯菌等均为一定能力的条件致病菌。这一发现表明酒曲的制作需要严格的管理规范和制作工艺,防止米酒的发酵过程中引入致病菌和腐败菌,引起食品生物安全性的风险。酒曲中分离的真菌微生物菌株系统发育树见图4。
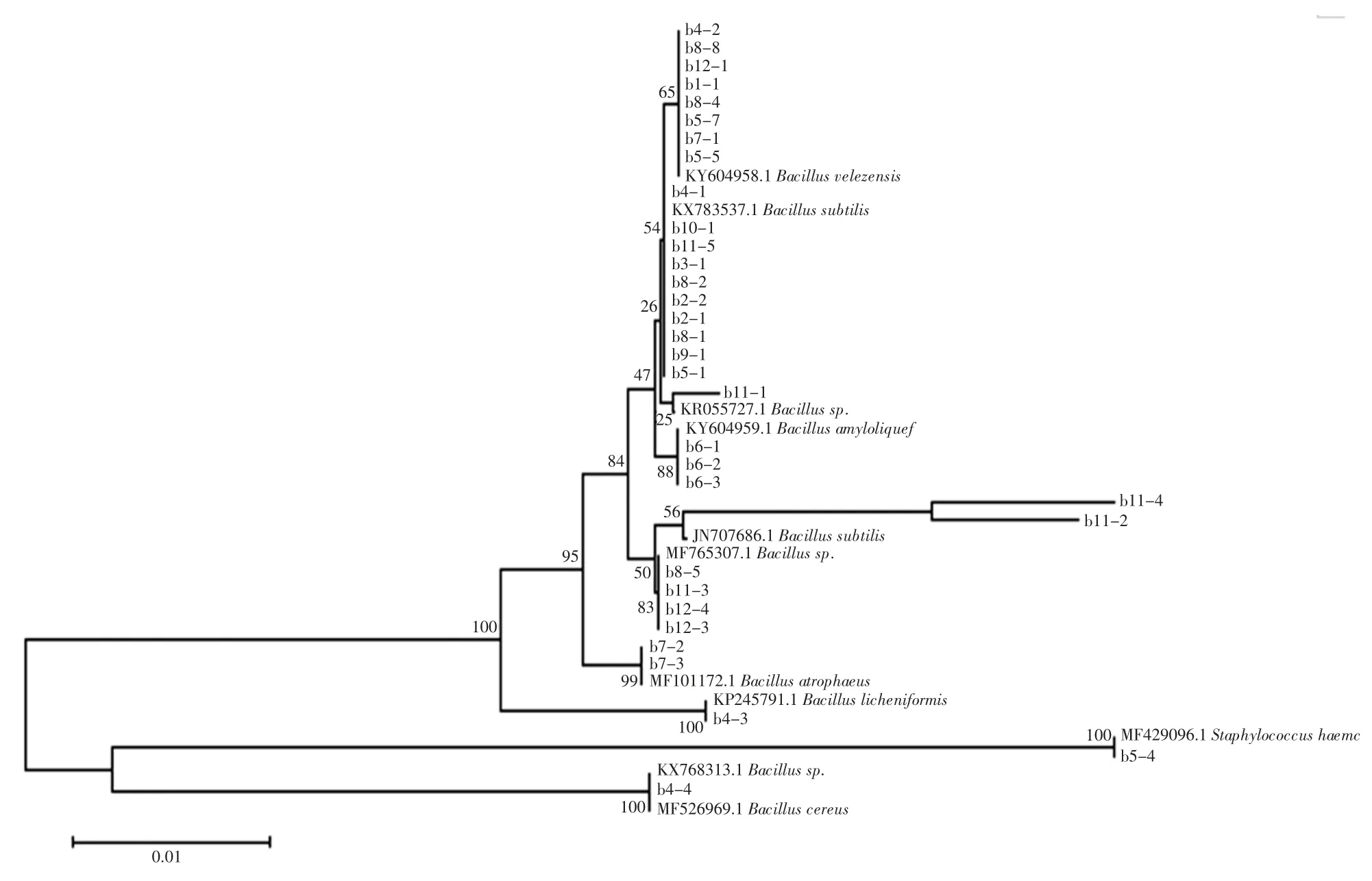
图2 酒曲中分离的芽孢杆菌菌株系统发育树Fig.2 Phylogentic tree of Bacillus isolated from CSRW starters
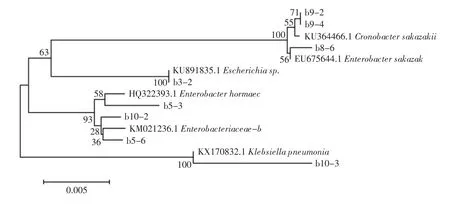
图3 酒曲中分离的其他细菌菌株系统发育树Fig.3 Phylogentic tree of other bacteria isolated from CSRW starters
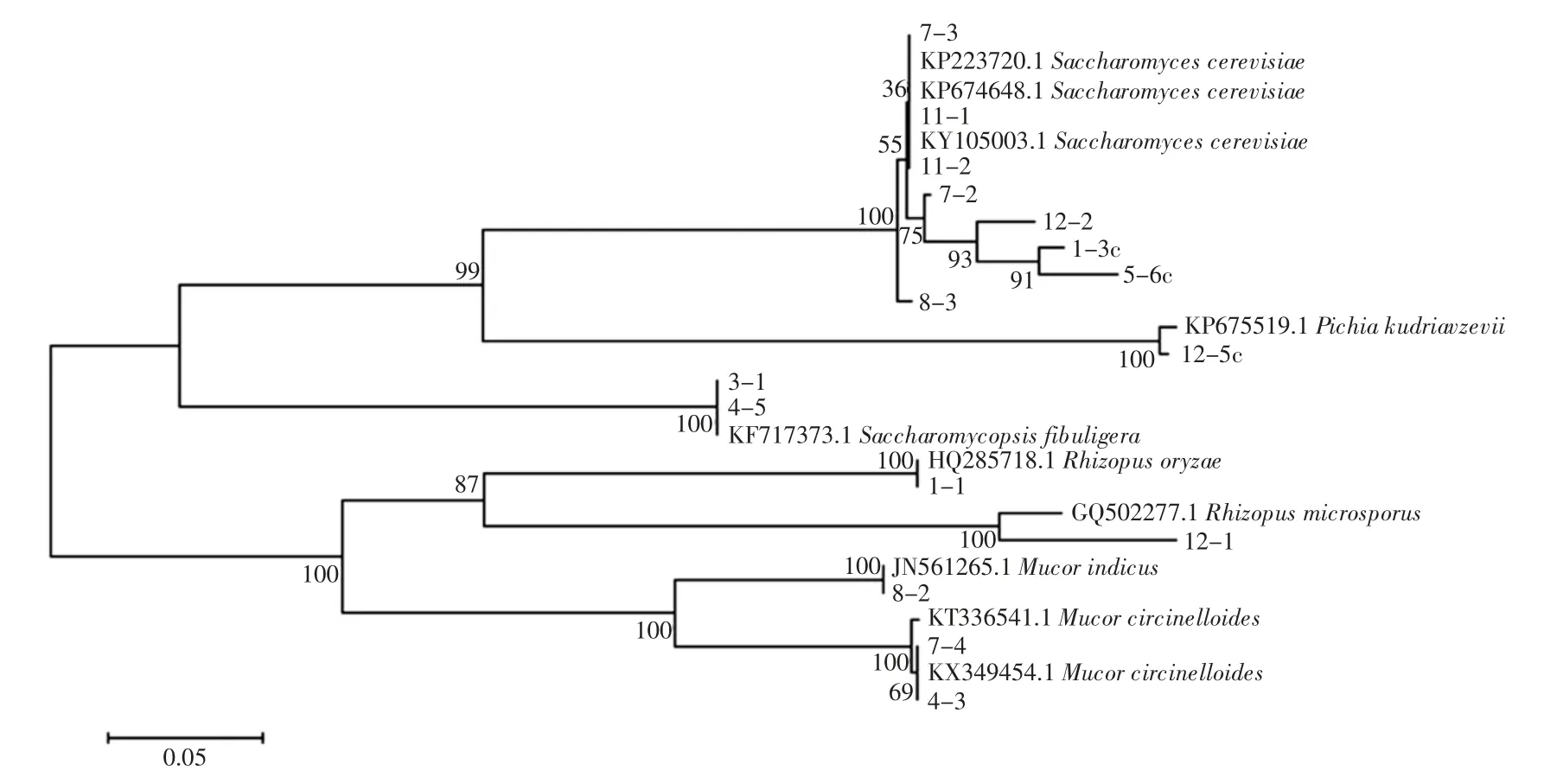
图4 酒曲中分离的真菌微生物菌株系统发育树Fig.4 Phylogentic tree of fungi isolated from CSRW starters
米酒中有丰富的真菌微生物资源。除典型的产酒精微生物酿酒酵母(Saccharomyces cerevisiae),还发现其他产酒精微生物,如库德里阿兹威毕赤酵母(Pichia kudriavzevii)和米根霉(Rhizopus oryzae)等[21]。另外,扣囊复膜酵母菌(Saccharomycopsis fibuligera)等非酒精酵母也出现在酒曲微生物中。有报到表明扣囊复膜酵母菌可通过与酿酒酵母的互作和共生影响乙醇的产量,并改变发酵液中风味物质的生成[22-23],未来对于非酿酒酵母与酿酒酵母之间的互作机理研究,有望对改善和调节酒精发酵饮品提供理论指导。另外,酒曲真菌微生物试验的还鉴定了卷枝毛霉(Mucor circinelloides)和印度毛霉菌(Mucor indicus)的存在。
3 结论
本研究对12 种来源的酒曲进行了微生物的分离鉴定,筛选到的46 株细菌和54 株真菌微生物,结合菌落形态和细胞形态,进一步通过分子生物学鉴定快速鉴定了其中41 株细菌和16 株真菌微生物。酒曲细菌微生物中含有大量芽孢杆菌;另外,酒曲中还鉴定到少量病原菌和腐败菌,说明部分中国传统发酵食品还有一定的生物安全隐患,需要不断创新、转型升级才能迎来发酵食品的工业现代化。酒曲中还有很多真菌微生物资源,通过分离纯化的微生物资源可用于甜米酒酒曲制作和米酒酿制,也可以用于其中发酵食品的研究开发。经过鉴定的分离微生物的利用,往往可改善发酵食品的品质和风味;同时,科学的微生物搭配可改善发酵食品的原料利用效率,还减少了病原菌和腐败菌对食品安全性的潜在威胁,是未来发酵食品发酵剂的研究方向之一。

