局灶性脑低温处理对大鼠创伤性脑损伤模型的保护作用
费晓炜 徐如祥 魏明海 贺业霆
创伤性脑损伤(traumatic brain injury,TBI)是外界暴力作用于头部导致的脑组织器质性损伤,临床多表现为脑震荡、脑挫裂伤、弥漫性轴索损伤及和脑干损伤。TBI会导致严重的脑水肿及癫痫样棘波,因此部分患者会产生癫痫症状,及时有效安全的治疗对TBI至关重要。低温治疗在临床上又称为冬眠疗法,根据温度不同可分为轻度(33℃~36℃)、中度(28℃~32℃)、深度(17℃~28℃)和超深(17℃以下)低温。全身性低温对脑损伤和缺血患者的临床运用展示出了良好的治疗效果,但是也会出现致命并发症的几率,如感染、心律失常、血液凝固异常等[1,2]。为了更好地解决这个问题,局部脑冷却作为脑损伤的微创治疗受到广泛关注。从1959年至1963年,对脑肿瘤和癫痫患者进行了局部脑冷却的初始临床应用,并证明了其有效性[3,4]。尽管这些初步研究支持局部脑冷却的治疗潜力,但尚未针对临床应用进行优化。本研究通过SD大鼠TBI模型表明了利用局部脑皮层冷却可抑制TBI引起的脑水肿及癫痫样棘波的发生,从而起到脑保护作用。
材料与方法
一、实验动物
18只健康雄性SD大鼠(180~220 g)购自大连医科大学无特定病原体(specific pathogen free,SPF)动物实验中心。动物级别、饲养条件、手术过程、对照处理、取材等严格按照大连医科大学SPF动物管理中心相关规定执行,并符合National Institutes of Health Guide for the Care and Use of Laboratory Animals。
二、仪器
TBI模型制作设备:液压脑损伤打击仪液压装置由圆形液柱,电打击架、示波器和压力传感器组成。圆形液柱内装生理盐水,一端是有机玻璃活塞,另一端连接打击管和压力传感器,打击面为直径3 mm的圆形。通过打击玻璃活塞产生压力,管内的液体将压力传导到大脑皮层,造成脑损伤。冷却设备:采用钛合金材料制作皮层冷却模块,大小6 mm×6 mm,冷却模块两端连接冷却泵,通过调控冷却水泵的排水速度来达到降低脑皮层温度,从而起到局灶性亚低温脑保护作用。
三、试剂
SDS-PAGE凝胶制备试剂盒及BCA蛋白浓度测定试剂盒购自北京索莱宝试剂有限公司。AQP4抗体购自英国Abcam公司(ab46182),GABAB1R抗体购自美国CST公司(3835s)。
四、实验分组及处理
实验动物随机分为假手术组(sham组),非冷却组(non-cooling组),冷却组(cooling组),每组5只。Sham组大鼠只开颅不创伤,non-cooling组和cooling组大鼠均制作为创伤模型,non-cooling组创伤后不予处理。Cooling组给予冷却处理:脑皮层创伤处迅速降温至15℃维持3 h,之后为回温状态,每隔10 min升高1℃,升至30℃后维持30 min,整个回温过程持续3 h。手术开颅骨窗定位及创伤面积见图1。

图1 手术操作示意图
五、脑组织GABAB1R和AQP4检测
取脑组织于500 mL裂解液中,置于冰上裂解1 h,取2 μL用BCA试剂盒检测蛋白浓度,按照标准公式计算样品上样量。125 mL 5×loading buffer加入含有脑组织的裂解液中,100℃水浴10 min,12 000 g离心15 min取上清用于检测。在12%的分离胶与5%的浓缩胶中进行蛋白电泳,每孔上样蛋白总量为30 μg,按恒压80 V和120 V分别跑浓缩胶和分离胶。恒压110 V电转至PVDF膜,5%牛血清白蛋白封闭1 h。AQP4抗体使用浓度1 μg/mL,GABAB1R按1∶1000稀释于1×TBST中使用,4℃过夜。对应种属二抗孵育1 h,凝胶成像设备曝光。
六、统计学分析
应用SPSS17.0软件进行数据统计。方差齐性且呈正态分布的计量资料以均数±标准差()表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
结果
一、3组大鼠血气记录比较
Cooling组在TBI后平均动脉血压较其他组下降明显,但差异无统计学意义(P>0.05,图2A)。Sham组大鼠受到开颅刺激且cooling组和non-cooling组大鼠TBI后,血气pCO2明显上升,pO2无明显变化,cooling组pCO2分别和sham组、non-cooling组比差异具有统计学意义(t=3.565,P=0.023;t=4.000,P=0.016);cooling组pO2和sham组、no-cooling组比差异具有统计学意义(t=12.002,P=0.000;t=3.320,P=0.029)(图2B~C)。
二、TBI后cooling组与non-cooling组脑组织死亡比较
回温持续3 h后对大鼠进行麻醉处死,用2%TTC进行染色,低温处理能明显改善TBI造成的脑损伤(图3A~B),对大鼠进行4%多聚甲醛灌流后取脑组织后进行HE染色,non-cooling组较cooling组损伤部位细胞核缺少,细胞核染色较浅(图3C~D)。
三、3组大鼠术后癫痫样棘波频率比较
Sham组进行假手术后皮层电位未发生明显改变。Non-cooling和cooling组在TBI处理后均出现明显的癫痫样棘波。然而,cooling组中在15℃的脑冷却期间癫痫样棘波显着受到抑制,并且在整个复温期间癫痫样棘波的不完全抑制持续存在。在sham组和non-cooling组中,整个试验过程中所有频率范围内的功率谱差异无统计学意义(P>0.05,图4A)。然而,在cooling组中频率范围4~25 Hz的功率谱低温冷却相比冷却处理前明显降低,回温时各波谱的平均功率虽较低温时略上升,但较冷却前降低,差异均有统计学意义(P<0.05,图4B)。此外,频率范围1~4 Hz、25~30 Hz的波谱在各处理阶段功率谱之间差异无统计学意义(P>0.05,图4C)。
检测TBI损伤周围脑组织中GABAB1R蛋白含量,结果显示cooling组的GABAB1R蛋白含量较non-cooling组低,差异具有统计学意义(t=33.411,P=0.000)(图4D)。
四、TBI后cooling组和non-cooling组脑组织水肿比较
Cooling组脑组织蒸干前后的质量差较noncooling组大,蒸干后cooling组脑重量较non-cooling组大,差异均具有统计学意义(t=4.436,P=0.011,图5A)。Cooling组较non-cooling组脑水肿症状轻,且脑组织AQP4蛋白含量明显下降,差异具有统计学意义(t=11.510,P=0.001,图5B)。
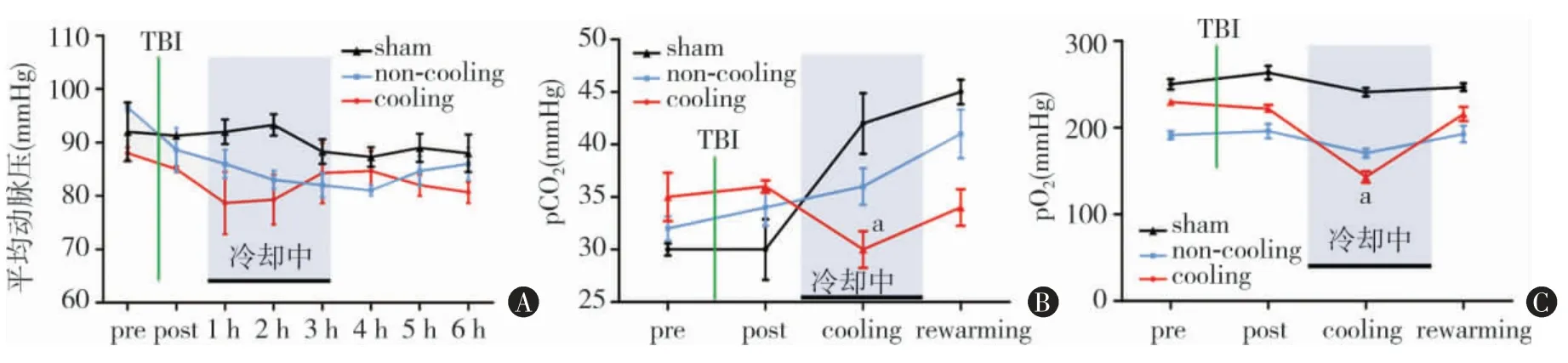
图2 实验全程大鼠血气记录

图3 大鼠脑组织TTC染色和HE染色

图4 实验全程大鼠皮层脑电分析和GABAB1R表达变化;图5创伤性脑损伤后cooling组和non-cooling组水肿情况及AQP4表达变化
讨论
在临床上不能预防原发性TBI,但是由其引起的继发性脑损伤如脑水肿、脑死亡、癫痫等并发症对患者的影响较原发性TBI更严重,因此如何更好地预防TBI之后的各类并发症显得极为重要。低温治疗TBI的基本理论基础可能与降低脑组织耗氧量、减少乳酸在脑组织中的堆积、保护血脑屏障和降低脑组织水肿程度有关[5,6]。最新研究发现中度低温通过调节细胞自噬/凋亡和MyD88依赖性TLR4信号通路抑制创伤性脑损伤后的小胶质细胞激活[7]。此外,低温预处理通过增强神经元的突触可塑性改善创伤性脑损伤引起的认知功能障碍[8]。中度低温通过影响细胞自噬途径减少脑损伤后海马细胞的死亡[9]。
γ-氨基丁酸(γ-aminobutyric acid,GABA)是最普通的脑内抑制性递质,通过与突触后膜相应受体结合发挥作用,与癫痫的发生密切相关[10]。许多抗癫痫药能增加脑内GABA的含量,从而改善大脑过度放电导致癫痫的症状。GABA受体根据药理学特征不同可分为GABA-A受体、GABA-B受体和GABA-C受体,其中GABA-B受体属代谢型受体,可与钙离子、钾离子和G蛋白偶联。目前对GABAB1R研究较少,有研究显示在人类难治性颞叶癫痫病中GABAB1R蛋白和mRNA含量上升[11]。本研究检测到cooling组癫痫样棘波出现频率较其他组少,且Western blot检测发现GABAB1R蛋白低温处理后呈现下降的趋势,与之前的研究相符。因此笔者猜测低温冷却抑制TBI引起的癫痫样棘波,其机制可能与调控GABAB1R有关,但是具体如何调控GABAB1R涉及的信号通路还有待进一步研究。
AQP4是中枢神经系统主要的水通道蛋白,位于星形胶质细胞的足突上,不同原因引起的脑水肿中AQP4的表达变化不同[12]。细胞毒性脑水肿AQP4的缺失能降低水流入脑组织的速度,减轻细胞毒性脑水肿。相反,缺失AQP4能降低血管源性脑水肿水流出脑组织的速度,加重血管源性脑水肿[13,14]。通过对脑组织进行外力的打击形成TBI模型,脑组织TTC染色和HE染色都显示出细胞死亡,所引起的水肿属于细胞毒性脑水肿[15]。AQP4 Western blot检测结果与之前报道的结果相符。此外,有研究发现Foxo3a上调AQP4的转录水平,诱导TBI后引起的脑水肿。选择性血管加压素-1a受体拮抗剂可预防局灶性脑外伤后引起的脑水肿,减少星形胶质细胞肿胀和GFAP、V1aR和AQP4的表达[16]。本研究证实了低温抑制TBI后引起的脑水肿和AQP4之间的相关性,但具体潜在机制有待进一步研究。
综上所述,本研究发现局部低温处理能降低脑组织的新陈代谢,减轻TBI后脑细胞死亡,抑制大脑皮层癫痫样棘波产生的机制可能与GABAB1R相关,减轻损伤后脑水肿程度的机制可能与AQP4相关,为临床治疗TBI提供了一种更加安全有效的方法。

