小分子靶向药物SNX2112对结肠癌细胞的作用研究
万 月,文庆莲
(西南医科大学附属医院 肿瘤科,四川 泸州 646000)
大肠癌是第三大最常被诊断出的癌症[1]。不管是在发达国家还是在发展中国家,结肠癌的发病率和死亡率仍在上升[1-2],这些统计数据反映出有必要进一步了解这种疾病,并为结肠直肠癌患者提供新的治疗方法。传统的化放疗由于肿瘤耐药、毒性等原因已经难以满足临床的需要。化学抗肿瘤药物经过半个多世纪的发展,已经进入靶向治疗药物时代。
热休克蛋白90(Heat shock protein 90,HSP90)是存在于细胞中的分子量为90kDa的热休克蛋白[3],是一个保护蛋白质折叠和稳定所需的蛋白质,参与细胞内信号转导如AKT及转录激活因子(STAT3)等调节细胞生存、增殖和分化[4-5]。HSP90作为分子伴侣,在正常生理条件下,参与蛋白质的合成、折叠、装配、运输和降解、寡聚体的形成和解聚等过程[6]。在发生应激反应时,HSP90 可以和那些由于环境刺激而使自身构象发生改变的蛋白相互作用,保证蛋白进行适当的折叠并防止其非特异性聚集,从而维持细胞的正常生理功能。HSP90在相对于正常组织的许多类型的癌症中均过表达,其客户蛋白与许多致瘤途径有关,因此被认为是潜在的抗癌药物靶标[7]。格尔德霉素衍生物是最早发现的HSP90抑制剂,但其具有明显的脱靶毒性,例如肝毒性,眼和心脏毒性,从而限制了药物的进一步临床开发[8-10]。SNX-2112是一种新型的HSP90抑制剂,它以高亲和力与HSP90的N末端ATP结合位点结合,是治疗各种癌症的有希望的候选药物[11]。本研究通过HSP90的特异性抑制剂SNX2112作用于结肠癌细胞HCT116,通过MTT实验、划痕实验观察药物毒性和细胞迁移情况,通过流式细胞仪检测凋亡和周期观察药物的促凋亡作用和对周期的抑制,并研究其对信号传导及转录激活因子(STAT3)、丝氨酸/苏氨酸蛋白激酶(AKT)等相关信号蛋白的调控机制,为HSP90抑制剂治疗结肠癌提供依据。
1 材料与方法
1.1 主要试剂 1 640培养液(HyClone公司,美国);胰蛋白酶 (Sigma公司,美国);胎牛血清(HyClone公司,美国);培养板 (Corning Costar公司,美国);SNX2112 (MCE公司,美国);MTT检测试剂盒 (索莱宝公司,中国);细胞凋亡与周期检测试剂盒(BD Biosciences公司,美国);RIPA裂解液 ( Thermo 公司,美国);ACTIN (CST公司,美国);AKT(CST公司,美国);p-AKT(CST公司,美国);STAT3(CST公司,美国);p-STAT3 (CST公司,美国)。
1.2 细胞培养 人结肠癌细胞株HCT116(American type culture collection,ATCC),培养于10% 胎牛血清培养基 (10%FBS RPMI-1640)含1% 双抗,37 ℃培养箱 (5% CO2),培养4 h后贴壁生长。当细胞处于对数生长期时,0.05%胰蛋白酶消化贴壁细胞,1/4传代备实验使用。
1.3 生物信息学分析 利用 TCGA 等数据库的结肠癌数据及近年来(2015-2018年)的结肠癌组织样本,分析HSP90的基因(HSP90AA1)表达情况,包括正常组42例,结肠癌组478例,基于Log2(RSEM+1)分析数据。
1.4 MTT细胞活性检测 取对数生长期的HCT116细胞,胰蛋白酶消化后接种于3个96孔板,培养过夜,细胞贴壁后,分别给予0、0.04、0.08、0.16、0.31、0.63、1.25、2.5 μM/L的SNX2112处理,3个孔板分别孵育24、48、72 h后吸去上清,每孔加20 μL MTT溶液,继续培养4 h,然后吸掉上清,每孔加入150 μL DMSO溶解液,置摇床上低速振荡10 min,在酶标仪 (Molecular Devices公司,美国)490 nm处测量各孔的吸光度值。
1.5 流式细胞术检测凋亡 用胰酶消化HCT116细胞按2×105密度每孔接种于六孔板上,24 h后用0、0.04、0.08、0.16μM/L的SNX2112进行处理。基于V-FITC/PI检测试剂盒说明书进行实验。收集细胞,用冷PBS洗涤2次,并轻轻重悬于100 μL结合缓冲液中,然后用膜联蛋白V-FITC(5 μL)和PI(10 μL)溶液染色,孵育15 min,并在流式细胞仪(BD 公司,美国)上进行分析。进行一式3份的实验。
1.6 细胞周期测定 用胰酶消化处于对数生长期的HCT116细胞,按每孔2×105细胞密度接种于6孔板上,培养24 h后,给予0、0.04、0.08、0.16 μM/L的SNX2112处理,孵育24 h后,收集细胞到离心管中,离心去上清后用PBS重悬,再次离心去上清,用预冷70%的乙醇4 ℃固定2 h;离心去上清,并用PBS重悬,再次离心去上清,每管加入0.5 mL碘化丙啶染色液重悬,37 ℃避光温浴30 min,用流式细胞仪检测细胞周期。
1.7 划痕实验 将每孔1×106密度HCT116细胞接种于6孔板,贴壁后用10 μL枪尖在孔板中间划一条直线,并用马克笔标记,去除培养基,PBS洗2次,加入1%FBS RPMI-164,分为SNX2112:0、0.04、0.08、0.16 μM/L 4个组,分别于0、24、48 h拍照。重复3次。Image J计算迁移面积。
1.8 蛋白质印迹法检测 将每孔2×105密度HCT116细胞接种于6孔板,贴壁后给予0、0.04、0.08、0.16 μM/L的SNX2112处理,孵育24 h后,弃去培养液,PBS冲洗,每孔加入含磷酸酶抑制剂和蛋白酶抑制剂的RIPA裂解液200 μL,用细胞刮将细胞全部刮下后置于离心管中,冰上静置30 min后离心取上清,BCA蛋白定量分析试剂盒(Thermo公司,美国) 检测蛋白浓度,95 ℃作用3 min使蛋白变性。配胶后上样,电泳,转膜,5%BSA封闭,一抗过夜,用 TBST 缓冲液 (Tris-Buffer Saline and Tween20,TBST) 洗膜后敷二抗常温1 h,TBST洗膜后滴加ECL发光液,使用ChenmiDocMP成像分析仪进行曝光。

2 结果
2.1 HSP90在结肠癌中的差异表达 TCGA数据库分析了一共520例结肠癌组织样本数据(包括正常组42例,结肠癌组478例),发现HSP90AA1在结肠癌中的表达上调(见图1)。
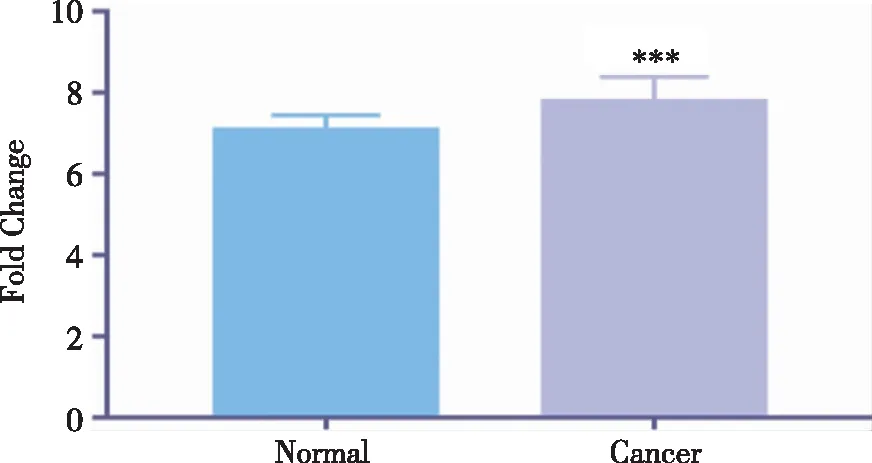
使用TCGA RNA- Seq数据进行分析,正常组42例,结肠癌组478例。 图1 HSP90AA1在结肠癌肿瘤组织及邻近正常组织中的表达水平
2.2 SNX2112对 HCT116 细胞活力的影响 不同浓度的SNX2112作用于HCT116后,MTT 检测结果显示,与0 μM/L SNX2112组相比,加药组尤其是高浓度SNX2112组的细胞活力明显减小,SNX2112抑制HCT116细胞活性有明显的时间-浓度依赖性。相同时间不同浓度SNX2112组之间差异有明显统计学意义(P<0.05) ,并且结果显示时间越长SNX2112对肿瘤细胞的细胞活力抑制越明显(见图2)。Graphpad Prism 6计算IC50值24、48、72 h分别为:24.26、0.02613、0.035 94 μM/L。
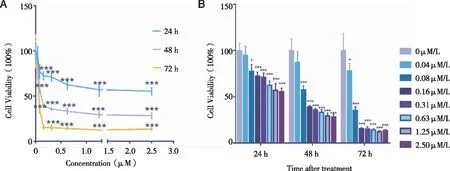
A:IC50 24 h:24.26μM/L;48 h:0.02613μM/L; 72 h:0.03594μM/L;B:MTT检测不同浓度SNX2112(0.04、0.08、0.16、0.31、0.63、1.25、2.50μM/L )分别给药24、48、72 h后HCT116细胞存活率。图2 SNX2112对结肠癌细胞株活力的影响
2.3 SNX2112阻滞HCT116细胞周期 进一步研究SNX2112对HCT116细胞周期的影响,流式细胞术结果显示,与不加药组(0μM/L组) 相比,给予SNX2112 0.08μM/L和0.16μM/L时,G2期HCT116细胞比例明显升高(见图3A),并且具有统计学意义(见图3B),低浓度0.04μM/L也会增加细胞G2期,但未达到统计学意义(P<0.05)。
2.4 SNX2112诱导HCT116细胞的凋亡 PI和Annexin V染色提示,与不加药组(0μM/L组)相比,0.04、0.08、0.16μM/L均可不同程度的促进肿瘤细胞凋亡,随着加药剂量增加,凋亡细胞所占总细胞数百分比明显上升(P<0.001,见图4 A、B)。
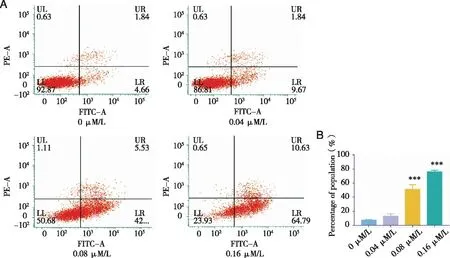
A:采用PI (y轴)和Annexin V (x轴)染色流式细胞术检测细胞凋亡,SNX2112在不同浓度处理HCT116细胞24 h;B:统计3次重复实验的结果,给药分别为0.00、0.04、0.08、0.16 μM/L时,3次实验凋亡细胞的平均比例分别为(7.41±0.80)%、(12.9±3.25)%、(50.87±6.96)%、(75.73±2.49)%。图4 SNX2112对结肠癌细胞的促凋亡作用
2.5 SNX2112抑制HCT116细胞迁移 细胞在低浓度血清1 640培养基(1%FBS RPMI-1640)培养下,在不同浓度的SNX2112作用后,分别于0、24、48 h拍照,高浓度SNX2112(0.08、0.16 μM/L)在培养48h后迁移面积与0h,0μM/L组对比具有统计学意义(P<0.05,见图5A、B)。

A:分别为不同浓度SNX2112(0.00、0.08、0.16μM/L)在给药0、24、48h的照片;B.统计3次重复实验的结果。图5 不同浓度SNX2112对HCT116细胞迁移的影响
2.6 不同浓度SNX2112 24 h对结肠癌信号蛋白STAT3、AKT及磷酸化水平检测 采用 Western Blot对结肠癌相关蛋白检测。不同浓度SNX2112给药24 h后对细胞内STAT3/AKT及磷酸化水平检测。结果显示,随着给药浓度的增加,上述蛋白表达随之降低(见图6)。0.04 μM/LSNX2112组(0.75±0.07 vs 1±0.12,P<0.05)、0.08 μM/LSNX2112组(0.43±0.05 vs 1±0.12,P<0.01)和 0.16 μM/L组(0.34±0.02 vs 1±0.12,P<0.01)肿瘤中p-STAT3分子的表达水平均明显低于未给药组(1±0.12)。与未给药组(1±0.08)相比,0.08 μM/L SNX2112组(0.76±0.07 vs 1.00±0.08,P<0.05)和0.16 μM/LSNX2112组(0.55±0.05 vs 1.00±0.08,P<0.01)中STAT3分子的表达水平均显著降低,而0.04 μM/L组(1.01± 0.08 vs 1.00±0.08,P=1.00)差异无统计学意义。0.16 μM/L SXN2112组p-AKT表达量较未给药组明显降低(0.38 ± 0.02 vs 0.65 ± 0.03,P< 0.05)。AKT各组间差异无统计学意义。
3 讨论
在我国结肠癌发生率以平均每年4%~5%的增速逐年增加,传统的治疗方法除手术以及化疗以外,分子靶向药物的应用极大改善了结直肠癌患者的预后,总生存期由过去的6~12月延长至近30月[12]。选择肿瘤细胞特异的靶点,应用针对该靶点的药物进行治疗,从而避免对正常细胞的伤害,取得高效低毒副作用的治疗模式,越来越被肿瘤治疗者所认同。HSP90抑制剂的发展从具有毒性的格尔德霉素,到药理特性受限的17-AAG,再到具有较强水溶性的17-DMAG(阿螺旋霉素)、IPI-504(瑞他霉素)以及其他具有更完善特性的新型合成小分子,其抗肿瘤的潜在价值也显得越来越突出。SNX-2112是一种结构新颖可口服的选择性HSP90抑制剂,具有广泛的抗肿瘤活性[13]。
既往研究表明,HSP90在多种癌症中过表达,包括乳腺癌、前列腺癌、肾癌、肝癌、多发性骨髓瘤和白血病。我们通过TCGA数据库中的结肠癌基因表达数据进行分析,证实HSP90基因HSP90AA1在结肠癌中的表达远高于正常组织,这意味着HSP90抑制剂在结肠癌中可能是一种有效的抗癌治疗。HSP90有400多个客户蛋白,包括激酶如AKT、CDKs、PKC以及转录因子等。AKT可以通过对下游多种途径对靶蛋白进行磷酸化从而发挥抗凋亡作用,例如磷酸化Bcl-2、磷酸化P53等对细胞凋亡、周期等进行调控。在肿瘤中,STAT3可以靶向Bcl-2、Bcl-X等抗凋亡基因,增殖相关蛋白Cyclin D1、Myc等从而延长细胞的生存周期,促进肿瘤的发生发展[14]。为了进一步证明SNX2112对下游蛋白的作用,我们选择用Western blot方法检测具有代表性的蛋白AKT、STAT3及其磷酸化蛋白的表达。实验结果显示,SNX2112作用于肿瘤细胞 24h 后,细胞内AKT、STAT3及其磷酸化蛋白的表达随SNX2112浓度增加而逐渐降低。
综上所述,本研究表明SNX2112不仅可以促进HCT116细胞凋亡,还能抑制其迁移能力并且可以在G2期对细胞周期阻滞。SNX2112的抗肿瘤效应与HSP90的客户蛋白降解、活性降低有关,并且HSP90的多种客户蛋白都在肿瘤通路中具有促进细胞生长、抑制凋亡的作用,所以SNX2112能够靶向多个通路多个靶点,具有更广泛的抗肿瘤效应,它会导致除STAT3、AKT之外的其他癌蛋白的降解,从而使抗癌或抑癌效应逐级放大,由此可见,SXN2112是一种很有临床应用前景的抗癌药物。但其抑制剂SNX2112对其余下游蛋白的抑制及其完全的作用机制还需进一步的研究。

