以胶原水凝胶为支架构建腺病毒三维培养系统
敖弟书,徐运娥,孙 欣,宋 鸿
(遵义医科大学 微生物学教研室,贵州 遵义 563099)
传染病严重威胁着公共卫生健康,在引起传染病的病原体中,来自人畜共患或媒介传播的病毒是最主要的[1]。病毒性疾病不但传染性强、流行性广,而且目前还没有特效药物治疗。病毒除了引起急性感染之外,还可以引起持续性感染,某些病毒甚至与肿瘤和自身免疫性疾病的发生密切相关[2-3]。因此,对病毒生物学性状、致病性和抗病毒药物的研究已成为医学和生命科学关注的热点。然而,病毒因缺乏能量代谢或蛋白质合成所需的遗传信息,只能在活细胞中生长,因此不能在体外无生命培养基中生长繁殖,分离培养较困难。常选用相应的容纳细胞、敏感动物或鸡胚进行分离与鉴定,分离培养出相应病毒是病毒性疾病病原学诊断的金标准,其中细胞培养是最常用的病毒分离、鉴定和研究方法[4]。
在体外研究病毒多采用细胞培养法,传统细胞培养常用玻璃或塑料培养瓶或板进行,此为二维(Two dimensional,2D)平面,常常无法模拟具有立体空间结构的细胞微环境——细胞外基质(Extracellular matrix,ECM)与细胞之间的相互作用,许多从组织分离进行二维培养的细胞会逐步失去分化表型[5]。近年来人们逐渐认识到,细胞外微环境中ECM、各种细胞因子等多种信号参与调节了细胞生长、增殖、分化和凋亡等生命活动[6]。为了能尽量模拟体内微环境,细胞培养技术进行了不断的改革与创新,多种三维(Three dimensional,3D)培养模型被报道出来,它们在肿瘤细胞体外研究、组织工程和再生医学中得到了广泛的应用[7]。近年来有学者将三维细胞培养模型应用于病毒的分离培养取得了成功[8-9],并观察到3D细胞培养的感染效率高于2D细胞培养[8-9]。然而,对于3D病毒分离培养,至今依然没有一个标准的模型。
目前所获得的关于病毒复制增殖、致病性和药物筛选等的知识多来源于二维细胞培养和动物实验模型,然而,体内组织细胞生活在具有三维立体空间结构的微环境中,传统二维培养方法不能反映微环境对病毒感染发生、发展的影响,因此建立病毒三维细胞培养模型,模拟体内病毒感染的微环境有助于深入研究病毒感染的机制及病毒与宿主之间的相互关系。水凝胶因大量含水不但能很好地给细胞提供营养,还能调节细胞的生长与分化,从而能模拟体内细胞生长的微环境,且具有可塑性高、临床应用方便等特点[10],被广泛用作三维细胞培养的支架材料。胶原蛋白在人体内含量丰富,因是天然材料免疫排斥反应小,且具有良好的生物相容性,可自组装形成胶原纤维网络水凝胶,因而是三维培养常用的支架材料。我们课题组已成功建立了多种细胞体外纳米自组装短肽和胶原水凝胶三维培养模型[11-12]。因此,本实验拟将病毒学技术与胶原水凝胶3D细胞培养技术相结合,建立胶原水凝胶293T细胞腺病毒三维培养模型,观察三维培养与传统细胞培养条件下病毒的增殖情况,为病毒性疾病的研究及抗病毒药物筛选和疫苗的研发提供新的理论和实验基础。
1 材料与方法
1.1 主要材料 293T细胞系购自武汉大学典型培养物保藏中心;腺病毒(空载体,带EGFP)购自上海吉凯基因科技有限公司;I 型鼠尾胶原(Collagen I)购自美国 BD 公司;DMEM培养基、胎牛血清购自美国 Gibco 公司;钙黄绿素 AM购自美国 Sigma 公司;MTS购自美国Promega 公司,病毒基因组DNA/RNA提取试剂盒购于天根科技有限公司,qPCR试剂盒购于Bio-Rad公司。
1.2 方法
1.2.1 扫描电镜表征胶原水凝胶 在冰浴中将1型鼠尾胶原稀释为终浓度1.5 mg/mL,然后用NaOH调节pH为7.2,取100 μL置于37 ℃培养箱30 min,待胶原形成凝胶后用2.5﹪戊二醛前固定,再梯度脱水,然后进行临界点干燥、贴样,离子溅射仪镀膜后扫描电镜(日本日立 SU8010 型扫描电镜)观察。
1.2.2 三维细胞培养 293T细胞接种于25 cm2培养瓶中,加入DMEM完全培养液(含10%胎牛血清)置于CO2培养箱,培养条件为37 ℃,5% CO2及饱和湿度。待细胞铺满90%后用0.05%胰酶消化,用预冷培养液制备细胞悬液,在冰浴中用3 mg/mL 1型鼠尾胶原(pH为7.2)溶液75μL与细胞悬液75 μL按1∶1充分混匀接种于24孔板(每孔5 × 104个细胞),置37 ℃培养箱30 min待胶原水凝胶成胶后每孔补加400 μL完全培养液,隔天换液,观察记录细胞生长情况。如需用96孔板进行细胞培养,则每孔25μL 3 mg/mL 1型鼠尾胶原(pH为7.2)溶液与25 μL细胞悬液混匀接种(每孔1.67 × 104个细胞),培养条件为37 ℃,5% CO2及饱和湿度。
1.2.3 MTS 测定细胞增殖情况 将293T细胞三维培养于96孔细胞培养板。分别在1、3、5、…… 29 d取6个复孔加入MTS 20 μL,孵育2 h后用490 nm波长测定吸光度值。
1.2.4 染色观察三维细胞增殖情况 24孔板三维培养293T细胞,分别在7、14、21、28 d用钙黄绿素-AM(Ca-AM)染色后荧光显微镜观察细胞活性。
1.2.5 三维病毒培养模型的建立及检测 293T细胞三维培养于24孔板,24 h后用DMEM清洗细胞三次接种腺病毒,每孔接种4×106拷贝腺病毒,置37 ℃培养,24 h后吸出病毒液,再用DMEM清洗3次,加入完全培养液,感染后每天观察、记录感染情况。
1.2.6 MTS 测定病毒感染后细胞增殖情况 293T细胞三维培养于96孔板,24 h后感染腺病毒(1×106拷贝腺病毒每孔),分别在感染后1、3、5、…… 27 d取6个复孔加入MTS 20 μL,孵育2 h后490 nm波长测定吸光度值。
1.2.7 透射电镜观察腺病毒在3D培养293T细胞中的增殖情况 收集24孔板内腺病毒感染7 d后的三维培养细胞(水凝胶及细胞)用于透射电镜观察。三维培养水凝胶用1%锇酸于4 ℃下固定3 h,乙醇梯度脱水,Spurr树脂浸透包埋,超薄切片(厚度70 nm),醋酸双氧铀和柠檬酸铅染色,JEM1230 型透射电镜(JEOL,Japan)在80 kV加速电压下检查样本。
1.2.8 实时荧光定量PCR观察病毒增殖情况 293T细胞三维培养于96孔板,接种后24 h感染腺病毒(1×106拷贝腺病毒每孔),分别在感染后1、3、5、…… 27 d收集细胞及上清保存于-20 ℃。使用病毒基因组DNA/RNA提取试剂盒(天根DP315)根据说明书提取病毒DNA,使用BIO-RAD qPCR试剂盒进行扩增(引物为腺病毒标记EGFP:5’-TTCAAGATCCGCCACAACA-3’和5’- CGCTTCTCGTTGGGGTC-3’)。反应体系为20 μL,扩增条件为 95 ℃ 2 min,95 ℃ 5 s、60 ℃ 30 s 39个循环,65 ℃~95 ℃溶解曲线,每次扩增设置阴性(水)和阳性(腺病毒标准品)对照。反应结束后系统自动生成标准曲线,计算出对应样品中完整病毒基因组的拷贝数。
1.2.9 三维扩增病毒感染性测定 三维腺病毒感染7 d后收集上清(PCR扩增定量后用1×106拷贝)再感染二维培养293T细胞,分别在感染后2、4、6 d收集上清及细胞,提取DNA后进行PCR扩增。

2 结果
2.1 扫描电镜表征胶原水凝胶支架材料的结构特征 1型鼠尾胶原为温敏型水凝胶,在0 ℃为液体,37 ℃时可自组装成纤维形成水凝胶。SEM可见1型鼠尾胶原自组装成高度交叉链接的胶原纤维,这些纤维彼此缠绕形成3D网络(见图1)。由此可见胶原水凝胶可作为三维培养支架进行细胞3D培养。
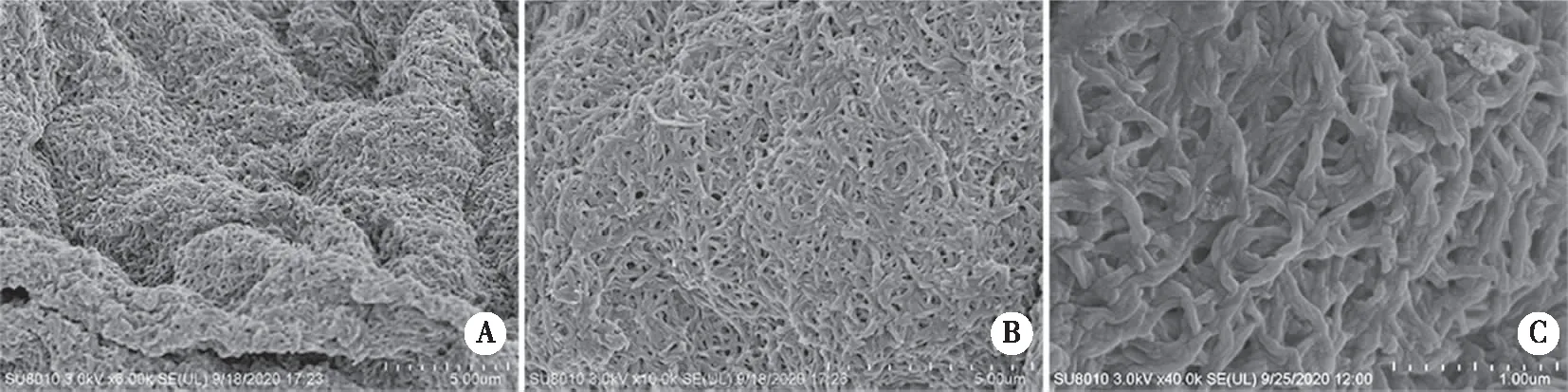
图1 胶原水凝胶在SEM下的结构特征
2.2 胶原水凝胶三维培养中293T细胞的增殖情况 二维培养时,293T细胞4~6 h开始贴壁,18~24 h完全贴壁呈单层扁平多形态生长,细胞生长铺满瓶底后部分会重叠生长,逐渐脱落,不能长时间培养。而胶原水凝胶三维培养中细胞刚开始为分散的单个细胞,经3 d左右分裂生长形成细胞微球体,细胞微球体随着培养时间的延长逐渐增大,呈球形或近似球形(见图2)。细胞微球体增殖活性较好,从第3天开始快速增殖,13 d达高峰,之后增殖逐渐减少,28 d依然能见少量活细胞(见图3、4)。这些结果表明三维培养细胞生长形态与二维培养不同,且能长时间培养,这类似于细胞在体内微环境下的生长情况,因而可用于长时间模拟体内微环境的体外研究。
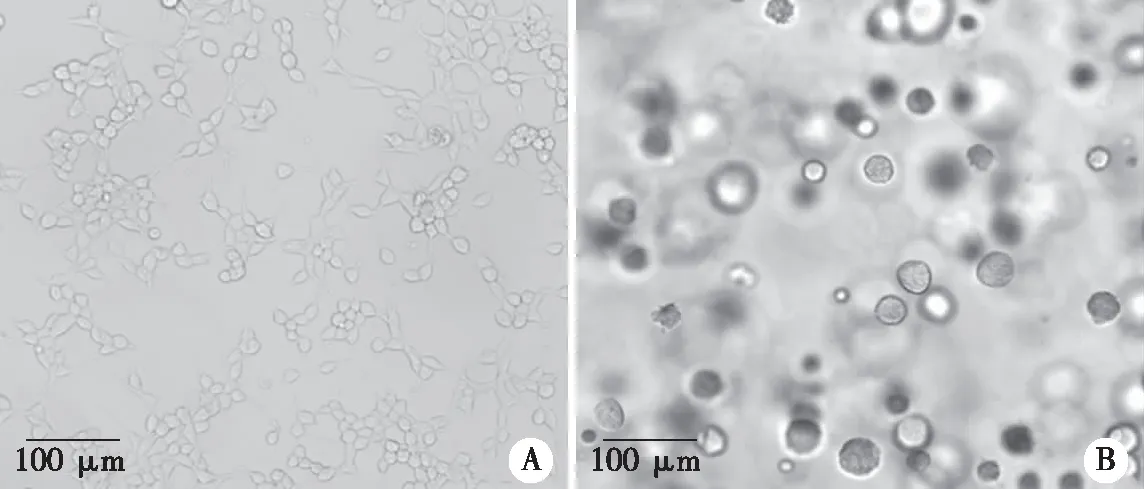
图2 293T细胞在2D和胶原水凝胶3D培养系统中的形态
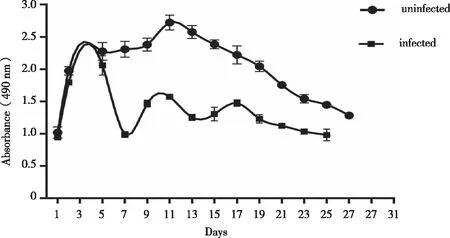
图3 胶原水凝胶中293T细胞感染腺病毒前后的增殖活性

BF:293T细胞在胶原水凝胶3D培养体系中不同时间的相差图,细胞形成微球体生长,随着培养时间延长,球体逐渐增大,开始球体表面光滑,随着培养时间增加,球体表面开始出现凸起等改变,培养26~28 d,部分微球体开始溶解;Ca-AM:293T细胞在3D培养系统中不同时间的荧光染色图,绿色示活细胞。图4 293T细胞在胶原水凝胶3D培养体系中的生长及活性分析
2.3 病毒在三维培养293T细胞中的增殖情况 为了能更直观观察腺病毒的增殖情况,我们用增强绿色荧光蛋白(EGFP)标记腺病毒。在二维培养中腺病毒感染293T细胞18~24 h开始出现荧光,48~72 h最强,此时细胞全部出现CPE,4~6 d逐渐坏死脱落,不能长时间培养;而在胶原水凝胶3D培养体系中,293T细胞感染腺病毒后60~72 h才能见荧光细胞团,且少和弱,初始荧光细胞团主要分布于水凝胶边缘,随着培养时间延长逐渐增多明显,在培养第7天时荧光细胞团多且明亮,之后逐渐减少,随之又增加,如此反复多次。三维培养感染腺病毒的293T细胞微球体在6~9 d开始出现形态改变,能见少部分细胞团表面凹凸不平或少量细胞脱落,12~14 d少部分细胞微球体开始溶解,水凝胶内细胞团变少,部分变小,大小不均。19~21 d能见大部分细胞微球体溶解,26~28 d几乎全部细胞团溶解,水凝胶内能见大量单个圆形细胞和细胞裂解碎片(见图5)。为了便于观察腺病毒感染三维培养293T细胞后的病理改变和细胞内增殖的病毒颗粒,本研究用透射电镜进行了检测,结果显示293T细胞病变明显,出现内质网扩张、线粒体肿胀、破裂等改变,在胞浆中能观察到少量病毒颗粒,直径60~90 nm(见图6)。为明确病毒的增殖量,进一步进行了qPCR扩增定量检测,结果显示腺病毒在3D体系中呈多峰增殖,第7天峰值最高达3.09×108copies/mL,而后出现3次小高峰,分别是13、19和23 d。同时,为了排除腺病毒是否会在水凝胶中大量存留而影响实验结果,我们对不含细胞的水凝胶进行了腺病毒感染分析,结果显示,在水凝胶和上清液中未检测到病毒DNA(见图7A)。以上表明腺病毒能感染胶原水凝胶三维培养的293T细胞,并能在此三维培养模型中持续长时间增殖。
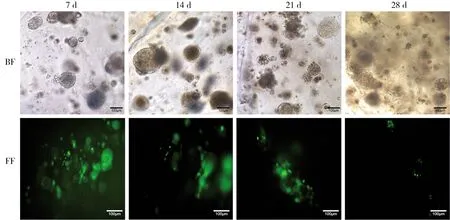
BF:胶原水凝胶3D培养293T细胞感染腺病毒后7、14、21、28 d的相差图,随着感染后培养时间的延长,细胞微球体出现凹陷、囊泡、溶解等改变,感染后28 d见大部分细胞微球体溶解,水凝胶中能见溶解后的单个细胞或细胞碎片;FF:带EGFP的腺病毒感染3D培养体系中293T细胞的荧光图,随着感染时间延长,病毒增殖逐渐减少,但增殖持续时间较长。图5 胶原水凝胶中293T细胞感染腺病毒后的形态特点及腺病毒增殖情况
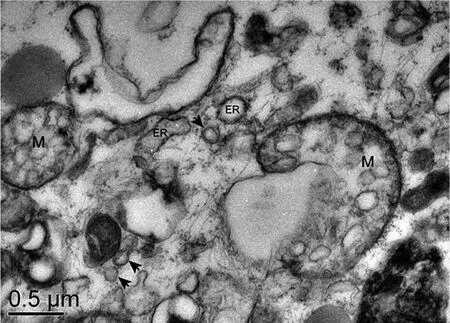
箭头所示为病毒颗粒,M:线粒体,ER:内质网。 图6 TEM观察胶原水凝胶3D培养体系中的病毒颗粒及细胞病变
2.4 胶原水凝胶三维培养体系中293T细胞感染腺病毒后的增殖活性 胶原水凝胶中293T细胞在感染腺病毒5 d后增殖活性逐渐减弱,第7天最低,此后呈现出逐渐增强而后减弱的趋势,在第17天后细胞增殖活性持续降低(见图3)。
2.5 胶原水凝胶三维培养体系中腺病毒复制子的感染性 如图7B所示,此三维培养体系中培养增殖出的腺病毒颗粒可成功感染二维培养293T细胞,并能在此细胞中持续增殖,且增殖趋势与标准品感染组一致(见图7B)。
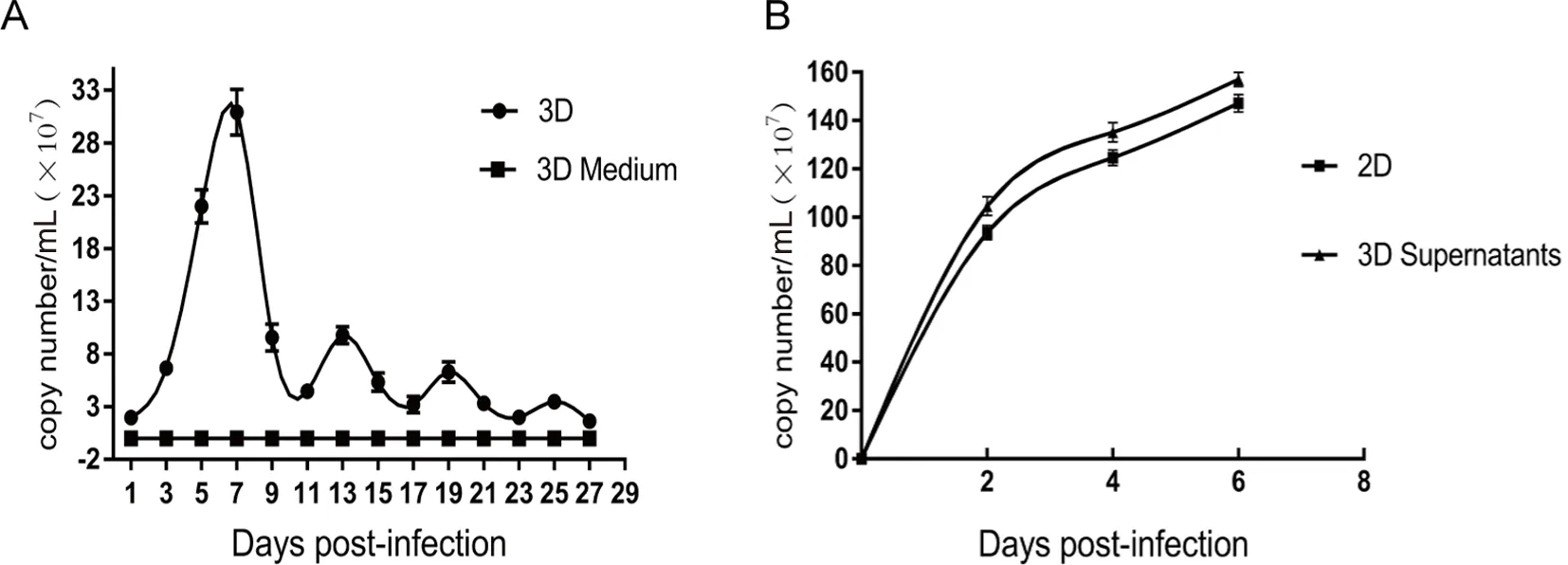
A:qPCR测量腺病毒在293T细胞3D培养物中的增殖情况;3D为三维腺病毒扩增;3D Medium为水凝胶感染腺病毒后扩增;B:qPCR测量三维扩增腺病毒的感染性;2D为二维标准腺病毒扩增;3D supernatants为三维腺病毒感染7 d后收集上清再感染二维293T细胞后收集上清及细胞PCR扩增。图7 qPCR检测腺病毒增殖情况
3 讨论
本实验使用的三维培养支架材料胶原水凝胶,是由自组装的胶原纤维交联形成的凝胶网络,小分子物质可以自由进出,因而可使分散于水凝胶中的细胞都能获得营养,且胶原蛋白为天然材料,免疫排斥反应小,因此胶原水凝胶具有良好的亲水性和生物相容性,适合用作三维培养的支架材料[10]。本研究观察到293T细胞能在胶原水凝胶中长时间良好生长,细胞分裂生长形成致密的多细胞球体,这与传统二维培养不同。由于3D培养系统通过提供可重现的、可控制的微环境来模拟生理条件,且易于操作、分析和成像,因此,3D细胞培养有望部分替代动物模型进行实验研究[13]。细胞培养是病毒分离培养和鉴定常用的方法,3D病毒培养模型能部分代替动物模型模拟体内微环境用于病毒的研究,避免了动物对多数人类病毒不敏感、感染后症状不明显和动物体内常带有潜在病毒对研究的影响。
腺病毒直径60~90 nm,理论上该病毒可以通过胶原水凝胶的支架孔隙感染293T细胞。本研究发现在胶原水凝胶三维培养体系中,293T细胞感染腺病毒7 d后透射电镜下观察到胞内病毒颗粒,这说明腺病毒已经通过胶原水凝胶支架孔隙感染了其内生长的293T细胞。在体内,病毒感染易感细胞并于胞内增殖释放出大量子代病毒会再次感染周围细胞,引起细胞病变和相应临床症状。在体外二维培养时细胞呈单层平面生长,接种病毒后,病毒能在短时间内吸附于细胞表面,随后穿入细胞大量增殖,病毒感染的细胞很快出现CPE,逐渐坏死、脱落,因而无法维持长时间培养研究。然而在三维培养系统中,单个细胞分裂后形成微球体生长,病毒通过细胞微球体表面受体吸附于其表面,首先感染微球体最外层细胞,于胞内复制扩增后释放出大量子代病毒,复制子再感染微球体中心细胞或邻近细胞团,而未被感染的细胞继续分裂生长,因而在三维培养体系中病毒增殖时间比二维大大延长,早期观察不到明显的细胞微球体改变,且出现多个增殖峰的特点,这符合病毒感染体内细胞的增殖过程(即感染、释放、再感染)。而这一研究结果与Ao、Chen和Berto等在病毒三维培养研究中的报道类似[8,14-15],因此,与二维培养相比,病毒三维培养更能模拟体内病毒感染增殖的过程。但文献中不同病毒在不同三维体系中出现增殖峰的时间和持续增殖时间有所差异,这可能与病毒自身的复制周期、宿主细胞的易感性或使用的三维培养材料不同等因素有关。
本研究以1型鼠尾胶原为三维支架材料成功构建了腺病毒体外三维培养模型,但不可否认,本研究中还存在一些不足。首先,虽然研究结果支持腺病毒可在胶原水凝胶293T细胞三维培养体系中持续长时间增殖,但由于使用的是腺病毒空载体,且没有进一步进行病毒感染机制的研究,是否其他病毒也能在此三维培养体系中长期持续增殖还有待更多的研究证实;其次,随着3D细胞培养技术的不断发展,研究者们清晰认识到支架材料的机械性能(如材料硬度、孔隙结构)和生化特性(如生物相容性、可降解性)对细胞的活力、黏附、分化、迁移等都可能产生重要影响[16],虽然胶原本身是天然材料具有免疫排斥反应小、生物相容性好、可降解、力学性能好等优点,但它依然存在孔隙不均匀、可能含有潜在病原体等问题;第三,三维培养不像二维培养细胞生长在同一平面,病毒感染后能观察到明显的CPE现象,如能在研究中测定病毒感染后每个细胞微球体的平均大小、密度和荧光强度的变化更能体现病毒的增殖特点。总之,机体是一个多细胞多器官多组织共存的复杂环境,病毒感染机体、在体内进行复制增殖、引发疾病等一系列病理过程,均不只有单一细胞参与,而是多细胞多组织共同参与的一个复杂的病理生理过程。因此,若能利用水凝胶构建出多种细胞的3D共培养模型,对于研究宿主与病毒之间的相互作用将有重要意义。
综上所述,本研究成功构建了腺病毒体外三维培养模型,我们希望此模型能用于病毒性疾病致病机制、抗病毒药物筛选和疫苗的研究。因腺病毒是常用的遗传研究工具和基因载体,我们也希望此模型能用于基因治疗等多个领域的研究。

