siRNA干扰HepG2.2.15细胞BUBR1基因及对细胞增殖的影响
周艳萌,向晓波,王 欢
(1.遵义医科大学 基础医学院微生物学教研室,贵州 遵义 563099;2.遵义医科大学附属口腔医院,贵州 遵义 563099)
乙型肝炎病毒(Hepatitis B virus,HBV)仍然是世界大多数地区肝细胞癌(Hepatocellular carcinoma,HCC)的主要病因,中国的肝细胞癌发病率居世界前列[1]。有丝分裂检查点基因BUBR1(Mitotic checkpoint serine/Threonine kinase B)与酵母细胞Mad3同属一个家族基因,其编码的BUBR1蛋白是有丝分裂纺锤体组装检查点(Spindle assembly checkpoint,SAC)基因中的重要组分,在染色体分离、招募有丝分裂检查点复合体成员和激活纺锤体检查点等方面发挥着重要作用[2]。有研究发现,在约45%的HCC中BUBR1呈高表达;在BUBR1表达增高者中,大多数人的血清HBsAg呈阳性,BUBR1基因可能在肝癌的发生、发展、侵袭或复发中起重要作用[3-4]。Kim等[5]的研究指出:BUBR1是有丝分裂检查点复合体(Mitotic checkpoint complex,MCC)的关键成分,是HBx病毒癌蛋白的靶点。HBx-BUBR1相互作用破坏了MCC中CDC20的结合,表达HBx的细胞经历了错误的有丝分裂过程。近年来,有研究发现HepG2.2.15细胞对5-FU、ADM、Amn等化疗药物的敏感性明显低于HepG2细胞,提示HBV感染与肝癌细胞对化疗药物耐药的发展可能有一定关系[6-7]。本研究利用慢病毒载体和RNAi干扰技术构建慢病毒介导的BUBR1沉默载体,沉默稳定转染了HBV全基因组的肝癌细胞HepG2.2.15的BUBR1基因,并筛选出稳定沉默BUBR1基因的细胞株,为研究HBV所致肝细胞癌化疗耐药与BUBR1基因的关系提供一种新的实验手段。
1 材料与方法
1.1 材料 HepG2.2.15细胞株由遵义医科大学微生物学与免疫学实验室提供。293T细胞、大肠杆菌菌株DH5α、慢病毒包装质粒psPAX2、pMD2.G、表达质粒phU6-CMV-GFP-puro (含氨苄霉素抗性基因、嘌呤霉素抗性基因)shRNA载体购自上海吉凯基因公司。DMEM培养基、0.25%胰蛋白酶、胎牛血清购自Hyclone公司。转染试剂Lipofectamine2000和嘌呤霉素购于美国Invitrogen公司。质粒提取试剂盒、TRNzol总RNA抽提试剂盒、荧光定量PCR试剂盒购自日本Takaya公司。
1.2 方法
1.2.1 构建慢病毒介导BUBR1沉默载体 用AgeI、EcoRI两种内切酶对phU6-CMV-GFP-puro载体进行酶切,酶切产物进行琼脂糖电泳,然后回收目的片段。从GenBank中查找人BUBR1基因cDNA序列(NM_001211),根据RNAi设计原则,设计并合成3对靶点序列(大写为引物序列,小写为保护基因):siRNA-1:5′-ccggccTCAGAAAGCATCACCTCAActcgagTTGAGGTGATGCTTTCTGAggttt-ttg-3′; siRNA-2:5′-ccggccAGTGTACCTTTCTCCATTTctcgagAAATGGAGAAAGGTACA-CTggtttttg-3′; siRNA-3:5′- ccgggaGACAACTAAACTGCAAATTctcgagAATTTGCAGTTT-AGTTGTCtctttttg-3′。同时合成RNAi阴性对照scrambled序列。以上序列分别进行退火获得双链DNA,通过 T4 DNA 连接酶将双酶切线性化的载体和退火双链 DNA 连接,将10 μL交换反应产物加入到100 μL感受态细胞DH5α转化,用氨苄培养基筛选阳性菌落进行测序,将测序正确的菌液转接于10 mL含氨苄的LB 液体培养基中,37 ℃培养过夜,用天根无内毒素质粒抽提试剂盒进行质粒抽提。
1.2.2 慢病毒的包装 对数生长期的293T 细胞,以含10%血清的培养基调整细胞密度约5×106细胞/15 mL,重新接种于10 cm细胞培养皿,37 ℃、5% CO2培养箱内培养。24 h细胞密度达70%~80%时,用脂质体Lipofectamine2000将包装质粒psPAX2、pMD2.G和表达质粒转染293T细胞,培养6 h后弃去含有转染混和物的培养基,PBS液清洗一次,加入含10%血清的细胞培养基继续培养48 h。收集转染后48 h(转染即可计为0 h)的293T细胞上清液,于4 ℃ 4 000 g离心10 min,收集上清液,并用 0.45 μm滤器过滤。将过滤后的病毒上清液以离25 000 rpm、4 ℃离心2 h,弃去上清,加入病毒保存液放-80 ℃保存备用。
1.2.3 病毒滴度检测 病毒原液10 μL与无血清培养基90 μL进行10-1~10-7梯度稀释。胰酶消化293T细胞并调整浓度为 4×104个/mL细胞悬液,接种于96孔板,每孔100 μL,培养24 h后,吸弃90 μL原培养基,每孔加入90 μL稀释好的病毒液,每个稀释度3个复孔,感染24 h后每孔再加入100 μL完全培养液,48 h后观察荧光表达情况,病毒滴度(TU·mL-1)=1 000×荧光细胞个数/每孔的病毒液量(μL)。
1.2.4 慢病毒感染HepG2.2.15及稳转细胞株的筛选 生长旺盛的HepG2.2.15细胞以2.5×104/孔接种24孔板,在37 ℃ 5%CO2的环境中培养24 h。第2天换含完全培养液并用收获的病毒以MOI=1、10、100(病毒滴度:1×109TU/mL)每孔加入3 μL病毒,空白组加入等量完全培养液。实验分组:1.空白对照组:HepG2.2.15细胞;2.阴性对照组:HepG2.2.15+慢病毒NC;3.实验组:①沉默1组:HepG2.2.15+ siRNA-1;②沉默2组: HepG2.2.15+siRNA-2;③沉默3组:HepG 2.2.15+ siRNA-3。感染12 h换为常规完全培养液继续培养,感染72 h后在倒置荧光显微镜下观察带有绿色荧光的HepG2.2.15细胞。传代后换含嘌呤霉素终浓度3 μg/mL的培养基筛选,得到稳定的细胞克隆。
1.2.5 Real-time PCR检测BUBR1沉默效果 收集上述各组细胞检测BUBR1 mRNA的表达量,TRNzol抽提细胞总RNA,根据逆转录试剂盒说明书进行操作,合成cDNA。取2 μL逆转录产物、总体系20 μL,采用SYBR Green染料进行Real Time PCR反应,以β-actin为内参。引物序列:BUBR1基因:上游引物为5′-GCACCGACATTCCAAGCTC-3′;下游引物为5′-TGTGCTTCGTTGTGGTACAGA-3′;内参β-actin:上游引物:5′- TCCTGTGGCATCCACGAA-3′;下游引物:5′- GAAGCATTTGCGGTGGAC -3′。PCR扩增反应条件为:95 ℃预变性30 s,95 ℃变性5 s,57.5 ℃延伸10 s,共进行40个循环。实时荧光定量PCR检测BUB1B在HepG2.2.15中的表达,BUBR1mRNA相对表达量用2-△△Ct值表示[8]。
1.2.6 MTT法检测沉默对细胞增殖的影响 各组细胞以浓度5×104个/mL细胞数接种于96孔板,每孔100 μL,每组设6个复孔。培养24、48、72 h后每孔加入20 μL MTT溶液,继续培养4 h后弃上清,每孔加入150 μL的DMSO溶解甲瓒颗粒,在酶标仪波长492 nm下检测各孔吸光度值(OD),计算细胞存活率[9]。细胞存活率=实验组OD值 /对照组OD值×100%。

2 结果
2.1 重组慢病毒质粒测序鉴定 对3个干扰组重组载体阳性克隆进行测序鉴定。测序结果证明干扰载体中的特异性干扰序列完全正确(见图1),说明靶向BUBR1基因重组慢病毒载体phU6-CMV-GFP-puro构建成功。
A:siRNA-1;B:siRNA-2;C:siRNA-3。图1 重组慢病毒载体BUBR1shRNA测序鉴定结果
2.2BUBR1shRNA重组慢病毒包装和滴度测定 测序鉴定正确的BUBR1shRNA重组慢病毒转染293T细胞,48 h后在荧光显微镜下可见绿色荧光(见图2),说明BUBR1shRNA重组慢病毒转染成功。根据镜下荧光细胞个数和每孔病毒液的量计算病毒滴度约为10-9TU/mL。

A:正常293T细胞;B:包装siRNA-1的293T细胞;C:包装siRNA-2的293T细胞;D:包装siRNA-3的293T细胞。图2 荧光显微镜观察包装了重组慢病毒BUBR1 shRNA的293T细胞(标尺:50 μm)
2.3 重组慢病毒BUBR1shRNA转染HepG2.2.15细胞 制备成功的重组慢病毒BUBR1shRNA感染HepG2.2.15细胞,72h后在倒置荧光显微镜下观察,MOI=10条件下阴性对照组和各实验组的细胞形态不受影响,转染率均达80%以上。用嘌呤霉素筛选得到了稳定的慢病毒感染细胞株(见图3)。

A:空白对照组;B:阴性对照组;C:沉默1组;D:沉默2组;E:沉默3组(1.明场;2.荧光)。图3 荧光显微镜观察重组慢病毒BUBR1shRNA转染HepG2.2.15细胞(标尺:50 μm)
2.4 Real-time PCR检测BUBR1沉默效果 荧光定量PCR检测结果显示沉默组3对shRNA靶点转染HepG2.2.15细胞后,均显著下调BUBR1mRNA的转录水平,组间比较差异具有显著性(P<0.05),沉默3组沉默效果最好;与空白对照组和阴性对照组比较差异也具有显著性(P<0.01)。阴性对照组BUBR1mRNA的转录表达水平上调,与空白对照组比较有统计学意义(P<0.01,见图4)。
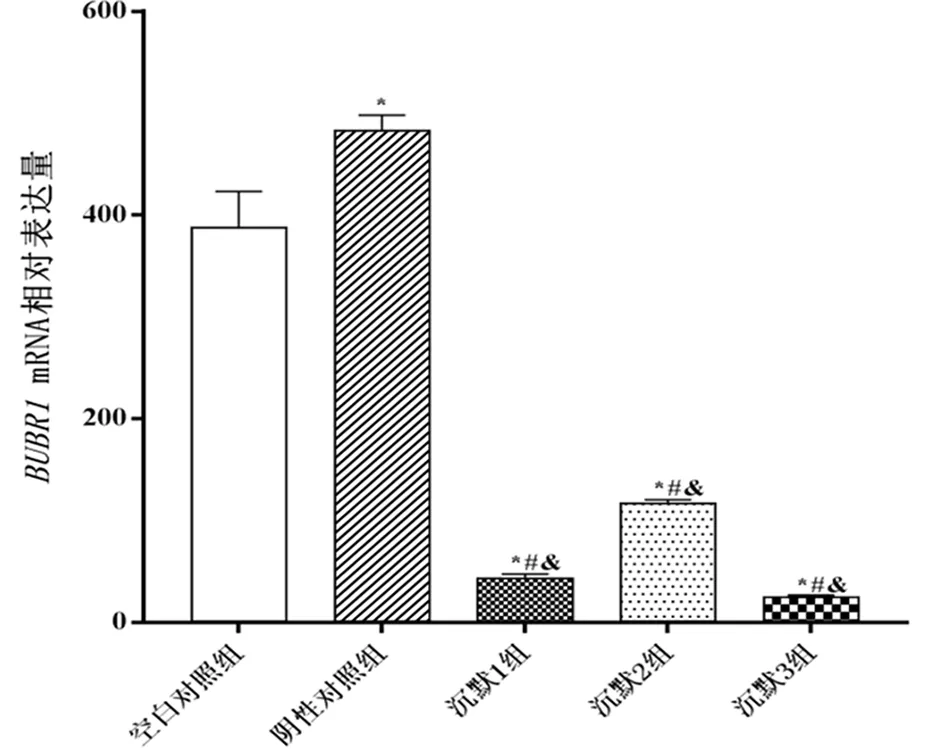
*:与空白对照组比较,P<0.01;#:与阴性对照组比较,P<0.01;&:沉默组组间比较,P<0.05。图4 HepG2.2.15细胞中BUBR1 3个靶点沉默效率比较
2.5 MTT法检测各实验组细胞增殖的情况 利用MTT法观察BUBR1沉默后对HepG2.2.15细胞增殖能力的影响,结果显示阴性对照组作用24h对HepG2.2.15细胞具有短暂的促增殖作用,但是随着感染时间的延长细胞的增殖明显被抑制作用,与空白对照组比较差异有显著性(P<0.05);沉默组感染后24 h及48h对HepG2.2.15细胞也有促进增殖的趋势,与空白对照组比较有差异(P<0.05),感染72 h对细胞增殖没有影响,与空白对照组比较无差异(P>0.05,见表1)。
表1 BUBR1沉默对HepG2.2.15细胞增殖的影响
3 讨论
多种危险因素与肝癌的发生有关,慢性HBV感染是世界范围内HCC最重要的病因之一。BUBR1是有丝分裂纺锤体检查点的一个关键组成部分,它可以通过阻断染色体与纺锤体的正确连接来防止染色体分离错误[10],近年来越来越多有关肿瘤方面的研究聚焦在这个重要的因子上。有研究[3]发现在HCC进展中BUBR1呈过度表达,BUBR1可以作为估计HCC生物学特性的潜在肿瘤生物标志物。在肿瘤的治疗中,常通过抗癌药物诱导基因损伤,激活细胞周期检测点信号传导通路,从而使细胞分裂停滞或者诱导其凋亡。但是,许多因素影响了肿瘤对化学药物的敏感性,其中重要的因素之一就是检测点成分表达异常所致的检测点功能失常。因此,BUBR1在肿瘤治疗中也倍受关注。以病毒为载体的转染方法具有转染率较高、基因表达时间较长等优点。慢病毒是以人类免疫缺陷病毒I型(Human immunodeficiency virus-1,HIV-1)为基础发展起来的一种基因载体,它利用HIV能将自身基因组插入整合到宿主基因组的特性获得病毒载体,再通过病毒载体转染靶细胞,经嘌呤霉素等抗性筛选后即可获得稳定转染的细胞株[11]。本实验利用慢病毒成功构建了phU6-CMV-GFP-puro-shRNA-BUBR1慢病毒干扰质粒载体,测序证明干扰载体中的特异性干扰序列完全正确,利用该载体成功转染293T细胞,收集到滴度约为10-9TU/mL病毒液,以此病毒液感染HepG2.2.15细胞后,阴性对照组及沉默各组均可以在荧光显微镜下检测到绿色荧光,Real-time PCR证实沉默各组细胞中的BUBR1表达较空白对照组、阴性对照组显著降低,说明构建的载体病毒能有效沉默HepG2.2.15细胞中的目的基因,经嘌呤霉素筛选2周获得稳定沉默BUBR1的HepG2.2.15细胞系。有研究提出在BUBR1表达增高者中大多数人的血清HBsAg呈阳性[3-4],Lira等[12]研究也发现HPV感染可能与口腔鳞状细胞中BUBR1的过度表达有关,说明有些病毒的感染可能会导致BUBR1的过度表达,本实验中阴性对照组BUBR1表达明显高于空白对照组,说明慢病毒的感染可能会导致BUBR1的过度表达。不管使用哪种病毒载体,其MOI和最佳转染时间都是非常重要的[13]。实验中筛选到的最佳MOI为10,在此MOI下阴性对照组和沉默组对HepG2.2.15细胞的形态均无明显影响。沉默3个组的BUBR1基因沉默效果均很好,以第3组沉默效果最好。MTT结果提示沉默组对HepG2.2.15细胞的增殖没有影响,沉默后24、48 h对细胞有一定促增殖作用;阴性对照组感染24 h也有短暂的促增殖,但是随着时间的延长细胞的增殖被抑制,其原因可能是由于HepG2.2.15细胞是由HBV全基因组转染HepG2肝癌细胞而来[14],当慢病毒载体同时也插入细胞基因组中24h时慢病毒尚没有进行增殖,没有影响HepG2.2.15细胞的增殖,随着培养时间的延长,慢病毒也在细胞中增殖,但是最终是由于慢病毒的增殖影响HepG2.2.15细胞的增殖呢,还是HepG2.2.15细胞分泌的HBV相关抗原影响了细胞在增殖,还是二者共同作用影响了细胞的增殖呢?我们还需要进一步实验证实。总之,我们成功建立了稳定沉默BUBR1的HepG2.2.15细胞系,可以为下一步研究HBV所致肝细胞癌对化疗药物耐药性与BUBR1之间的关系提供一个工具。
——一道江苏高考题的奥秘解读和拓展

