典型畜禽粪污中雌激素排放特征
胡双庆, 袁哲军,2, 沈根祥*
1.上海市环境科学研究院, 上海 200233
2.上海纺织节能环保中心, 上海 200082
规模化畜禽养殖业在快速发展的同时也给环境带来了雌激素污染风险. 据估计,环境中90%的天然雌激素来源于畜禽动物排泄物[1-2],且排泄物中雌激素的种类和含量因畜禽动物类型、性别及其生长发育阶段的不同而存在差异[3],猪和家禽主要通过尿液排放雌激素,而奶牛和羊主要通过粪便排放雌激素[4],猪主要排放E1(estrone,雌酮)、E2(17β-estradiol,雌二醇)和E3(estriol,雌三醇),而奶牛主要排放E1和E2[3,5]. 人工合成雌激素炔雌醇(17β-ethinylestradiol,EE2)和己烯雌酚(diethylstilbestrol,DES)因具有促进动物生长和体质量增加的作用,而被用作激素类药物或饲料添加剂应用到畜禽养殖过程中. 进入环境中的天然和人工合成雌激素具有很强的内分泌干扰活性[6-7],如它们能够在ngL痕量水平诱导雄鱼雌性化[8-9],致使鱼类胚胎发育迟滞和畸形[10-11],胁迫微生物群落结构发生改变[12-13]. 因此,畜禽养殖业雌激素污染风险应当引起足够重视.
近年来,畜禽养殖业雌激素污染及其控制逐渐成为研究热点[14-16]. 目前对河流水体中雌激素污染特征进行研究的报道[17-19]较多,但对畜禽养殖场雌激素的排放特征研究报道相对较少. 再者,畜禽粪污基质较为复杂,样品前处理难度大,这给畜禽粪污雌激素研究带来了挑战. 上海市畜禽养殖规模大、养殖类型多样化,养殖过程雌激素污染风险不容忽视. 因此,该研究通过建立固相萃取-高效液相色谱串联质谱(SPE-HPLC-MSMS)分析方法,对上海市典型畜禽养殖类型排放的5种天然和人工合成雌激素(E1、E2、E3、EE2和DES)进行定量检测,分析其总体分布特征和检出水平,并通过比较畜禽排泄物经处理设施处理前后雌激素含量水平的差异,分析不同处理方式下雌激素的去除效率,以期为畜禽养殖雌激素污染风险管控提供参考.
1 材料与方法
1.1 试剂与仪器
仪器:5500Q-trap高效液相色谱串联质谱仪(美国AB公司),配MultiQuant 3.0.2软件;12通道固相萃取装置(美国Waters公司);超声波清洗器(KQ3200E,昆山市超声仪器有限公司);pH计(S220,梅特勒-托多仪器(上海)有限公司);Milli-Q超纯水器(美国Millipore公司);氮吹仪(Anpel 12通道,上海安谱实验科技股份有限公司);旋转蒸发仪(艾卡仪器设备有限公司上海分公司);微波萃取仪(MARS CLSSIC,美国CEM公司);低温真空冷冻干燥机(上海昊博低温真空有限公司).
试剂:甲醇、乙腈、正己烷、二氯甲烷均为HPLC级,均购自美国Tedia公司. E1(雌酮,纯度为99.3%,)、E2(17β-雌二醇,纯度为97.5%)、E3(雌三醇,纯度为99.5%)、EE2(炔雌醇,纯度为99.0%)、DES(己烯雌酚,纯度为99.5%)、17β-E2-d3(17β-雌二醇-d3,纯度为98.0%)、EE2-d4(炔雌醇-d4,纯度为98.0%)和DES-d8(己烯雌酚-d8,纯度为98.0%)均购自德国Dr. Ehrenstorfer公司. 上述标准品均用甲醇配成标准储备液. 混和标准溶液中5种物质的含量均为100 mgL. 根据需要用甲醇配制标准工作溶液,于4 ℃冰箱中保存.
1.2 样品的采集与保存
选择上海市畜禽养殖业相对集中的区域,针对3种不同养殖类型(猪、奶牛、鸡)分别采集粪便、尿液、有机肥和污水样品,向样品中加入4 molL的盐酸防止微生物对目标物质的降解作用. 样品快速运回实验室后,放入-20 ℃冰箱冷冻保存. 试验前取出解冻,粪便样品经低温真空冷冻干燥机干燥24 h后待用. 不同畜禽养殖场的养殖规模、粪便污水处理方式等基本信息见表1.
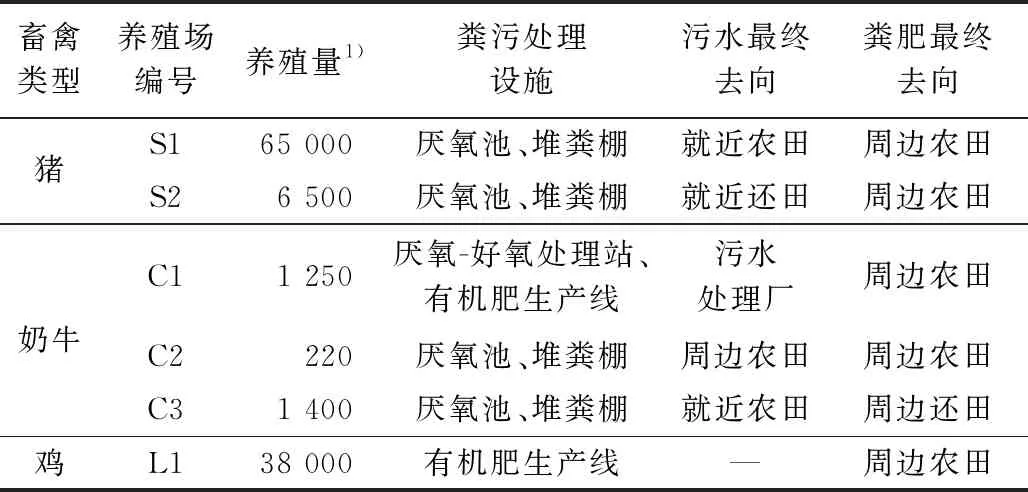
表1 不同畜禽养殖场养殖规模及粪污处理方式
注: 1)猪和奶牛养殖量的单位为头a,鸡养殖量的单位为羽a.
1.3 液体样品前处理方法
分别量取10 mL尿液样品和100 mL污水样品,用超纯水稀释至500 mL,水样经玻璃纤维滤纸(孔径0.7 μm)过滤后,在每个样品中均加入100 ng的3种内标物质(17β-E2-d3、EE2-d4和DES-d8),其中,17β-E2-d3 作为E1、E2和E3内标,EE2-d4作为EE2内标,DES-d8作为DES内标. 调水样pH为3,进行Oasis HLB柱(200 mg,6 mL,美国Waters公司)固相萃取净化. 依次用6 mL甲醇、6 mL水活化HLB固相萃取小柱. 上样速率为3~6 mLmin,上样结束后,依次用5 mL超纯水、5 mL 5%的甲醇水溶液淋洗小柱,减压抽干10 min,最后用10 mL甲醇分两次洗脱[20]. 洗脱液在40 ℃下氮吹至近干,用8 mLV(正己烷)∶V(二氯甲烷)为3∶1的溶液重新溶解,进行Florisil固相萃取柱(500 mg,6 mL,美国Waters公司)净化,用5 mL二氯甲烷和5 mLV(正己烷)∶V(二氯甲烷)为 3∶1 的溶液先后进行活化,样品过柱流速为1 mLmin,过柱完后,用6 mLV(甲醇)∶V(二氯甲烷)为1∶4的溶液进行洗脱,洗脱液氮吹至近干. 用1 mLV(甲醇)∶V(水)为7∶3的溶液重新溶解,过0.22 μm微孔滤膜到进样瓶中,进行SPE-HPLC-MSMS测定.
1.4 固体样品前处理方法
称取粪便、有机肥和土壤样品各5.0 g(干质量),分别加入100 ng内标物. 利用微波辅助萃取(MAE)方法提取固体样品中的雌激素. 微波萃取剂选取50 mLV(甲醇)∶V(丙酮)为1∶3的溶液,萃取温度为100 ℃,萃取功率为800 W,萃取时间梯度设置为温度爬升10 min,保持30 min,降温20 min. 萃取结束后,转移所有上清液于100 mL玻璃瓶中,转移至旋转蒸发仪(40 ℃,80 rmin,-75 kPa)中浓缩至10 mL,经氮吹仪吹至近干. 用5 mL乙腈重新溶解,然后加入5 mL正己烷进行液-液萃取(LLE)后,移除正己烷层,该操作重复两遍,以除去油类物质. 所得乙腈层溶液用超纯水稀释至500 mL,调节pH至3. 然后经Oasis HLB柱固相萃取净化,操作同1.3节液体样品处理方法.
1.5 HPLC-MSMS分析
采用AB 5500 Q-trap高效液相色谱串联质谱仪(美国AB公司),配岛津30A液相色谱,对5种目标雌激素进行检测. 其中,色谱柱选用Shim-Pack XR-ODSII C18(100 mm×2 mm,1.0 μm)型号,流动相为0.1%氨水和乙腈. 5种雌激素高效液相色谱-串联质谱分析条件见表2.
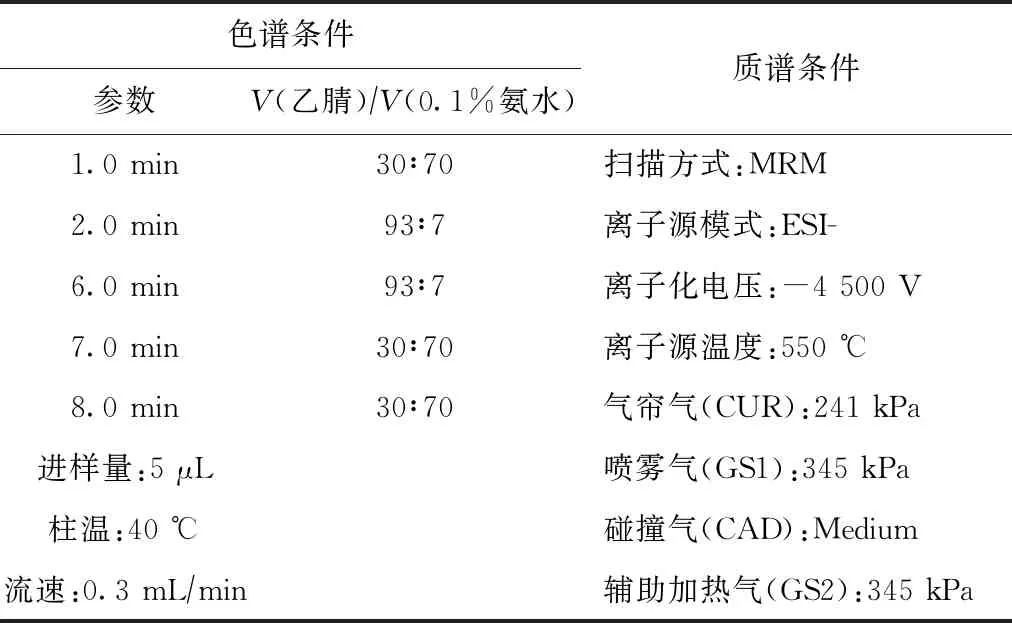
表2 高效液相色谱-串联质谱分析参数
1.6 质量保证和质量控制
用甲醇溶液配制5种雌激素的系列混合标准溶液,ρ(雌激素)为1.0~500 μgL,采用内标法定量,向进样瓶中分别加入100 ng的17β-E2-d3、EE2-d4和DES-d8内标液,在选定的色谱和质谱条件下进行测定,得到5种雌激素的线性相关系数(r2)均大于0.995,表明所建立的线性关系良好. 在该方法条件下获得各目标物的LOD(检测限)范围为0.17~1.57 μgL,LOQ(定量限)范围为0.57~5.25 μgL.
选择4种环境样品(粪便、有机肥、尿液、污水),设置100和500 ng两个加标水平进行加标回收率试验. 按1.3节和1.4节优化的前处理方法进行萃取、净化和浓缩,用1.5节建立的分析方法测定各目标物的含量,并计算回收率与相对标准偏差(见表3),得到粪便样品中目标物回收率范围为61.3%~91.2%,相对标准偏差小于7.1%;有机肥样品回收率为66.2%~106.3%,相对标准偏差小于6.9%;尿液样品回收率范围为65.4%~102.2%,相对标准偏差小于7.5%;污水样品回收率范围为64.8%~89.9%,相对标准偏差小于6.5%;表明所建立的方法对畜禽粪污环境样品中雌激素的检测分析具有良好的准确度和精密度.
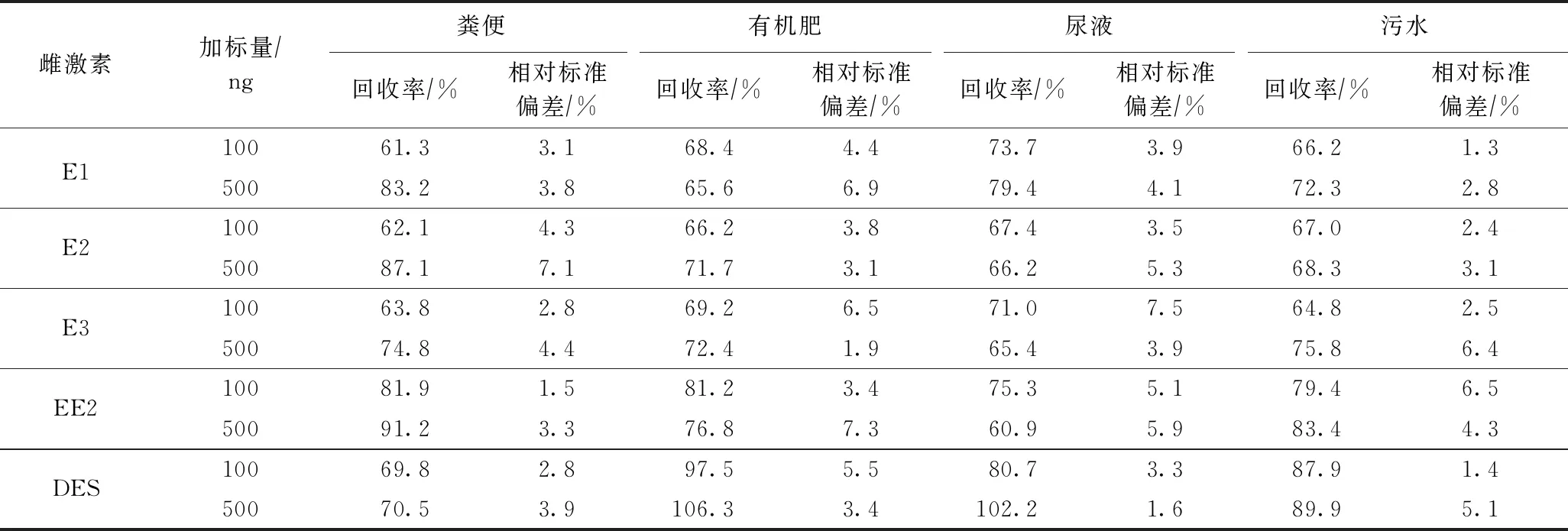
表3 不同环境样品中雌激素的回收率和相对标准偏差(n=3)
2 结果与讨论
2.1 畜禽排泄物中雌激素总体分布特征
2.1.1畜禽粪便和有机肥中各雌激素检测水平
分别对采集的18个粪便样品(含平行样,包括9个奶牛粪、6个猪粪和3个鸡粪样品)和18个有机肥样品(含平行样,包括3个奶牛场堆肥、6个奶牛场沼渣肥、6个猪场沼渣肥和3个鸡场堆肥样品)中5种雌激素含量进行了测定(见图1).
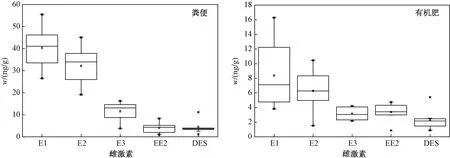
注: 箱式图中上下水平线分别代表最小值和最大值;×代表第1和99百分位数;箱子上下底和中间水平线分别代表第25、75和50百分位数;含量平均值用小方块()表示.
由图1可见,粪便样品中天然雌激素w(E1)、w(E2)和w(E3)范围分别为26.5~55.5、19.1~45.2和nd~16.3 ngg,检出率分别为100%、100%和50%;人工合成雌激素w(EE2)和w(DES)范围分别为nd~8.3和nd~11.2 ngg,检出率分别为83.3%和66.7%. ZHANG等[14]对上海市和浙江省13个畜禽养殖场进行了布点采样,测得粪便样品中w(E1)、w(E2)、w(E3)和w(EE2)的范围分别为nd~12.8、nd~101.0、nd~13.1和nd~10.4 ngg,表明两个地区雌激素检出情况相似,对比分析表明,上海市畜禽养殖业雌激素排放水平较稳定. 另外,该研究发现,E3仅在猪粪和鸡粪中被检出,奶牛粪便中未检出E3,这与奶牛主要分泌雌激素E1和E2、并不产生E3的研究报道[21]相一致,这进一步证明了环境中雌激素种类和畜禽养殖类型的相关性. 在畜禽排泄物中检出人工合成雌激素EE2和DES,分析原因可能是EE2和DES被作为动物饲料添加剂用于畜禽养殖业,最终会随畜禽排泄物进入环境中.
由图1可见,有机肥样品中w(E1)、w(E2)、w(E3)、w(EE2)和w(DES)范围分别为3.8~16.3、1.5~10.5、nd~4.2、nd~4.8和nd~5.4 ngg,检出率分别为100%、100%、50%、66.7%和33.3%. 与粪便样品相比,有机肥样品中雌激素总体含量明显降低,各雌激素检出范围缩小,且人工合成雌激素EE2和DES的检出率也有所降低. 综合分析表明,粪便经过有机肥处理过程后,其中的雌激素会发生降解,从而其含量下降,检出率降低.
2.1.2尿液和污水中各雌激素检测水平
分别对采集的15个尿液样品(含平行样,9个奶牛尿液样品和6个猪尿样品)和18个污水样品(含平行样,3个奶牛场污水进水、3个奶牛场污水出水、6个奶牛场厌氧发酵污水和6个猪场厌氧发酵污水样品)中5种雌激素含量进行测定,各雌激素检出情况如图2所示.
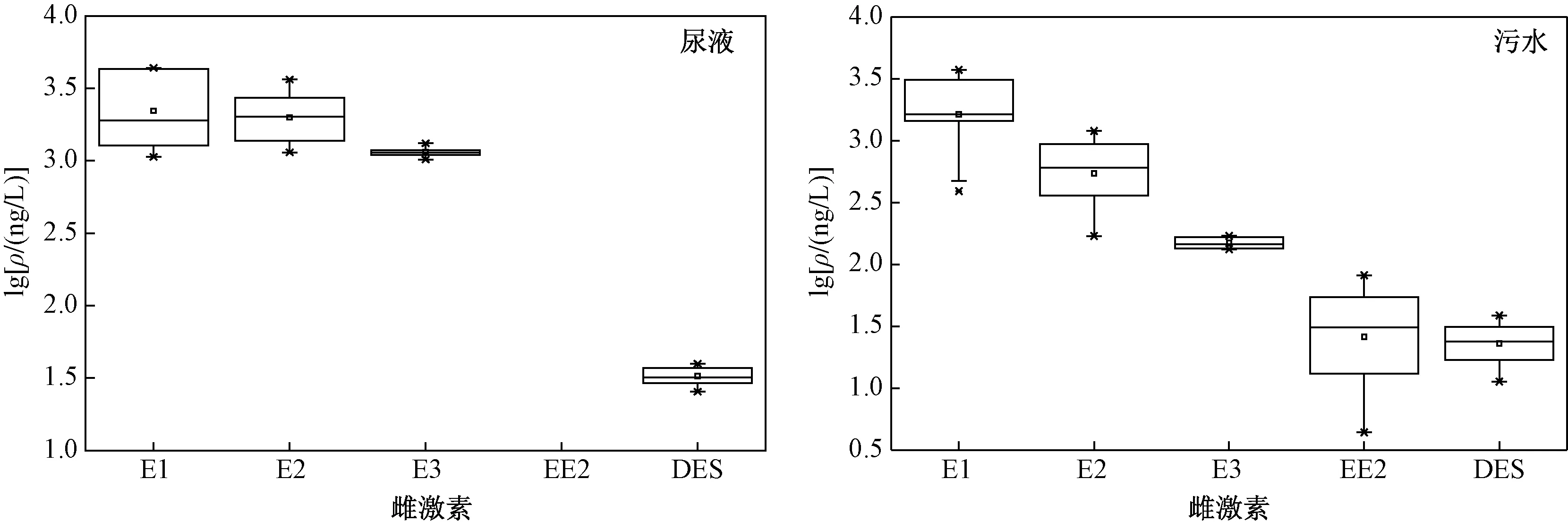
图2 尿液和污水样品中5种雌激素的含量范围Fig.2 The concentration ranges of five estrogens in animal urine and sewage samples
尿液样品天然雌激素ρ(E1)、ρ(E2)和ρ(E3)范围分别为 1 087.0~4 380.3、1 144.5~3 640.0 和nd~ 1 322.1 ngL;污水样品中分别为391.5~3 735.0、169.8~1 201.4 和nd~170.3 ngL,各雌激素的检出含量较高,检出范围较宽. Raman等[22]发现某猪场氧化塘中ρ(E1)和ρ(E2)分别为 5 900.4~14 000.6 和 1 800.5~3 300.2 ngL,然而ZHENG等[23]发现某畜禽场污水处理设施中雌激素物质总量低于5.0 ngL. 分析原因,可能与畜禽养殖类型和畜禽动物生长期、污水处理方式和处理程度的差异有关,导致天然雌激素的含量水平差异较大,检出范围较宽. E1、E2、E3和DES在尿液和污水样品中的检出率相近. EE2在尿液样品中未被检出,但在污水样品中检出率达到100%,ρ(EE2)范围为4.8~81.7 ngL. LIU等[24]发现,某养殖场经处理的污水中ρ(EE2)为124~285 ngL,而未经处理的污水中ρ(EE2)高达410 ngL;ZHANG等[14]测得某猪场氧化塘污水中ρ(EE2)为155 ngL. 然而,也有相关文献报道[25-26]EE2含量低于检测限. 因此,污水中EE2会因处理设施和处理程度的不同,而引起降解率出现较大差异.
2.2 典型畜禽场雌激素的排放状况
2.2.1典型猪场雌激素排放情况
对某规模化养猪场进行加密布点采样,共采集5种样品——粪便、沼渣肥、还田土壤、尿液以及沼液样品,这些样品中雌激素含量如表4所示,5种雌激素总量分布见图3.
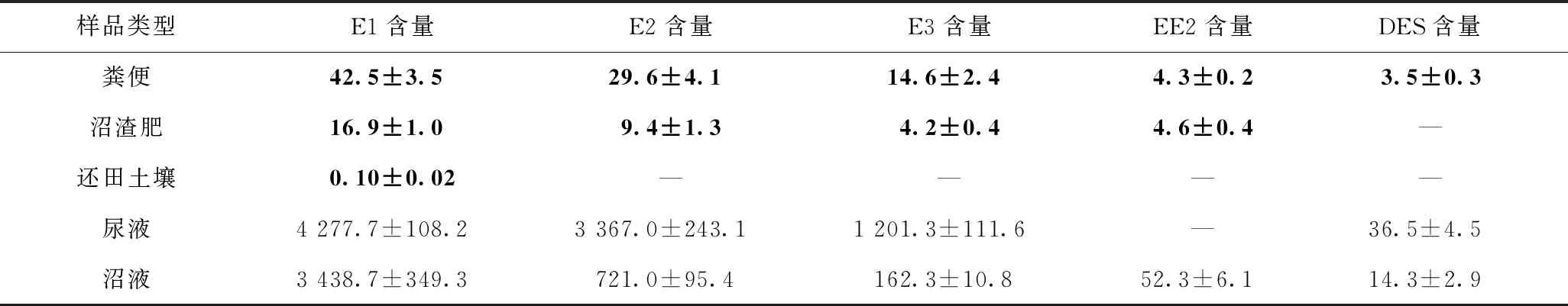
表4 典型猪场样品中5种雌激素含量(n=3)
注:—表示未检出. 加粗数值单位为ngg,非加粗数值单位为ngL.
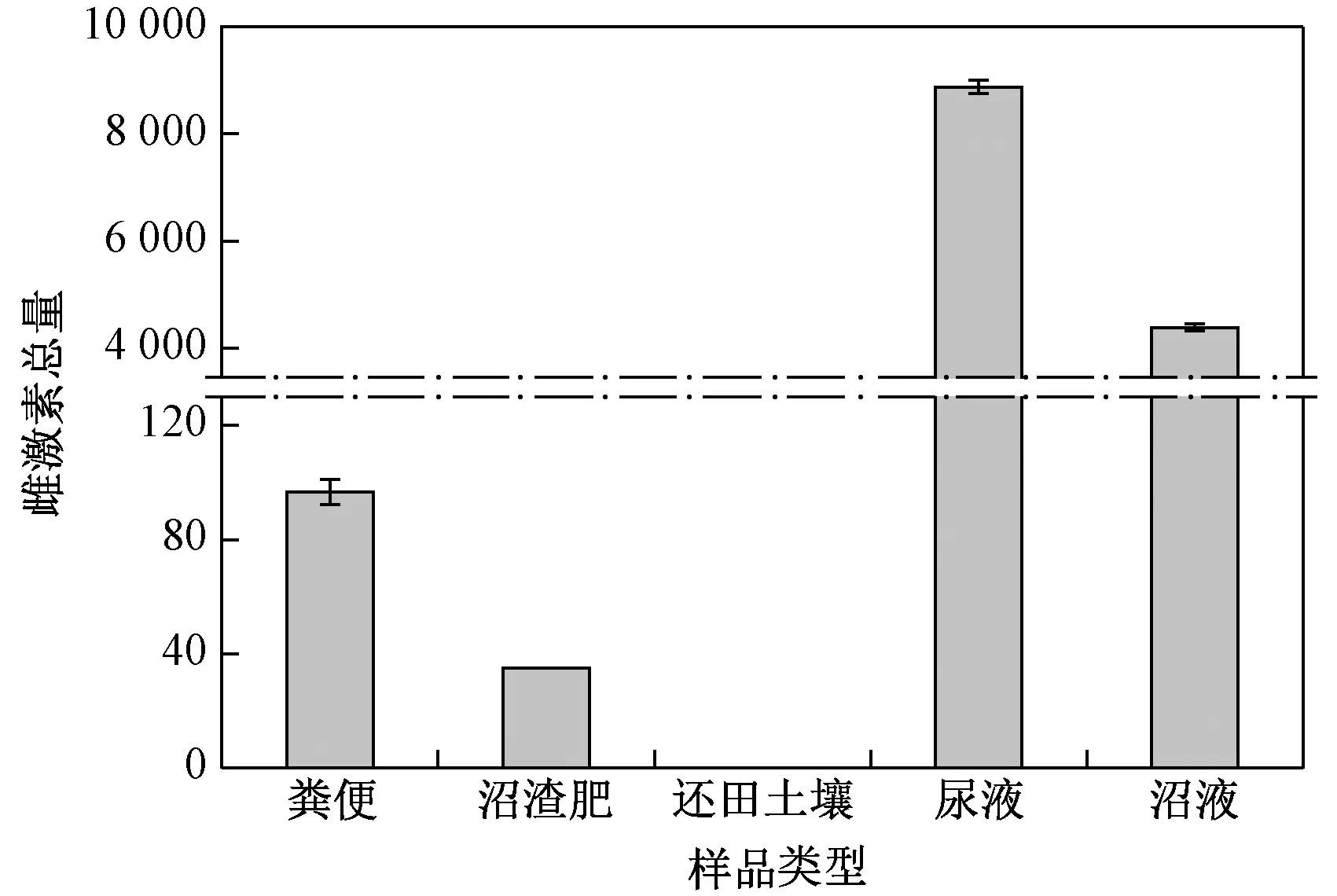
注: 粪便、沼渣肥、还田土壤样品中雌激素含量单位为ngg;尿液和沼液中雌激素含量单位为ngL.
天然雌激素E1在粪便和尿液样品中检出含量均为最高,分别占样品中雌激素总量的45%和48%,这与Johnson等[27-28]发现E1是猪排泄物中最主要的雌激素结果相符. 该养猪场粪污处理利用方式为沼气工程模式,主要通过厌氧发酵生产沼气,并产生沼液和沼渣肥. 由图3可见,猪场粪便和尿液中雌激素总量分别为94.5 ngg和 8 882.2 ngL,粪污经处理后产生的沼渣肥和沼液中雌激素总量分别为35.1 ngg和 4 388.6 ngL,还田土壤中雌激素总量为0.1 ngg,表明该养猪场厌氧发酵处理工艺对猪场污水中雌激素的去除效果一般,未被去除的雌激素会随粪肥还田进入农田土壤,给农田土壤环境带来雌激素污染风险,相关研究[14]发现,组合式气浮污水处理设施对畜禽排泄物中雌激素的去除率高达97%,其中对E1和E2的去除率达100%,而厌氧发酵处理对雌激素的去除率低于50%. 对比分析表明,污水处理设施的去除效率可能与粪污处理过程中的好氧-缺氧环境有关,好氧环境能够促进雌激素的吸附和降解[29],而缺氧(厌氧)状态下雌激素的降解受到抑制,EE2甚至不能得到降解[30-31]. 因此,为了加强对猪养殖过程雌激素排放的污染管控,可通过优化养殖场粪污处理利用方式,提高粪污中雌激素的去除效果,从而降低雌激素进入周边环境的风险.
2.2.2典型奶牛场雌激素排放情况
对某规模化奶牛场进行加密布点采样,共采集6种样品——粪便、尿液、堆肥、污水进水、污水出水(污水采用厌氧-好氧净化处理)和还田土壤样品,这些样品中5种雌激素含量如表5所示.

表5 典型奶牛场样品中5种雌激素含量(n=3)
注: —表示未检出. 加粗数值单位为ngg,非加粗数值单位为ngL.
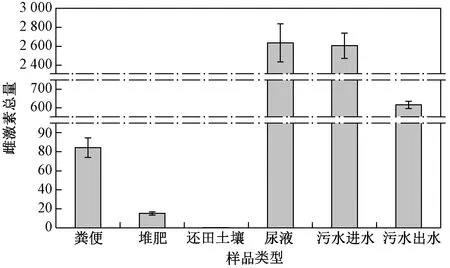
注: 粪便、堆肥、还田土壤样品中雌激素含量单位为ngg,尿液、污水进水和污水出水中雌激素含量单位为ngL.
在奶牛场粪便和尿液样品中E1和E2的含量均较高,分别占粪便样品中雌激素总量的61%和25%以及尿液样品中雌激素总量的41%和57%,表明E1和E2是奶牛排泄物中最主要的雌激素,这与Hanselman等[3-4]研究奶牛排泄物中雌激素的分布结果相一致. 研究报道[7,32]显示,E2具有很强的内分泌干扰活性,故应加强对奶牛养殖业粪污雌激素污染风险的管控. 由图4可见,奶牛粪便和尿液中雌激素总量分别为84.6 ngg和2 636.7 ngL,比猪粪和猪尿中低12%和70%,表明猪排泄物中雌激素含量高于奶牛排泄物. 粪便经高温好氧堆肥后,雌激素总量为16.2 ngg,下降了81%,其中E1和E2含量显著降低. ZHANG等[33]研究显示,堆肥处理对奶牛粪便中雌激素的去除率达55.8%;ZHENG等[23]研究发现,粪便经堆肥3个月后,雌激素的去除率高达80%. 对比分析表明,该奶牛场的好氧堆肥处理方式可有效去除固体粪便中的雌激素. 在还田土壤样品中,雌激素总量为0.1 ngg,只有DES以较低含量被检出,其他雌激素均未被检出. 由于土壤环境中存在各种吸附和降解作用[34],使得进入土壤中的雌激素含量降低. 污水经处理设施处理后,雌激素总量由 2 605.6 ngL降至615.7 ngL,E1、E2和EE2含量显著降低,去除率分别达72%、82%和84%,且在污水出水中DES含量低于检测限. 该奶牛场污水经场区内预处理达到纳管标准后接入污水处理厂污水收集管网,采用的污水处理方式为厌氧-好氧净化处理. 这表明该污水处理方式对天然和人工合成雌激素均具有较高的去除效果,可能是微生物厌氧与好氧降解以及污泥吸附等共同作用的结果[24].
2.2.3典型鸡场雌激素排放情况

图5 典型鸡场样品中5种雌激素含量Fig.5 The concentration distribution of five estrogens in the samples from the chicken farm
对某规模化养鸡场进行平均布点采样,共采集3种样品,包括粪便、堆肥和还田土壤样品,这些样品中雌激素含量如图5所示. 鸡场雌激素的排放特征与猪场和奶牛场有较大差异. 鸡主要排泄固体粪便,产生的尿液量很少,因此该研究未采集液体样品. 鸡粪样品中5种雌激素均被检出,总量达60.9 ngg,比猪粪和奶牛粪雌激素总量低36%和28%,表明鸡对环境中雌激素的贡献率远低于猪和奶牛. 堆肥样品中未检出EE2,其他4种雌激素总量为17.5 ngg,相较于粪便样品雌激素总量下降71%,表明雌激素在高温堆肥过程中得到了较好的降解. 5种雌激素在鸡粪还田土壤中均未被检出.
3 结论
a) 上海市典型猪场、奶牛场和鸡场排泄物中均含有一定数量的天然和人工合成雌激素,其中,猪场粪便和尿液中5种雌激素总量分别为94.5 ngg和 8 882.2 ngL,奶牛场粪便和尿液中总量分别为84.6 ngg和 2 636.7 ngL,鸡场粪便中总量为60.9 ngg.
b) E1为猪排泄物中最主要的雌激素,分别占粪便和尿液样品中雌激素总量的45%和48%,E1和E2为奶牛排泄物中最主要的雌激素,分别占粪便样品中总量的61%和25%,占尿液样品中总量的41%和57%,且通过粪便和尿液向环境中排放的5种雌激素总量表现为猪场>奶牛场>鸡场.
c) 厌氧发酵处理对猪场污水中雌激素具有一定的去除效果,经处理后沼液中雌激素总量降至 4 388.6 ngL,固体粪高温堆肥和污水厌氧-好氧净化处理对奶牛排泄物中雌激素具有较好的去除效果,粪便经堆肥处理后雌激素总量降至16.2 ngg,污水经处理后雌激素总量降至615.7 ngL.

