长链非编码RNA双特异性磷酸酶5假基因1对三阴性乳腺癌细胞生物学行为的作用
曹亚伟,桂百卉
据报道全世界每年约有450 000人死于乳腺癌[1],其中雌激素受体、孕激素受体及人表皮生长因子受体2均为阴性的乳腺癌称为三阴性乳腺癌(triple-negative breast cancer,TNBC),TNBC占乳腺癌的15%~20%,由于缺乏有效的靶向治疗手段而成为死亡率最高的乳腺癌类型[2-5],深入研究乳腺癌的发病机制对研制有效的治疗药物,提高癌症治疗效果意义重大。
长链非编码RNA(long non-coding RNA,lncRNA)是一类缺乏编码蛋白质功能、长度超过200个核苷酸的RNA,lncRNA在细胞增殖、分化、迁移和凋亡等生物学过程中起到了重要作用,随着近年来高通量测序的发展,越来越多的功能性lncRNAs成为肿瘤研究的热点[6],双特异性磷酸酶5假基因1(dual-specificity phosphatase 5 pseudogene 1,DUSP5P1)属于双特异性磷酸酶5(dual-specificity phosphatase 5,DUSP5)相关假基因,由1q42染色体编码[7],已有相关报道lncRNA DUSP5P1在急性髓性白血病细胞和霍奇金淋巴瘤细胞中异常高表达[7-8],并且与肿瘤的发生发展有关,然而,lncRNA DUSP5P1在TNBC的发病过程中所起的作用目前较少有研究报道。本研究在体外条件下探讨lncRNA DUSP5P1对TNBC细胞生物学行为的作用。
1 材料与方法
1.1 材料 正常人乳腺导管上皮细胞MCF-10A、TNBC细胞系MDA-MB-231、4T1、MDA-MB-468均购自上海中科院细胞库,Trizol、DMEM培养基、胎牛血清、胰蛋白酶均购自美国Gibco公司;Western Blot实验所用一抗、辣根过氧化物酶标记的二抗、转染试剂、polybrane均购自美国Sigma公司,慢病毒及转染序列设计由吉凯基因生物有限公司完成。
1.2 方法
1.2.1 慢病毒包装与感染 取混合包装质粒1.5 μg,shRNA慢病毒质粒0.5 μg,Opti-MEM培养基250 μL混合室温孵育5 min,取脂质体Lipofectamine 2000 5 μL溶于250 μL Opti-MEM培养基室温孵育5 min,将质粒和脂质体混合后接种于HEK293T细胞中,转染48~72 h后收集含有病毒的培养液,此病毒液可用于感染细胞株,感染24 h后,换上正常培养基加入合适浓度的嘌呤霉素筛选病毒稳定转染的阳性细胞,筛选3代以后,收集细胞使用实时荧光定量PCR(quantitative real time PCR,qRT-PCR)的方法检测敲减的效率。
1.2.2 细胞培养、慢病毒转染及分组 将TNBC细胞系MDA-MB-231、4T1、MDA-MB-468及正常人乳腺导管上皮细胞MCF-10A培养于含有2%双抗、5%FBS的DMEM培养基中,在37℃、5% CO2细胞培养箱培养。将MDA-MB-231细胞系分为对照组(negative control,NC)、sh-vector组和sh-DUSP5P1组共3组,分别代表不感染慢病毒、感染空载质粒慢病毒和感染sh-DUSP5P1-慢病毒(lentivirus,lenti)。
1.2.3 qRT-PCR检测 LncRNA DUSP5P1按照操作说明使用Trizol提取细胞总RNA,使用PrimeScript逆转录酶将2 μg模板RNA逆转录为cDNA。在罗氏qRT-PCR仪器中,以GAPDH为内参,量化lncRNA DUSP5P1表达水平。设计的引物如下:lncRNA DUSP5P1正向引物5′-GTGCTGAACTAGGGGAGCTG-3′,反向引物5′-AGATGGTGGGTGAACAGGAG-3′;GAPDH上游引物5′-TCGGAGTCAACGGATTTGGT-3′,下游引物5′-TTGGA GGGATCTCGCTCCT-3′,使用2-△△Ct方法计算lncRNA DUSP5P1的相对表达水平。
1.2.4 MTT细胞增殖实验 使用NC组、sh-vector组和sh-DUSP5P1组细胞以每孔2 000个细胞接种到96孔板,每孔体积200 μL,培养3~5 d后,每孔加入MTT溶液(5 mg/mL)20 μL,继续孵育4 h,小心吸弃孔内培养上清液,每孔加入DMSO 150 μL,振荡5 min使结晶物溶解,在比色仪上选择490 nm波长测定各孔光密度(optical density,OD)值,记录结果,以时间为横坐标,以吸光度为纵坐标绘制细胞生长曲线。
1.2.5 平板克隆形成实验 取对数生长期的NC组、sh-vector组和sh-DUSP5P1组细胞,消化成单个细胞悬液,每组细胞以每皿约200个细胞的密度均匀接种于含10 mL 5% FBS DMEM培养液的皿中,置于37 ℃ 5% CO2细胞培养箱中培养2~3周,当培养皿中出现肉眼可见的克隆时,终止培养,弃去上清液,PBS清洗后,使用4%多聚甲醛固定15 min,在显微镜(低倍镜)下计数大于20个细胞的克隆数。
1.2.6 Transwell实验 Transwell在24孔板中浸泡1 h;消化细胞,经血清培养基清洗2次,计数后配成细胞悬液,每孔加入100 μL细胞悬液;下腔室中加入10%FBS培养基在37 ℃ 5% CO2细胞培养箱中孵育24 h;取出Transwell用PBS清洗3遍,5%甲醛固定,PBS清洗2遍,加入0.2%结晶紫室温染色0.5 h,用棉球拭去表面细胞,显微镜下观察计数10个视野并照相,记录,每种实验重复5次。侵袭实验在此基础上取300 μL无血清培养基,加入30 μL Matrigel,混匀后加入上室各100 μL;放入37 ℃ 5% CO2细胞培养箱中孵育4~5 h以形成凝胶。
1.2.7 Western Blot实验 从单层贴壁细胞中提取总蛋白,每孔50 μg总蛋白上样,经电泳后转膜,5% FBS封闭1 h,分别加入E-cadherin、Vimentin、Snail、GAPDH抗体(1∶1 000),4 ℃孵育过夜,PBS漂洗,再加入辣根过氧化物酶标记二抗(1∶2 000),孵育2 h,加入增强化学发光液发光,凝胶成像系统进行显影,使用Image J灰度分析检测条带,目的蛋白和内参GAPDH灰度值比较作为蛋白的相对表达量,每种实验重复3次。
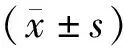
2 结果
2.1 TNBC细胞与正常乳腺上皮细胞lncRNA DUSP5P1表达水平比较 LncRNA DUSP5P1在TNBC细胞系MDA-MB-231、4T1、MDA-MB-468的相对表达水平分别为4.17±0.35,2.53±0.35,2.37±0.15,在正常人乳腺上皮细胞系MCF-10A中的相对表达水平为1.00±0.20。TNBC细胞系MDA-MB-231、4T1、MDA-MB-468中lncRNA DUSP5P1的表达水平均明显高于正常人乳腺上皮细胞系MCF-10A(F=65.10,P<0.05),图1。由于MDA-MB-231中lncRNA DUSP5P1表达相较于4T1和MDA-MB-468均高,并且其表型可同时用于增殖和迁移实验,因此我们选择MDA-MB-231用于慢病毒转染。

2.2 3组细胞增殖情况比较 由于siRNA-1#敲减效率最高,我们选择于siRNA-1#用于后续实验,3组细胞培养12、24、48、72 h时,分别测定各组细胞OD490值,与NC组和sh-vector组比较,sh-DUSP5P1组OD490值明显下降(分别F=33.62,90.72,41.17,77.94;均P<0.05)。3组细胞培养7 d后,与NC组和sh-vector组比较,sh-DUSP5P1组克隆形成数明显减少(F=575.1,P<0.05)。图2。
2.3 3组细胞侵袭和迁移情况比较 选取MDA-MB-231细胞用于细胞侵袭和迁移功能实验,在MDA-MB-231细胞中稳定敲减DUSP5P1,敲减DUSP5P1后MDA-MB-231侵袭和迁移能力明显下降(分别F=933.30,160.20;均P<0.05),图3。

A:敲减DUSP5P1效率比较;B:MTT实验OD490值比较;C:克隆形成数比较与NC组比较,*P<0.05,**P<0.01,***P<0.001

与NC组比较,***P<0.001
2.4 在MDA-MB-231细胞中敲减lncRNA DUSP5P1后对上皮间质转化标志物的影响 采用Western Blot方法,在TNBC细胞株MDA-MB-231敲减DUSP5P1后检测上皮间质转化标志物的变化。敲减lncRNA DUSP5P1的MDA-MB-231细胞株sh-DUSP5P1组间充质标志物Vimentin和Snail低于sh-vector组和NC组(分别F=100.11,227.37;均P<0.05),sh-DUSP5P1组上皮标志物E-cadherin高于sh-vector组和NC组(F=6.21,P<0.05),图4。

图4 在MDA-MB-231细胞中敲减lncRNA DUSP5P1后对上皮间质转化标志物的影响
3 讨论
TNBC恶性程度较高容易发生远处转移,由于缺乏激素及人表皮生长因子受体2受体表达,TNBC对包括激素、单抗靶向治疗在内的标准化临床治疗效果不佳,TNBC患者往往预后较差[9],因此,明确TNBC的发病机制对提高TNBC治疗效果显得尤为重要。
LncRNAs是近年来肿瘤研究的热点,近期有许多研究报道lncRNAs在TNBC中异常表达。Wang等[10]报道lncRNA RMST抑制TNBC细胞的增殖、迁移和侵袭,并且可以诱导细胞的凋亡。Zuo等[11]报道lncRNA MALAT1通过调控miR-129-5p促进TNBC细胞的增殖和迁移。Wu等[12]报道Linc00152通过DNA甲基化途径抑制乳腺癌1号基因从而促进TNBC细胞增殖及侵袭转移。
LncRNA DUSP5P1是一种新发现的lncRNA分子,Staege等[7]报道在包括霍奇金淋巴瘤、造血肿瘤细胞系、神经母细胞瘤细胞系和尤文肉瘤细胞系中发现lncRNA DUSP5P1异常高表达,其中DUSP5与DUSP5P1相互作用可以影响霍奇金淋巴瘤细胞细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路的激活。本研究检测了TNBC细胞与正常乳腺导管上皮细胞中DUSP5P1表达水平,发现TNBC细胞较之正常乳腺导管上皮细胞DUSP5P1表达水平均高,表明DUSP5P1可能参与了TNBC的发病,其异常高表达可能促使乳腺上皮细胞过度增殖或突变,进而发展成肿瘤。本研究对3组细胞系分别进行增殖、侵袭及迁移实验,发现sh-DUSP5P1组增殖、侵袭及迁移能力均明显低于对照组、sh-vector组,提示敲减lncRNA DUSP5P1后TNBC细胞系MDA-MB-231增殖、侵袭及迁移能力受到抑制,通常肿瘤细胞发生转移,首先要在原发灶部位侵袭基底膜,然后进入血管或淋巴结,进而发生远处转移,其中,肿瘤细胞的上皮间质转化在乳腺癌的研究中很受关注[13],在上皮间质转化过程中,上皮细胞失去极性却获得侵入型间充质细胞的特征,从而有利于细胞的侵袭[14],进一步对lncRNA DUSP5P1如何影响TNBC侵袭及迁移进行机制研究,发现敲减lncRNA DUSP5P1的MDA-MB-231细胞株sh-DUSP5P1组间充质标志物Vimentin和Snail低于sh-vector组,sh-DUSP5P1组上皮标志物E-cadherin高于sh-vector组,表明lncRNA DUSP5P1可能通过上皮间质转化过程促进TNBC细胞系MDA-MB-231细胞侵袭及转移,是否发生转移对TNBC患者的预后影响十分重要[15],这与之前Zhou等[8]报道DUSP5P1的异常高表达与急性髓性白血病患者不良预后有关类似。近期有研究报道8号染色体开放阅读框76通过结合DUSP5P1启动子区域激活ERK信号通路进而促进胃癌细胞的增殖、侵袭和转移[16],与之前Staege等[7]报道DUSP5P1在霍奇金淋巴瘤中激活ERK信号通路一致,许多研究报道癌基因通过激活ERK信号通路影响上皮间质转化过程促进肿瘤的侵袭和转移[17-20],因此,我们推测DUSP5P1可能也是通过激活ERK信号通路影响上皮间质转化过程促进TNBC的侵袭和转移,具体机制需要进一步实验验证。
综上所述,本研究结果显示lncRNA DUSP5P1在TNBC细胞中高表达,沉默DUSP5P1表达可抑制TNBC细胞系MDA-MB-231增殖、侵袭及迁移。进一步对侵袭和迁移进行机制研究发现,lncRNA DUSP5P1可能通过上皮间质转化过程促进TNBC细胞系MDA-MB-231细胞侵袭和迁移。LncRNA DUSP5P1有望成为TNBC治疗的新靶点,当然,本研究尚有一些不足,缺少体内动物实验的研究数据,涉及lncRNA DUSP5P1与ERK信号通路的分子机制也需要进一步研究。

