可变剪切事件在胰腺癌中的发生及其临床意义
帕成周,张贯启,邬善敏
可变剪切(alternative splicing,AS)又称选择性剪切,在mRAN前体到成熟mRNA的这一过程中,不同的剪切方式使得同一个基因可以产生多个不同的成熟mRNA,最终产生不同的蛋白质[1]。AS包含7种选择性剪切类型,即可变受体位点(AA)、可变供体位点(AD)、可变启动子(AP)、可变终止子(AT)、外显子跳跃(ES)、外显子互斥(ME)、内含子保留(RI)。
胰腺癌(pancreatic adenocarcinoma,PAAD)常见的首发症状为上腹部疼痛及不适,早期缺乏特异的临床表现,容易忽略,就诊率低。据中国国家癌症中心统计数据显示[2],2015年我国PAAD发病率位居恶性肿瘤第9位,死亡率位居恶性肿瘤第6位。PAAD现有治疗手段有限,目前尚未明确发现PAAD的发生发展机制及其相应靶基因的作用。近年来研究表明[3-4],AS事件常在癌症中发生,可用于肿瘤靶向治疗,且被认为与肿瘤发生发展密切相关。现分析AS事件在PAAD中的发生情况、临床生存率及调控网络,以便为临床评估及深入研究提供依据,报道如下。
1 资料与方法
1.1 数据集下载及筛选 自癌症基因组图谱(TCGA)(https://portal.gdc.cancer.gov/projects)下载并整理TCGA胰腺癌队列的RNA-seq数据、临床数据,获取PAAD病例的临床病理参数和预后资料,并提取剪接因子(splicing factor,SF)表达量。采用TCGA SpliceSeq工具(https://bioinformatics.mdanderson.org/TCGASpliceSeq/)进行拼接百分比值(percent-splice-in值,PSI值)数据下载及提取可变剪切事件数据,探索与PAAD相关的AS事件的变化。
1.2 生物信息学及统计学分析 利用UpSetR包定量分析PAAD中7种AS类型之间的交集;对172例总生存期至少90 d的PAAD患者,采用单因素Cox分析筛选出与生存显著相关的AS事件数据,定量分析PAAD中7种与生存相关的AS类型之间的交集,进行与生存相关AS事件的亚组分析。利用Lasson回归筛选后构建Cox模型,借助AS事件的PSI值及回归系数计算PAAD患者风险值并截取中位值,分为高、低风险2组。使用Survival包对纳入的80例具有完整临床资料的PAAD患者,采用Kaplan-Meier法进行生存分析,采用单因素Cox回归分析选择可能影响PAAD预后的因素,采用多因素Cox回归分析验证风险值与PAAD患者生存时间的相关性。采用Cytoscape(3.7.1版)构建PAAD生存相关AS事件与SF的调控网络。本研究所有资料均用R(3.5.2版)进行分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 PAAD中AS事件发生数目及与生存相关的AS事件发生数目 在PAAD样品中,发现1 805个基因只发生ES,1 125个基因只发生AT,757个基因只发生AP,最常见的AS事件前3位分别是ES、AT、AP,ME为最罕见的AS事件,见图1A。经单因素Cox分析选取与生存相关的AS事件,研究表明与生存相关发生AS事件前3位为ES、AP、AT,ME仍较少见。其中,938个基因只发生ES,597个基因只发生AP,592个基因只发生AT,见图1B。
2.2 PAAD中与生存相关的各型AS事件分析 在单因素Cox分析选取的数据基础上进行各类型AS事件的可视化分析,分别显示了7种类型中与生存相关最重要的20个AS事件,CD44基因中发生的ES事件与生存显著相关,UBA1、VRK3、SPAG7、ITGB1BP1、SPINT2、DNM2基因中分别对应发生的AP、AT、RI、AA、AD、ME事件与生存显著相关,并且大多数AP、RI事件是PAAD的危险因素,见图2。
2.3 PAAD中AS事件的临床生存分析 通过构建Cox模型,见表1,利用PSI值、回归系数计算PAAD患者风险值中位值为1.00,并将所有AS事件分为高、低风险2组,比较2组生存差异。通过Kaplan-Meier分析可发现高、低风险2组的生存差异具有统计学意义(χ2=42.10,P<0.01)。高风险组的中位生存期为1.3年,低风险组则为5.6年。值得注意的是,随访至第6年时,高风险组无存活患者,低风险组仍有2例存活,见图3A。ROC曲线的AUC为0.765,表明该模型构建比较准确,见图3B。单因素Cox回归分析表明风险值与患者总体生存率密切相关;多因素Cox回归分析则进一步提示高风险值是影响PAAD患者预后的独立危险因素(HR 1.050,95%CI1.03~1.07,P=0.000),见表2。
2.4 PAAD中生存相关AS事件与SF的调控网络 为了探索生存相关AS事件之间的功能关系(|cor|>0.8,P<0.01),使用Cytoscape生成基因相互作用网络显示,CELF3、CELF4、MSI1、NOVA1、CIRBP等剪接因子在调控网络与AS事件密切相关。ELAVL3对高风险的AS事件起负调控作用,PRPF39对低风险的AS事件起正调控作用,而CPSF6对低风险的AS事件起负调控作用。同时可以发现,RALYL存在对高风险AS事件负调控及低风险AS事件正调控的双重作用,见图4。

表1 基于AS事件的Cox模型参数
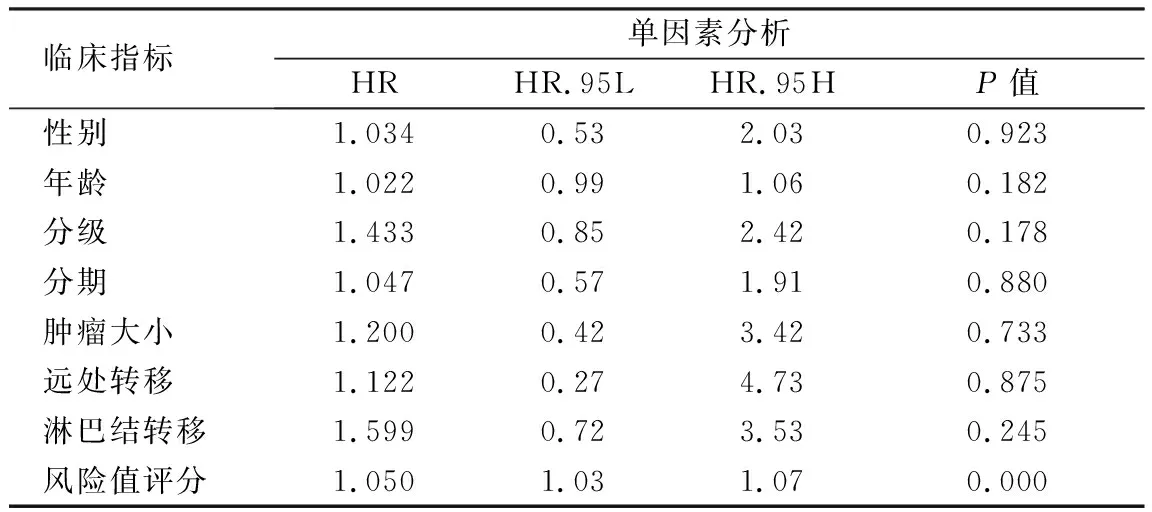
表2 单因素Cox回归分析PAAD临床特征、AS事件风险值和总体生存率的相关性
3 讨 论
剪切因子(SF)是参与RNA前体剪切过程的蛋白质因子,表达异常会导致基因的AS发生改变,增加了基因组表达mRNA的多样性,使其编码的蛋白质改变,进而改变表型。在肿瘤中,SF表达异常可能会引起特定促癌剪切异构体的形成,从而导致癌症的发生[3]。本研究中,基于AS事件的风险值计算,发现风险值可作为预后特征。SF和生存相关AS事件之间存在调控关系的研究,让人们对PAAD中SF在AS事件所处的调控中心有了更深入的认识。
在PAAD中与生存相关的AS事件发生情况的研究发现,位列首位为ES。同样,有研究发现在乳腺癌、前列腺癌中ES也是主要的AS事件[5-6],可能与RNA的保守性及存在顺式调控元件相关,目前尚未完全阐明。在亚组AS事件可视化分析中得到的部分基因在PAAD中的作用得到了实验验证。研究证实ESRP可以调节CD44 v8-10和v6-10外显子的剪接[7],且CD44的选择性剪接调控因子在正常或肿瘤细胞中的下调并不影响CD44的总mRNA水平[8]。在细胞水平及临床研究中发现[9-10],CD44阳性表达的胰腺癌细胞较CD44阴性亚群相比恶性程度更高,且与T分期、TNM分期、淋巴结转移、分化程度和肿瘤部位等相关。在肿瘤形成方面,CD44高表达的肿瘤组织在大小和质量上更占优势。肿瘤中的UBA1、VRK3、SPAG7、ITGB1BP1、SPINT2、DNM2等基因中的AS事件值得关注。
通过ROC曲线,分析了AS事件对PAAD预后的预测能力。结果表明,AS事件与PAAD患者的存活时间相关,高风险值可作为PAAD的不良预后因素。此外,本研究分析也强调了SF在AS事件中潜在的调节网络。有研究发现[11],通过删除MSI1/MSI2使得胰腺上皮内瘤变进展为腺癌的速度减慢,MSI1的缺失可引起小鼠MR下的肿瘤体积减少为原来的1/5倍。同样,有实验研究证实NOVA1与胰腺β细胞功能有关,如胞吐作用、转录、胰岛素受体信号传导、剪接和细胞凋亡[12]。但是,调控网络中凸显出的SF功能及作用机制还需要深入探索。调控网络还显示出明显的趋势,即大多数低风险AS事件与SF的表达呈正相关,而高风险AS事件与SF的表达呈负相关。尽管如此,一些特定SF表达的下调是否会导致低风险AS事件减少和高风险AS事件增加还需要进一步通过实验验证。
当前癌症治疗的主要难题是患者对治疗药物产生了耐药性,导致治疗失败。一项研究表明[13],剪接体突变改变了剪接位点和/或外显子的识别偏好,这种机制的变化可能会在癌细胞中产生突破点,利用剪接体突变的生化特性、基因组和生物学效应优化肿瘤治疗方法和手段。Siegfried等[14]研究发现胰腺导管腺癌细胞中丙酮酸激酶基因(PKM)的AS受到影响,导致促进与癌症相关的PKM2亚型表达升高,可增强胰腺肿瘤对吉西他滨的耐药性。此外,通过反义寡核苷酸切换PKM剪接,从而有利于PKM1的替代变体表达,增强氧化磷酸化,使胰腺肿瘤细胞对吉西他滨消除耐药性,进而成为改善胰腺导管腺癌对化疗反应的新潜在治疗靶点。
总之,本研究对PAAD中与生存相关的AS事件进行了概述,并建立了有价值的预后模型,可用于疾病预后预测。AS事件与SF之间的调控网络提出了SF如何潜在调节PAAD中AS事件的新见解。这些与生存相关的AS事件和SF为PAAD患者提供了许多新的治疗靶点,值得进一步深入研究。
利益冲突:所有作者声明无利益冲突
作者贡献声明
帕成周:查阅网络生物信息数据挖掘资源,完成大部分数据分析,论文撰写;张贯启:完成部分数据分析,论文指导;邬善敏:论文审核

