哺乳动物DNA聚合酶δ分离纯化研究进展
杨玉龙,周亚竟
(江苏大学 生命科学研究院,镇江 212013)
真核细胞中具有16种已知的DNA依赖性聚合酶,PrimPol是最新的DNA聚合酶成员,属于古真核生物酶家族,而其他15种聚合酶分属于A、B、X和Y 4个家族[1],其中,B家族的Pol α、Pol δ和Pol ε是负责染色体DNA复制的3种主要聚合酶,而其他家族的成员则主要参与DNA的损伤修复过程。
在众多的DNA聚合酶中,Pol δ是最保守的聚合酶,具有5′-3′聚合酶活性和独特的3′-5′核酸外切酶活性。Pol δ在染色体DNA复制过程中具有核心作用,当DNA复制启动时,在复制叉的滞后链上,首先由Pol α-引发酶重复合成小段RNA-DNA引物,随后复制因子C(Replication Factor C, RFC)取代Pol α-引发酶并紧密连接在引物3′末端,通过募集增殖细胞核抗原(Proliferating cell nuclear antigen, PCNA)和Pol δ形成RFC-PCNA-Pol δ复制复合物,从而启动新生的冈崎片段DNA合成[2]。而在前导链上,引物仅需合成一次,再由高度复制性复合物RFC-PCNA-Pol ε置换Pol α-引发酶并继续DNA的合成[2-3],但也有证据表明,Pol δ同时也参与了前导链DNA的合成[4]。除了维持基因组稳定性和避免遗传变异的作用外,Pol δ也参与了细胞中的诸多DNA修复途径,例如:Pol δ通过链置换合成的能力协同相关酶参与了错配修复途径,这种链置换修复主要是通过Pol δ的p68亚基介导而完成[5]。近期的研究发现,Pol δ在BER(Base excision repair, BER)中也扮演着重要角色,它通过亚基的调节而转变自身结构,从而在修复中发挥作用[6]。在跨损伤修复途径中,Pol δ能够通过某种聚合酶交换机制和其他的跨损伤聚合酶进行转换,来完成跨损伤合成[7]。此外,Pol δ还与肿瘤及其他疾病发生存在着密切联系,例如:Pol δ的变异导致的修复功能缺陷是许多自发性肿瘤和遗传性癌症综合征的主要特征之一[8-10],而未修复的DNA损伤积累则与早(衰)老症及老年性疾病相关。
哺乳动物Pol δ是由催化亚基p125和小亚基p50以及另外两个辅助亚基p68和p12组成的异源四聚体,与裂殖酵母(Schizosaccharomycespombe,S.pombe)Pol δ的4个亚基Pol3、Cdc1、Cdc27和Cdm1相对应。而在酿酒酵母(S.cerevisiae)中,Pol δ是由前3个单独编码的亚基组成的异源三聚体,即Pol3p、Pol31p和Pol32p,缺少第4个亚基的对应物。也有文章表明,从S.pomb分离的Pol δ可能含有第5个亚基[11],但是目前并未得到验证和广泛的认可。
迄今为止,对真核生物Pol δ的结构和功能研究主要是通过酵母Pol δ来进行,而对哺乳动物Pol δ的研究相对滞后,其主要原因之一是从哺乳动物中分离纯化Pol δ天然酶的过程极其复杂和困难。我们将详细介绍哺乳动物Pol δ的分离纯化历程及其多亚基复合体制备的研究进展。
1 天然DNA聚合酶Pol δ的分离纯化
1.1 硫酸铵盐析结合多次柱层析的分离纯化方法
DNA聚合酶δ最早由Byrnes等[12]于1976年从兔骨髓红细胞中分离纯化。Byrnes等通过注射苯肼诱导新西兰兔红细胞增生,将其骨髓细胞裂解上清经过硫酸铵分级沉淀以及磷酸纤维素柱、DEAE-Sephadex A-25柱、羟基磷灰石柱等三个柱层析纯化,以Poly[d(A-T)]为模板测定聚合酶活性,最终得到Pol δ。值得注意的是,DNA聚合酶和核酸外切酶活性组分在纯化过程中不能通过各种层析方法分离,即使在低离子和高离子强度下的蔗糖密度梯度沉降中共沉降,也未能被分离,这表明3′-5′核酸外切酶活性是Pol δ固有的特性。
1980年由Lee等[13]从小牛胸腺中也分离得到了Pol δ。Lee等将胎牛胸腺裂解上清同样通过硫酸铵分级沉淀结合多个层析柱,从1 kg胎牛胸腺中分离得到0.033 mg的Pol δ,其比活性为28 000 U/mg。随后,Lee等又通过改进的方法对小牛胸腺中Pol δ进行纯化(表1),该方法的关键步骤是在早期纯化过程中利用了苯基琼脂柱层析,去除了样品中大部分钙依赖性蛋白酶,最后酶的纯化倍数达到2280倍,比活性高达47 900 U/mg。通过凝胶电泳等实验,Lee等初步鉴定Pol δ是由一个125 ku催化亚基和一个48 ku亚基组成的异二聚体[14]。

表1 小牛胸腺Pol δ的分离纯化
1.2 免疫亲和柱层析和快速蛋白液相层析(FPLC)系统
1995年Jiang等[15]对上述传统的分离纯化方法进行了优化,其关键点在于利用了一个将抗p125单克隆抗体偶联到 AvidChrom 酰肼凝胶柱上制备而成的免疫亲和层析柱,再结合传统的层析柱,最终从750 g的小牛胸腺中获得了高达0.3 mg的 Pol δ(如表2所示)。该方法可以快速有效地分离由125 ku和50 ku亚基组成的Pol δ二聚体复合物,且得率比传统方法有很大的提升,但该制备方法的缺陷是多次洗脱过程容易导致酶的失活,且Pol δ纯化产物中通常含有许多多肽组分,纯度依然不理想。
早期对于Pol δ研究的主旨是严格分离酶组分,而这些分离过程存在一些问题,例如:获取的蛋白量少,利用众多纯化步骤增大蛋白水解的可能性。所以,过去一直认为Pol δ是由p125和p50两个亚基所构成,但随着蛋白分离技术的发展,科研人员在传统方法的基础上结合Jiang等的免疫亲和层析和FPLC快速层析系统相继分离纯化出Pol δ,并鉴定出另外两个亚基,进一步解析了Pol δ的亚基组成。
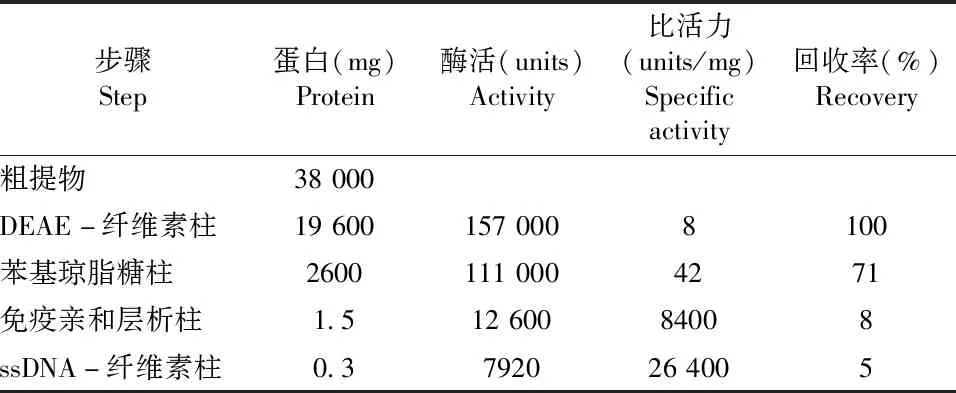
表2 小牛胸腺Pol δ的免疫亲和纯化
Mo等[16]研究了通过Jiang等[5]方法分离出的小牛胸腺Pol δ的性质,经过凝胶过滤测定和甘油梯度超速离心,发现Pol δ与一个大小为68~70 ku的多肽密切相关,该68 ku多肽与PCNA紧密捆绑,测序结果显示该蛋白对应于某未知蛋白KIAA0039序列,同源比对发现此蛋白与S.pomb和S.cerevisiae的第三亚基Cdc27、Pol32p具有显著的同源性,因此,提出该蛋白是Pol δ的第三亚基,命名为p68。几乎同时期,Hughes等[17]利用重组S.pombePCNA制备了PCNA亲和柱,用小鼠FM3A细胞的纯化组分进行亲和层析,发现亲和柱保留的Pol δ组分中含有新的66 ku蛋白,通过N-末端测序和同源性检索比对分析,也提出了该66 ku 蛋白是哺乳动物DNA聚合酶δ的第三亚基,命名为p66。
随着哺乳动物Pol δ分离纯化研究的深入,Liu等[18]设计了一种新的纯化方案,以求尽量保留Pol δ核心酶的相关蛋白。该方案使用了含Mono Q 、Mono S、Source Q15和Superdex 200 4个层析柱的FPLC快速纯化系统,具有柱容量大、回收率高且不易使生物大分子失活等特点,所得Pol δ产物活性可达8900 U/mg。考马斯染色分析显示,Pol δ产物的组分中有6个主要条带,即125 ku、50 ku、约25 ku的双条带和约12 ku的双条带,LC/MS/MS质谱分析表明,25 ku的双条带均被鉴定为KIAA0039的蛋白水解产物,即p68的水解产物,而12 ku序列与EST AA402118的开放阅读框相匹配,通过tBlastn检索,发现其为酵母Pol δ Cdm1亚基的人同源物,因此,p12被鉴定为哺乳动物Pol δ的第四亚基。至此,哺乳动物Pol δ的4个亚基全部被鉴定,为将来深入分析哺乳动物Pol δ各亚基的功能奠定了基础。
虽然利用FPLC快速层析系统提高了Pol δ的纯化效率,但其过程仍费时费力,而且利用众多的层析柱其成本偏高,产量较低,难以开展大规模制备,因此,开发更高效经济的方法制备高纯度Pol δ成为当前急需解决的迫切任务。
2 利用重组杆状病毒共感染昆虫细胞制备四亚基DNA聚合酶Pol δ
成功分离天然的四亚基Pol δ复合物面对诸多挑战,虽然已在酵母中分离出天然Pol δ多亚基复合物,但这在哺乳动物组织中非常困难[14-15, 17],而且在纯化过程中,p68亚基容易暴露蛋白水解位点,进而被降解[16, 18]。此外,通过常规方法从人源细胞或胎牛胸腺中纯化天然的Pol δ,通常仅产生含有p125和p50蛋白双亚基的制备产物,难以获得全酶。这些问题都严重阻碍了对Pol δ的结构和功能的深入研究。
昆虫杆状病毒表达系统是一种以杆状病毒为外源基因的载体,在昆虫细胞或幼虫体内表达外源蛋白的真核表达系统,杆状病毒表达系统具有与哺乳动物细胞相似的翻译和翻译后修饰功能,还能表达多蛋白复合物,而且成本低廉、安全性好[19-20]。为了获取Pol δ全酶,Xie等[21]通过杆状病毒表达系统构建了编码p125、p50、p68和p12亚基的4个重组杆状病毒,将重组杆状病毒共感染Sf-9昆虫悬浮细胞并检测蛋白表达,再利用Source15Q、Mono Q HR 5/5和Superdex 200等多个层析柱的FPLC纯化系统,从昆虫细胞裂解物中分离纯化出几乎均一的Pol δ异源四聚体。对纯化的Pol δ的理化性质与高纯度的天然小牛胸腺Pol δ进行对比,发现重组聚合酶在功能上与天然Pol δ几乎是一致的。类似的,Podust等[22]和Mertz等[8]利用重组杆状病毒表达系统也构建了含Pol δ 4个亚基的重组病毒,但他们所构建的重组杆状病毒带有His标签,通过Ni-柱并结合多个层析柱进行分离纯化,也获得了高纯度Pol δ四亚基复合物。
虽然利用该方法能够快速获取四亚基Pol δ复合物,但是仍有缺陷,因为是多病毒的共感染,所以各亚基的转录表达水平不均一,纯度不理想,得到的不仅有Pol δ4-四亚基酶复合物,也有缺少p12亚基的三亚基蛋白复合物,由于过去对p12亚基的功能尚未明确,认为其对Pol δ功能研究无影响,但后来的研究证明p12对于Pol δ结构和功能是必需的[23];此外,Podust等构建重组病毒时所用的标签可能会改变标记蛋白质的特性和功能[24],这些不足之处仍有待解决。
3 利用新型 Multi Bac 系统制备DNA聚合酶Pol δ全酶
新型 Multi Bac 系统的应用为DNA聚合酶δ的制备及分离纯化带来了新希望[25]。这是一种基于模块化杆状病毒的系统,专为真核多亚基蛋白表达而设计,使用含有可以嵌套的增殖模块的转移载体,便于组装多顺反子表达盒[26]。该杆状病毒系统因为已经消除了特定的病毒基因,具有改善的蛋白质表达特征,能够使感染的昆虫细胞中外源蛋白的表达量成倍提高,同时也解决了多病毒共感染所导致蛋白表达不均一的问题。
本实验室Zhou等[27]利用该Multi Bac 系统结合家蚕生物反应器,成功大规模制备了Pol δ的多亚基蛋白复合物,通过该家蚕-杆状病毒表达系统表达的重组蛋白具有很高的生物活性,且构象也接近于天然的哺乳类蛋白。Zhou等通过图1所示方案,首先将编码Pol δ四亚基全长序列的4个cDNA片段,利用Multi Bac 系统构建重组转移载体pFBDM-[p125-p50-p68-p12];然后,将重组质粒转化到大肠杆菌BmDH10Bac感受态细胞中,获得重组BmNPV杆粒DNA;随后,通过蓝/白斑筛选,选定白色表型大肠杆菌分离出杆粒DNA,用于转染家蚕BmN细胞以制备四亚基重组杆状病毒;最后将病毒悬液注入五龄家蚕体内,并监测蛋白表达水平。收集幼虫的血淋巴,进行免疫亲和层析和FPLC Mono Q离子交换层析快速分离重组Pol δ,最终,从350头家蚕血清中分离纯化到4 mg的Pol δ,比活性高达25 000 U/mg。此外,Zhou等还利用同样的方法从300 mL被感染的Sf-9昆虫细胞中获得了3~4 mg的Pol δ四亚基复合物[28]。

图1 重组病毒的产生及其在家蚕幼虫中的表达的示意图[27]
为了确定与天然Pol δ是否具有功能一致性,Zhou等[28]严格鉴定和比较了所得酶的活性和同质性,结果显示重构酶具有和天然来源 Pol δ相同的功能。此后,Liu等[29]和Wang等[30]也利用了此法制备的Pol δ复合物进行相关实验,相继获得了良好的实验结果,进一步验证了该方法的可行性。后来,Sari[31]和Pelosse等[32]还对该表达系统进行了进一步的优化和改善[31-32]。该方法是一种极具潜力的多蛋白复合物表达及制备方法,具有简单、快速且可靠的优点,已经在生物、医药等诸多领域得以广泛利用[31]。因此,可以利用该方法快速地制备高活性、高纯度四亚基Pol δ复合物,极大地方便了今后对Pol δ详细结构以及其在生物体内确切功能的研究。
4 小结与展望
哺乳动物Pol δ作为细胞内多种生物过程中起重要作用的聚合酶,自1976年被发现以来,其结构和功能得到了广泛深入的研究。从早期分离得到由p125和p50组成的Pol δ异源二聚体,到相继发现其第三和第四亚基,这些发现都有赖于蛋白质分离纯化技术的发展。尽管如此,从天然来源分离高纯度、高活性的Pol δ仍然面临着诸多挑战,从而阻碍了对Pol δ结构与功能的深入研究。尽管有研究报道了S.cerevisiaePol δ的亚基Pol3p以及哺乳动物Pol δ p50与p68亚基复合体的晶体三维结构及其详细功能分析[33-34],然而,哺乳动物Pol δ全酶的晶体结构仍未见报道。近年来随着冷冻电镜三维重构技术的成熟,为Pol δ三维结构的获得带来了希望,冷冻电镜技术能够在不需要样品结晶,保持样品的近生理状态下解析生物大分子复合体的高分辨率三维结构。如今,高纯度Pol δ的制备为解析Pol δ全酶晶体结构奠定了基础,也为从原子水平研究Pol δ及各亚基在DNA复制和各种修复途径中的作用提供了可能。鉴于Pol δ在DNA复制、修复和肿瘤发生中的重要作用,Pol δ可能成为某些小分子复制抑制剂的靶标,而对于Pol δ全酶详细功能的研究,阐明其在癌症、老年性疾病和其他疾病中的作用机制,能够为将来设计全新有效的肿瘤诊断和治疗方法提供理论依据。

