小分子靶向抑制剂及生物制剂在儿童特应性皮炎的应用前景
吴承龙综述 余 红审校
上海交通大学医学院附属新华医院皮肤科(上海 200092)
特应性皮炎(atopic dermatitis,AD)为一种常见的慢性反复瘙痒性炎症性皮肤疾病,全球范围内儿童与成人发病率分别为20%和3%,且呈逐年上升趋势[1]。AD的临床表现为皮肤湿疹样损害伴随剧烈瘙痒感,严重影响患儿生活质量,且常伴发哮喘、过敏性鼻炎等多种过敏性疾病[2]。AD发病机制复杂,至今仍未完全阐明,可能是基因易感性、皮肤屏障缺陷、免疫紊乱、微生物感染、环境、饮食、精神等多方面因素共同作用的结果[3]。儿童AD的严重程度往往大于成人,呈现发作-缓解-再发的过程,且治疗药物选择较为局限,药物治疗面临巨大的挑战。随着对AD发病机制研究的逐步深入,除常规的外用润肤剂、钙调磷酸酶抑制剂、糖皮质激素,口服抗组胺药物、照光疗法及免疫抑制剂治疗外,近期针对特定炎症因子的小分子靶向抑制剂如磷酸二酯酶IV抑制剂、非受体酪氨酸激酶—信号转导和转录激活因子(JAKSTAT)抑制剂、芳香烃受体调节剂及生物制剂也逐渐应用于临床。本文就儿童AD药物治疗的进展进行综述。
1 传统治疗
AD的临床表现复杂,患者之间的病情差异大,常需采取个体化治疗方案。外用药物如润肤剂、钙调磷酸酶抑制剂、糖皮质激素等适用于轻症AD;对于皮疹泛发、瘙痒明显的中、重度AD患者,则需在外用药物治疗的基础上联合系统治疗药物如抗组胺药、免疫抑制剂等控制疾病的发展。
1.1 糖皮质激素
目前除保湿、润肤剂以外,外用糖皮质激素为儿童AD 治疗的首选药物,在AD 急性期可有效抑制炎症反应,迅速缓解皮肤炎症并起到止痒作用。但药物在局部应用的同时也伴随系统吸收,且婴幼儿皮肤对糖皮质激素的敏感性和吸收能力都高于成人,长期大量使用后可出现局部皮肤萎缩、毛细血管扩张、色素沉着、多毛甚至肾上腺皮质功能抑制、代谢紊乱、影响生长发育等诸多不良反应[4]。
1.2 钙调磷酸酶抑制剂
钙调磷酸酶抑制剂如他克莫司、吡美莫司作为儿童AD 的二线治疗药物,主要用于外用糖皮质激素效果不佳、无法耐受或皮损部位薄嫩的AD 患儿。用药部位局部刺激、烧灼感在临床中最为常见。虽然钙调磷酸酶抑制剂的安全性良好,但美国食品药品监督管理局(Food And Drug Administration,FDA)发出黑盒警告指出,长期外用钙调磷酸酶抑制剂可能致罹患淋巴瘤及皮肤癌症的风险增加[5]。
1.3 系统治疗药物
抗组胺药物如西替利嗪、氯雷他定等临床上常用于泛发性AD的系统性治疗,偶见中枢神经系统抑制、肝肾功能异常等不良反应,2 岁以下儿童尚缺少药物安全性的临床试验数据[6];环孢素和硫唑嘌呤等免疫抑制剂一般不作为儿童AD 的常规治疗,但在严重影响生活质量、传统治疗效果不佳的重度难治性AD 患儿可考虑使用,治疗过程中需密切注意骨髓抑制、肝肾毒性、生殖毒性等不良事件的发生[7]。
2 小分子靶向抑制剂
2.1 磷酸二酯酶IV抑制剂
磷酸二酯酶IV(phosphodiesterase-4,PDE-4)为炎症发生过程中细胞因子产生的关键调节点,其通过降解细胞内cAMP引发下游信号转导而促进炎症性细胞因子(IL-4、IL-13、IL-22等)及趋化因子合成,并减少抗炎因子(IL-10)的产生,在AD 患者中可观察到淋巴细胞中PDE-4表达增加[8]。通过阻断PDE-4可减少炎症介质的表达,降低皮肤炎症反应并促进AD 临床改善。目前应用于儿童AD的PDE-4抑制剂为外用剂型(crisaborole、RVT-501、OPA-15406),口服制剂apremilast目前仅限于在成人研究中,儿童尚未见研究报道。见表1。
2.1.1 Crisaborole 局部外用PDE-4 抑制剂,FDA于2016 年12 月14 日批准2% crisaborole 上市,用于治疗2岁及以上轻中度AD患儿。目前2% crisaborole软膏已完成多项Ib 期、II 期、III 期的药物临床试验和扩展研究,共录入1 689 例儿童和成人受试者来评估药物的药代动力学、疗效及不良反应[9-15]。在一项Ib 期药物临床安全性开放试验中,34 例年龄2~17岁、轻中度AD 患者外用2% crisaborole,每日2 次,经28 天治疗后,研究者整体评价(Investigator Static Global Assessment,ISGA)由2.65 下降至1.15,平均可治疗皮损面积由 48.7%下降至13.2%,治疗成功率达47.1%[14]。2016 年进行的2 项设计方法相同的随机双盲空白对照III 期药物临床试验,分别收录759 例及763 例2 岁及以上的轻、中度AD 患儿,外用2% crisaborole 每日2 次,与赋形剂比较疗效,治疗组患儿治疗成功率较对照组高(32.8%:25.4%,31.4%:18.0%),且达到治愈/几乎治愈的比例更高(51.7%:40.6%,48.5%:29.7%)[15]。各临床研究中不良反应多为用药部位局部疼痛、烧灼感或针刺感,出现的不良事件均为轻至中度,多数与治疗无关,且治疗组与对照组间不良反应发生率相似[10-15]。由此可见,crisaborole软膏可以改善AD患者整体疾病严重程度,且安全性良好。
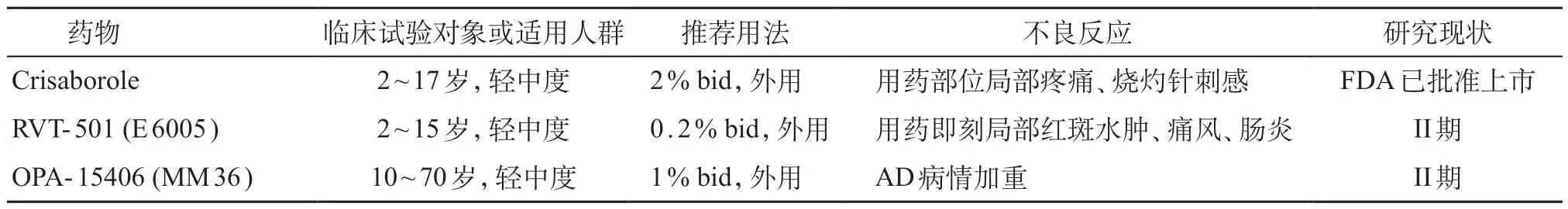
表1 PDE-4抑制剂
2.1.2 RVT-501(E 6005)局部外用PDE-4 抑制剂,目前有多项面向2~15 岁AD 儿童及成人的相关临床研究正在进行。2016 年一项随机多中心临床对照试验纳入62 例轻中度AD 患儿,分别外用0.05%、0.2% RVT-501软膏及赋形剂,每日2次,持续使用2周并评估临床疗效,结果显示,0.2%治疗组的治疗成功率高于对照组(34.4%:20.0%),瘙痒评分改善明显(-37.5%:-6.7%),目标皮损严重程度评分有较大改善(-45.94%:-32.26%),但差异无统计学意义;而0.05%治疗组与对照组无明显差异。RVT-501软膏治疗儿童AD 具有安全性及有效性,药物耐受性良好,在研究中无皮肤不良事件发生[16]。常见的不良反应包括用药即刻局部红斑、水肿,痛风及肠炎[17-19],目前未见严重不良事件报道。近期对0.5% RVT-501在儿童及成人的II 期临床试验已完成(NCT 03394677、NCT02950922),但结果尚未公布。
2.1.3 OPA-15406(MM36)局部外用新型PDE-4抑制剂,对PDE-4B具有高度选择性且对PDE-2也有抑制作用。2016年一项有关药物浓度选择的II期双盲安慰剂对照试验,入组121例年龄10~70岁之间的轻到中度AD患者,外用0.3%、1% OPA-15406 及赋形剂,每日2 次并维持治疗8 周,结果显示,治疗4 周后1%治疗组治疗成功率高于对照组(20.9%:2.7%)、湿疹面积及严重程度指数(EASI)也出现明显改善(39%:3%),而瘙痒视觉模拟评分(visual analog scale,VAS)从中度(63.7±20.3)mm 改善为轻度(40.5±27.1)mm;0.3%治疗组在治疗后的EASI、VAS 评分也有改善,但较1%治疗组疗效差。在研究中常见不良反应为AD病情加重,不良事件发生率低,且大多数事件程度较轻微[20]。故OPA-15406 软膏可为轻中度AD患者提供一种有效的治疗方式。
2.1.4 Apremilast 口服PDE-4 抑制剂,美国FDA批准用于治疗成人银屑病及银屑病性关节炎,目前在AD 相关的临床研究中以成人为主,尚缺少治疗儿童AD 的临床资料。2016 年报道1 例AD 患儿使用apremilast治疗成功的案例,为8岁重度AD患儿,皮损累及全身,血清IgE(11 769 IU/mL)及嗜酸性细胞百分比(8.1%)水平升高,有高危特应性家族史,曾予糖皮质激素、他克莫司外用,泼尼松20 mg每日1次口服,omalizumab 300 mg皮下注射等治疗后皮损改善但效果欠佳,且仍伴有强烈瘙痒。在给予apremilast 30 mg每日2 次口服治疗,2 周内患儿瘙痒和皮肤炎症迅速缓解且未出现明显不良反应[21]。Apremilast安全性良好,常见不良反应为头痛、腹泻、恶心及上呼吸道感染,目前尚无证据表明口服apremilast会导致终末器官损害[22]。虽然此病例在治疗上获得成功,但还需要更多临床数据来确定其用于儿童AD治疗的有效性及安全性。
2.2 JAK-STAT抑制剂
JAK-STAT 信号通路由4 种JAK 蛋白(JAK 1、JAK 2、JAK 3、TYK 2)和7 种信号转导与转录激活因子(STAT 1、STAT 2、STAT 3、STAT 4、STAT 5 a、STAT5b、STAT6)组成,配体与细胞膜上的受体结合激活并启动细胞基因转录,介导炎症细胞因子(IL-4、IL-5、IL-13、IL-31等)和抗胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)调节免疫系统,在炎症反应中起重要作用[23]。关于儿童AD的治疗方面,目前已有包括外用制剂(ruxolitinib、delgocitinib)及口服制剂(upadacitinib、tapinarof)等多种JAK-STAT抑制剂正进行药物临床试验。见表2。
2.2.1 Ruxolitinib 外用JAK 1/JAK 2 抑制剂。在成人AD 的IIb 期药物临床研究中(NCT 03011892),1.5% ruxolitinib每日2次外用组的EASI评分及瘙痒改善程度与0.1%曲安奈德相当,且明显优于赋形剂组,常见不良反应为鼻咽炎、头痛、恶心、中性粒细胞减少和腹泻等。在儿童AD 的相关研究中,一项纳入2~17岁儿童的I期临床研究(NCT03257644)和面向青年及成人AD 的药物最大用量I 期开放性临床试验(NCT 03920852)正在开展,两项针对12 岁及以上AD 患者的III 期临床研究在招募中(NCT 03745638、NCT03745651)。
2.2.2 Delgocitinib(JTE-052)外用JAK/TYK 2抑制剂。在一项纳入年龄介于16~64 岁AD 患者的II 期临床试验中(JAPICCTI-152887),不同浓度的delgocitinib(0.25%、0.5%、1%、3%)与赋形剂组相比,EASI 评分皆达到改善,差异有统计学意义,且经治疗后瘙痒可迅速缓解[24]。成人药物安全性试验中所报道的不良反应包括鼻咽炎、淋巴细胞减少和丹毒等[25]。目前针对2~15 岁儿童的II 期研究已完成但尚未报道(JAPI-CCTI-173553)。另外两项儿童和成人的II/III 期临床试验在进行中(NCT 03725722、JAPICCTI-184064)。
2.2.3 Upadacitinib(ABT-494)口服JAK 1 抑制剂。目前正在2~17 岁AD 患儿及成人患者中进行临床研究。一项成人的IIb期临床试验(NCT02925117)显示,upadacitinib 30 mg 组相比赋形剂组在EASI评分和瘙痒情况上有明显改善,差异有统计学意义,主要不良反应为上呼吸道感染。针对2~12 岁重度AD 患儿的I 期多中心临床药物安全性试验正在进行(NCT 03646604);另外有多项中、重度AD 的青年及成人患者的III 期药物临床试验在招募受试者(NCT 03569293、NCT 03568318、NCT 03607422、NCT03661138)。
2.2.4 PF-04965842 口服JAK1抑制剂。2018年2月FDA对PF-04965842的疗效给予肯定。在一项纳入 269例18~75岁中、重度成人AD患者的IIb期随机多中心双盲对照试验(NCT02780167)中,口服10 mg、30 mg、100 mg、200 mg及安慰剂,每日1次,共12周,结果显示,100 mg和200 mg剂量组的治疗成功率相比对照组,差异有统计学意义;药物安全性试验所报道的不良反应轻微,上呼吸道感染及AD 病情加重较常见[26]。目前数个面向12 岁及以上儿童或青年AD 患者的III 期临床试验正在进行(NCT 03575871、NCT 03349060、NCT03422822、NCT03627767、NCT03796676)。

表2 JAK-STAT抑制剂
2.3 芳香烃受体调节剂
芳香烃受体(aryl hydrocarbon receptor,AhR)与皮肤屏障的维持有关,其通过控制细胞因子的表达,调控T细胞、Th17和Th1/Th2的分化来调节机体的固有免疫及适应性免疫应答[27]。
Tapinarof(GSK 2894512)为外用AhR 调节剂(therapeutic AhR modulating agent,TAMA),其通过与多种细胞的AhR 结合,降低炎症细胞因子表达,并调节角质形成细胞中与皮肤屏障相关基因的表达。一项多中心随机双盲安慰剂对照试验,入组247 例12~65岁AD患者,外用0.5%、1% tapinarof与安慰剂,每日1、2次,持续12周,结果表明1% tapinarof每日2次组的治疗成功率明显高于对照组(53%:24%),且疗效持续到观察结束后4周;药物安全性方面,tapinarof组不良反应较对照组发生率高(56%:41%),程度为轻到中度,常见的不良反应为头痛、毛囊炎和上呼吸道感染[28]。
3 生物制剂
3.1 Dupilumab
Dupilumab为完全人源化单克隆抗体,通过与IL-4R、IL-13R共有的IL-4Rα亚单位结合,抑制IL-4、IL-13 信号转导,减轻Th 2 细胞的免疫应答,继而减少嗜酸性粒细胞、单核细胞等炎症细胞聚集[29],目前已获得FDA 及欧洲药品管理局批准用于成人中重度AD 的治疗。IL-4、IL-13 是参与AD 发病过程的核心细胞因子,研究发现患者血清中IL-4、IL-13 水平与AD 严重程度呈正相关,因而靶向IL-4、IL-13 对于抑制AD的发生发展具有重要意义。一项评估药代动力学、药物安全性和疗效性的IIa 期多中心开放试验(NCT 02407756),入组38 例6~11 岁儿童和40 例12~17岁青少年,均为局部外用糖皮质激素治疗效果不佳的中重度AD 患儿。两组受试者在试验开始前8周按原方案治疗,第9周起分别给予2 mg/kg(低剂量组)或4 mg/kg(高剂量组)dupilumab皮下注射,每周1次持续4周,结果显示,儿童组中低剂量及高剂量组的平均EASI 得分改善分别为76.2%、63.4%,青少年组为66.4%、69.7%;另外儿童低剂量组瘙痒评分改善41.6%、高剂量组改善39.6%,青少年组则分别为30.8%及37.6%。Dupilumab 在AD 治疗中,不良反应轻微且药物耐受性良好,其中眼睑炎症、结膜炎和角膜炎相对常见,其他不良反应包括注射部位反应和感染,特别是单纯疱疹病毒感染的风险增加[30]。目前有多项面向6个月至6岁重度AD儿童的安全性、药代动力学和疗效评估试验正在开展(NCT 03346434、NCT02612454、NCT03054428)。见表3。
3.2 Tralokinumab
Tralokinumab 为抗IL-13 单抗,可阻止IL-13 与其受体结合以抑制细胞内信号转导。IL-13 在AD 患者的血液及皮肤中高度表达,通过负调节兜甲蛋白、外皮蛋白等结构蛋白的基因表达,导致皮肤屏障破坏[31]。在成人AD 患者进行的IIb 期随机双盲安慰剂对照试验(NCT02347176)中以安慰剂,tralokinumab 45 mg、150 mg、300 mg,每2 周1 次皮下注射持续12周,结果显示tralokinumab治疗组的EASI评分皆有下降,下降程度与剂量相关,300 mg组的EASI评分相比安慰剂组下降明显(P=0.01)。上呼吸道感染及头痛为tralokinumab最常见的不良反应[32]。目前一项面对12~17岁中重度AD患者并评估药物安全性、有效性、耐受性的多中心随机双盲安慰剂对照III 期试验正在招募(NCT03526861)。见表3。
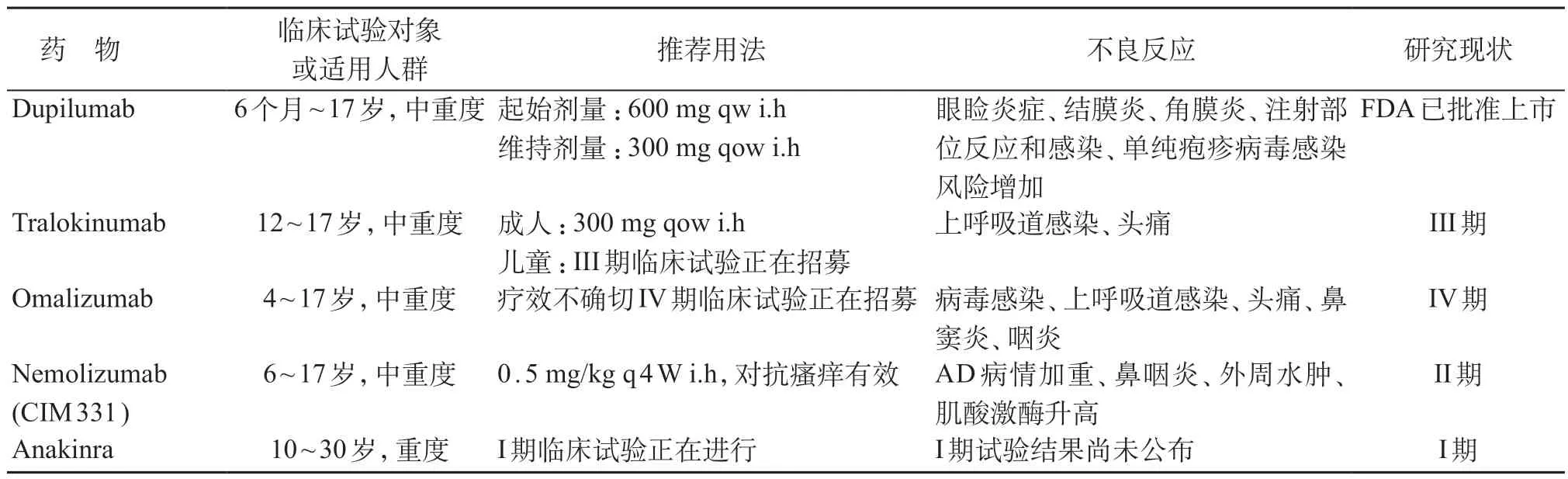
表3 生物制剂
3.3 Omalizumab
Omalizumab 为抗IgE单克隆抗体,可阻断IgE 与肥大细胞和嗜碱性粒细胞上的受体结合,稳定肥大细胞和嗜碱性粒细胞并抑制细胞激活。由于IgE参与多种炎症细胞活化的生物学效应,加重急性皮损并上调Th 2 炎症反应[33],其作为“特应性”的指标,在AD 发病机制中是否有致病作用目前尚存在争议,有观点认为IgE 在Th 2 炎症反应通路过程中非主要致病因素[34]。虽然部分病例报道或非对照药物临床研究表明抗IgE治疗有一定疗效[35],但在验证性或随机性试验中,抗IgE 治疗对AD 患者未见明显改善[36-37]。两项利用omalizumab治疗4岁及以上儿童和成人AD患者的随机双盲安慰剂对照试验显示,omalizumab 治疗组的特应性皮炎积分指数(SCORAD)改善程度与安慰剂组相当[38-39]。对两项RCT及13个病例报道共103例患者进行的meta分析表明,目前尚无结果证明omalizumab对AD具有疗效[38]。Omalizumab的安全性良好,不良反应在多数研究中与对照组相当,最常见为病毒感染、上呼吸道感染、头痛、鼻窦炎和咽炎等。目前对62例4~19岁重度AD患者的随机双盲安慰剂对照IV期临床试验(NCT02300701)已完成,结果尚未公布。见表3。
3.4 Nemolizumab(CIM331)
Nemolizumab 是抗IL-31Rα单克隆抗体。IL-31通过结合免疫细胞、角质形成细胞或神经纤维上的IL-31 Rα 受体,激活JAK-STAT 通路并导致瘙痒发生[39],故阻断IL-31 与受体结合可减轻AD 所造成的瘙痒不适。2016 年首次进行药物临床试验,结果显示,治疗组(0.3 mg/kg、1 mg/kg、3 mg/kg)VAS评分下降程度较对照组明显[40]。目前所报道的临床研究中,无严重不良反应及死亡案例,主要不良反应有AD 病情加重、鼻咽炎、外周水肿和肌酸激酶升高等[41]。近期针对6岁及以上AD患者的I~III期临床试验正在进行(JAPICCTI-173740、JAPICCTI-173741、JAPICCTI-183894、NCT03100344)。见表3。
3.5 Anakinra
Anakinra是一种人重组IL-1受体拮抗剂,其作用为干扰IL-1α及IL-1β的炎症活性,继而阻断IL-1 I型受体(IL-1 R 1)的信号通路,避免Th 2 炎症反应发展[42]。在AD 方面,2010 年开展I 期开放性临床试验(NCT01122914),纳入10~30岁重度难治性AD患者,皮下注射anakinra 3 mg/kg,每日1次持续12周,目前结果尚未公布。见表3。
综上所述,AD 作为婴幼儿最常见的皮肤疾病之一,皮肤炎症、瘙痒与病情反复对患儿及其家属的生活带来严重影响。外用糖皮质激素虽然可以控制并缓解皮肤炎症,但停药后皮疹复发的情况多见,且长期应用不良反应明显,加上家属对激素治疗的抵触,常发生用药不规范、依从性差,导致治疗效果不如预期。外用钙调磷酸酶抑制剂、系统性抗组胺药物、免疫抑制剂等传统治疗,部分中重度AD 患儿的病情仍难以有效控制。新型AD 治疗药物——小分子靶向抑制剂和生物制剂,为传统药物疗效不佳或慢性反复发作的AD 患儿的治疗提供了新的思路,多项临床试验证实了其对AD病情控制的有效性,且不良反应轻,安全性好。近期crisaborole 及dupilumab 在国外已批准用于AD 患儿的治疗,有望成为传统治疗效果不佳时的替代方案。但由于对婴幼儿的临床观察与研究存在相应的困难,药物临床试验对象仍以成人为主。目前新型药物在儿童AD治疗上的应用尚需更多临床试验来证实其可行性,将来还需要投入更多资源进行发展。

