盐酸伊立替康注射液中乳酸反向工程研究
付 强,刘 青,徐兴志,王志云,陆伟跃
(1. 浙江华海药业股份有限公司,浙江 台州 317000; 2. 复旦大学药学院,上海 201203; 3. 中国药科大学药物科学研究院,江苏 南京 210009)
盐酸伊立替康注射液由美国辉瑞制药公司于1996年研发上市,常用于治疗晚期大肠癌[1-2],辅料为乳酸和山梨醇,用盐酸或氢氧化钠调节pH 至3.0 ~4.0,目前原研专利已过期,开发其仿制药具有巨大的经济价值。仿制、原研注射液的辅料用量差异通常应≤5%。本品美国食品药物管理局(FDA)说明书中规定乳酸含量为792 ~828 μg/mL(总乳酸量),而阿根廷国家药物食品与医疗技术管理局说明书中规定乳酸处方量为900 μg/mL(总乳酸量),两者差异超过5%。乳酸主要由单乳酸、乳酰乳酸和水组成[3-4],《中国药典》推荐的滴定分析方法仅能测定乳酸辅料中总乳酸量,不能确定单乳酸和乳酰乳酸的比例[4]。单乳酸可采用离子色谱法[5-7]、液相色谱法[8 -12]和气相色谱法[13-15]等方法进行含量测定,但目前乳酰乳酸含量测定的关注度较低。本研究中采用仿制药反向工程研究技术对原研药中乳酸处方量进行探讨,以确定真实的乳酸投料量,规避仿制药开发风险。现报道如下。
1 仪器与试药
1.1 仪器
1260 型高效液相色谱仪(美国Agilent 公司,单波长紫外检测器);XS105DU 型电子分析天平(梅特勒-托利多国际有限公司,十万分之一);pH 计(梅特勒-托利多国际有限公司);HNS26 型电热恒温水浴锅(上海一恒科技有限公司);Milli-Q Reference 型超纯水仪(默克化工技术<上海>有限公司)。
1.2 试药
乳酸(无锡福祈制药有限公司,含总乳酸量88.2%);盐酸伊立替康注射液(实验室自制,规格为每支40mg∶2 mL);盐酸伊立替康注射液原研品(美国辉瑞制药,规格为每支40 mg ∶2 mL);乙腈(美国Sigma-Aldrich 公司,高效液相色谱);磷酸二氢钠和磷酸(比利时Acros 公司,色谱纯);氢氧化钠(杭州青辰化学试剂厂,分析纯);盐酸(杭州化学试剂有限公司,分析纯);实验用水均为Milli-Q 超纯水。
2 方法与结果
2.1 含量分析
2.1.1 色谱条件
色谱柱:YMC AQ C18耐水色谱柱(250 mm×4.6 mm,5 μm);流动相:20 mmol /L 磷酸二氢钠缓冲液(流动相A,pH 2.5)和乙腈(流动相B),梯度洗脱程序见表1,其中28 ~60 min 的洗脱程序可保证除乳酸外其他组分的洗脱;流速:1.0 mL/min;柱温:30 ℃;检测波长:205 nm;进样量:20 μL。
2.1.2 溶液制备
对照品溶液:取乳酸适量,精密称定,加纯化水溶解并制成900 μg/mL 对照品贮备液,精密移取1 mL,与70 μL 1 mol/L NaOH 混匀,沸水浴加热15 min,再加170 μL 1 mol/L HCl 调至酸性,将所有形态乳酸转化为单乳酸,用流动相A 稀释至约90 μg/mL,即得。
供试品溶液:精密移取1 mL 注射液,与70 μL 1 mol/L NaOH 混合,沸水浴加热15 min,将所有形态乳酸转化为乳酸钠,再加170 μL 1 mol/L HCl 调至酸性,用流动相A 稀释至总乳酸量约90 μg/mL,即得供试品溶液Ⅰ。精密移取1 mL 注射液,加流动相A 稀释至约90 μg/mL,即得供试品溶液Ⅱ,乳酰乳酸未受到破坏。

表1 梯度洗脱程序
2.1.3 乳酸及乳酰乳酸确认
取同一待测注射液,按供试品溶液方法制备并进样,即可计算总乳酸量和乳酰乳酸的比例。进样含90 μg/mL 乳酸的供试品溶液Ⅱ,在色谱图上出现2 个峰,将流出物进行质谱确认。在电喷雾质谱法(ESI-MS)负离子检测模式下,4.3 min 的峰产生m/ z为89.0 的离子,对应乳酸[M-H]-离子,表明该峰为单乳酸;16.6 min的峰产生m/ z为161.0 的离子,对应乳酰乳酸[M-H]-离子,表明该峰为乳酰乳酸。典型色谱图见图1。
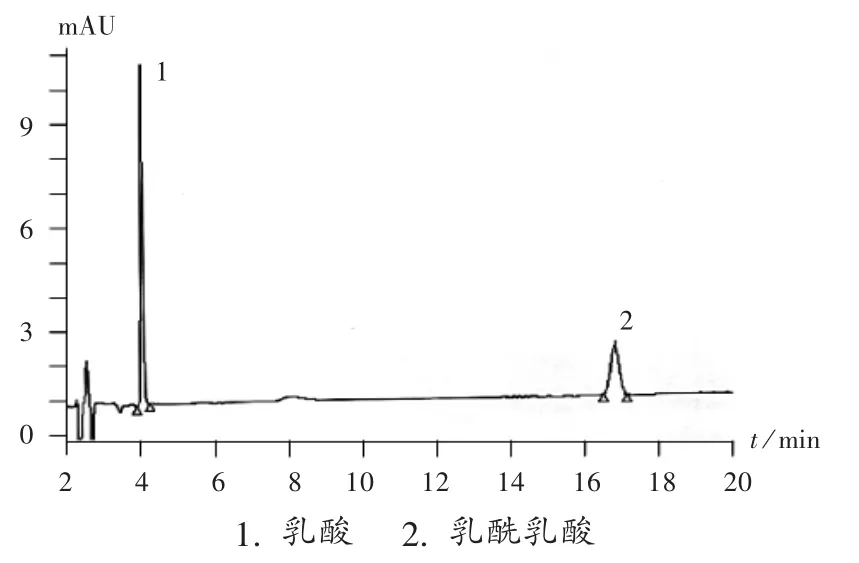
图1 典型色谱图
2.1.4 方法学考察
专属性考察:采用DAD 检测器,在190 ~400 nm 波长范围内,分别进样稀释液(流动相A)、供试品溶液Ⅰ、供试品溶液Ⅱ和盐酸伊立替康注射液各组分溶液各20 μL。结果单乳酸和乳酰乳酸色谱峰是纯的,其他组分与单乳酸和乳酰乳酸峰的分离度均远远大于1.5,表明方法专属性良好。
线性关系考察:分别配制45,72,90,135,180 μg/mL对照品溶液各3 份,各进样20 μL,以乳酸质量浓度(X)为横坐标、乳酸平均峰面积(Y)为纵坐标绘制标准曲线,得线性回归方程Y=851.712 4X+864.974 5,R2=0.999 9。结果表明,乳酸质量浓度在45 ~180 μg/mL 范围内与峰面积线性关系良好(R2≥0.999)。
检测限和定量限确定:适当稀释40.13 μg/mL 对照品溶液并连续进样60 μL,确定方法的检测限[信噪比(S/N)约为3]和定量限(S/N约为10)分别约为0.54 μg/mL 和1.63 μg/mL。
精密度考察:平行制备6 份供试品溶液Ⅰ和供试品溶液Ⅱ,各进样20 μL。结果的RSD≤1.21%(n=6),表明仪器精密度良好(≤2.0%)。
准确度考察:分别称取各组分,制成含有45,90,180 μg / mL 乳酸的供试品溶液Ⅰ,每个质量浓度水平平行配制3 份,各进样20 μL。结果平均回收率为101.0% ~101.7% ,表明方法准确度良好(98.0% ~102.0%)。
乳酸溶液稳定性:取供试品溶液Ⅱ,室温保存,于0,8,40,50 h 时进样,考察乳酸含量。结果单乳酸和乳酰乳酸峰面积的RSD≤0.9%,表明乳酸供试品溶液Ⅱ中单乳酸和乳酰乳酸在50 h 内不会发生明显的相互转化。
2.2 制剂中乳酸含量检测
盐酸伊立替康在水溶液中溶解度小于10 mg/mL,但能以20 mg/mL 的质量浓度形成稳定的交联物[16]。乳酸为稳定剂,其处方量的不确定进一步增加了仿制药开发难度和稳定性试验风险。取原研药,制成供试品溶液Ⅰ和供试品溶液Ⅱ各2 份,每份进样40 μL,测得原研药总乳酸平均含量为807 μg/mL,符合《美国药典》(USP)质量标准的乳酸辅料含有88% ~92%的总乳酸。FDA说明书规定,每1 mL 药液中加入0.9 mg 符合USP 标准的乳酸辅料,即相当于总乳酸量0.792 ~0.837 μg/mL。原研药总乳酸平均含量在上述范围内,表明本品乳酸辅料按FDA 说明书投料。
2.3 制剂中乳酰乳酸含量差异分析
对实验室自制药和原研药进行检测,发现自制药与原研药乳酰乳酸与单乳酸的峰面积比分别为17.53%和4.23%,表明自制药与原研药单乳酸和乳酰乳酸含量存在明显差异。若乳酸或乳酰乳酸对药物稳定性有不同影响,区分单乳酸和乳酰乳酸的量将是一个重要的质量控制指标。
3 讨论
目前,2015 年版《中国药典(二部)》推荐的乳酸含量控制方法为滴定法[3-4],首先使用过量氢氧化钠将乳酸全部转化为乳酸钠,再用盐酸滴定多余的氢氧化钠,但此法仅能检测总乳酸量,不能区分单乳酸和乳酰乳酸比例。
本研究中开发了HPLC-UV 法,既能确定盐酸伊立替康注射液中总乳酸量,也能测定单乳酸和乳酰乳酸比例。通过乳酸溶液直接进样测定单乳酸的含量,在碱性条件下加热破坏乳酰乳酸可测定总乳酸量,专属性、精密度、准确度和溶液稳定性均良好。对原研药的反向工程研究结果显示,原研药乳酸用量在FDA 说明书规定范围内,但原研药中检测到的乳酰乳酸含量仅为自制药的25%,因此推测自制用乳酸辅料的乳酰乳酸含量偏高。通过对盐酸伊立替康注射液中乳酸辅料进行反向工程研究,确定了原研乳酸处方量,以及自制药与原研药乳酰乳酸含量差异,保证自制药的一致性。反向工程研究在仿制药开发中的应用,对于保证产品一致性、提高仿制药质量具有重要意义。

