特应性皮炎患者外周血外泌体调控HaCaT细胞活化及炎症的研究
韩 悦 姚 煦
中国医学科学院北京协和医学院皮肤病研究所,南京,210042
特应性皮炎(atopic dermatitis,AD)是常见的慢性复发性炎症性皮肤病,多见于儿童,常伴食物过敏、过敏性鼻炎和哮喘,患者剧烈瘙痒,严重影响生活质量,是皮肤科最受关注的疾病之一[1,2]。近20年世界范围内特应性皮炎的发病率迅速增高,西方发达国家儿童特应性皮炎的发病率约为10%~20%[3]。近年报道我国多城市儿童特应性皮炎发病率为12.94%。AD的发生与多种细胞息息相关,其中,角质形成细胞(keratinocytes,KC)至关重要,其活化与炎症在AD中扮演着关键性的角色。目前发病机制尚未完全明确,故特应性皮炎的治疗仍非常困难[4]。因此,积极探索特应性皮炎的发病机制具有非常重要的意义。
外泌体是活细胞分泌的来源于晚期核内体的膜性囊泡,直径约为30~150 nm[5]。它天然存在于血液、唾液、尿液和母乳等体液中[6]。外泌体1980年首次被发现,当时被认为是细胞排泄废物的一种方式,如今随着研究深入,外泌体运输功能,特异靶向受体细胞,交换蛋白和脂类或引发下游信号传导参与细胞间通讯等功能逐渐被揭示[7]。不同组织细胞来源的外泌体由于携带的蛋白质不同,从而发挥不同的生物学功能[8]。外泌体除含有蛋白外,还含有各种非编码RNA,如microRNAs等,参与基因的表达调控[9]。
目前为止,外泌体关于AD方面鲜有报道。因此我们尝试通过检测AD患者外周血中外泌体来研究其对KC的调控作用。此文基于传统实验方法拟探讨AD患者外周血外泌体调控HaCaT细胞的活化及炎症,为AD的诊断和发病机制提供一些理论指导。
1 材料与方法
1.1 一般资料 资料概况:本次临床研究均获受试者及其家属知情并签署知情同意书。选取2017年5月至2018年5月期间中国医学科学院皮肤病医院就诊的AD患者和同期健康人的外周血标本各30例为研究对象,并记录患者的年龄、性别。AD患者中位数年龄为17.04岁,男/女比例为1.14,健康人年龄中位数为21.63岁,男/女比例为1.31,所有外周血标本均于清晨空腹采集。
纳入标准: 符合AD的William诊断标准,年龄介于18~70岁,无其他严重疾病者。
排除标准:伴有其他皮肤病,心肝肾功能不全,临床及随访资料不全。
1.2 exoEasy Maxi Kit试剂盒提取外泌体 预先过滤细胞培养上清,将大于0.8 μm的微粒全部除去,将buffer XBP加入到等体积样品中,试管上下震荡5次,室温混合。将上述混合液结合在核酸纯化柱上离心500 g 1 min,弃上清,将柱子复原至同一个接受管中。加入10 mL buffer XWP 5000 g离心5 min以去除残余buffer,弃上清及接受管。转移核酸纯化柱至一个新的接受管。加入400 μL~1 mL bufferXE至膜上孵育1 min,离心500g 5 min,收集洗脱液。再次将洗脱液加入至exoEasy核酸纯化膜中,并孵育1 min,离心5000 g 5 min,收集洗脱液转移至冻存管,置于-80℃冰箱内保存备用。
1.3 外泌体验证
1.3.1 电镜验证 外泌体戊二醛固定。清洗:用1 mL PBS清洗3次,每次静置15 min。锇酸固定:加入0.5 mL 2%锇酸溶液 4度固定2 h。清洗:用1 mL PBS清洗3次,每次静置15 min。脱水:用50%、70%、80%、90%乙醇各1 mL梯度脱水分别静置15 min,再用1 mL 100%乙醇脱水2次,每次20 min。置换:用1 mL丙酮置换2次,每次静置15 min。浸渍。包埋:将样品放入盛有纯包埋剂的包埋板中。聚合:将包埋板置于65℃条件下聚合48 h。染色:醋酸双氧铀染色10 min后清洗;醋酸铅染色10 min后清洗。上机检测。
1.3.2 外泌体粒径分析(nanoparticle tracking analysis,NTA) 采用NTA检测提取物粒径大小,若介于30~200 nm之间,即为外泌体提取成功。
1.4 CCK-8法检测HaCaT增殖 实验采用CCK8法检测各组细胞于转染后0 h、6 h、12 h、24 h、48 h时间点的增殖情况。将三组细胞调整至1.0×105/孔,取100 μL/孔在96孔板中接种,放置于培养箱中培养。每孔加入20 μL的CCK-8溶液(APExBIO,USA),将培养板在培养箱内孵育1~4 h,不用清洗,直接用酶标仪测定在450 nm处的吸光度。每组设6个副孔,重复三次。
1.5 Annexin V-FITC/PI双染法检测细胞凋亡 将转染后的细胞培养48 h,用0.25%胰酶消化细胞后血清终止消化,离心300 g 5 min收集细胞。用冰PBS清洗细胞一次,300 g离心5 min。加入300 μL的1×Binding Buffer 悬浮细胞。加入5 μL的Annexin V-FITC(BD,USA)混匀后,避光,室温孵育15 min。上机前5 min再加入5 μL的PI染色。
1.6 HaCaT细胞RNA的检测
1.6.1 试剂盒提取总RNA 使用RNeasy Mini Kit(QIAGEN,德国)试剂盒提取血清中总RNA,操作步骤按照说明书进行。首先将两组人群的全血离心2000 g 3 min,加入Buffer RLT震荡混匀,将液体移入到2 mL的收集管内离心2 min,加入一倍体积的70%乙醇,混匀,移出700 μL混合物到Rneasy收集柱,10000 rpm离心15 s,倒掉滤液,向柱子中加入700 μL的Buffer RW1,10000 rpm离心15 s,倒掉滤液,向柱子中加入500 μL Buffer RPE 10000 rpm离心15 s,倒掉滤液,向柱子中加入500 μL Buffer RPE盖上盖子,大于10000 rpm离心2 min,将柱子移入到一个新的2 mL收集管内,全速离心1 min,将柱子移入到一个新的1.5 mL 收集管内,加入30 μL的无Rnase water,10000 rpm离心1 min,重复一次,收集滤液。分光光度计检测RNA浓度和OD值,-80℃备用。
1.6.2 荧光定量-PCR(q-PCR)检测细胞中RNA的表达 首先利用primer 5.0进行引物设计,采用miScript Reverse Transcription Kit试剂盒(QIAGEN,德国)将提取出来的总RNA逆转录合成cDNA,反应体系为20 μL,反应条件为37℃ 60 min,95℃ 5 min。以cDNA为模板,利用SYBR®Green PCR Kit(QIAGEN,德国)进行PCR 扩增,反应体系为20 μL,反应条件为95℃ 15 min,1循环;95℃ 15 s,55℃ 30 s,60℃ 30 s,40个循环。以GAPDH作为实验的内参基因,相对表达量以2-△△Ct形式表示,其中△CT=CT(目的基因)-CT(GAPDH)(表1)。

表1 各mRNA引物序列
1.7 统计学方法 文中实验结果数据在SPSS 20.0软件中统计分析,统计图在Graghpad Prism 7软件中绘制和编辑加工,采用独立t检验分析两组独立样本间的均数差异,采用ANOVA检验进行多组间均数差异的比较。实验数据中计量资料以均数±标准差表示,P<0.05为差异有统计学意义。
2 实验结果
2.1 外泌体对HaCaT细胞的增殖的影响 将0 g/L、20 g/L、40 g/L、80 g/L蛋白浓度的正常人-外泌体分别与HaCaT细胞共培养,采用CCK-8法检测各组细胞的0 h、6 h、12 h、24 h、48 h时间点的增殖情况。与对照组相比,各浓度正常人-外泌体组在12 h、24 h、48 h时间点细胞增殖水平均明显降低(均P<0.001),40 g/L外泌体组尤为明显(图1、表2)。
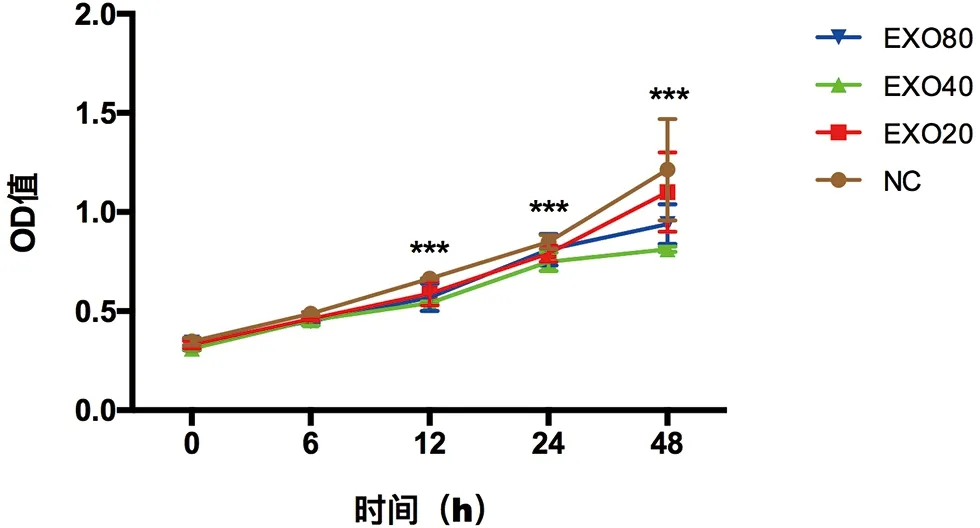
NC:不加外泌体组;EXO20:蛋白浓度20 g/L外泌体组;EXO40:蛋白浓度40 g/L外泌体组;EXO80:蛋白浓度80 g/L外泌体组
图1CCK-8检测各组细胞的增殖情况
2.2 外泌体对HaCaT细胞的凋亡的影响 将0 g/L、20 g/L、40 g/L、80 g/L蛋白浓度的正常人-外泌体分别与HaCaT细胞共培养48 h,采用Annexin V-FITC/PI双染法检测各组细胞的凋亡情况。0 g/L、20 g/L、40 g/L、80 g/L外泌体组细胞的凋亡率分别是2.53±0.3、14.53±2.6、17.12±2.2、12.12±1.2,与对照组相比,各浓度外泌体组细胞凋亡水平均明显升高,组间差异有统计学意义(P<0.001)。凋亡实验结果中40 g/L外泌体组尤为显著(图2)。
2.3 外泌体验证 为了验证从外周血上清中分离的提取物是外泌体,我们用了两种方法—电镜与NTA。透射电镜下观察到均一的微小囊泡,NTA镜下观察到提取物粒径在3 nm与200 nm之间,即为外泌体分离成功(图3、4)。
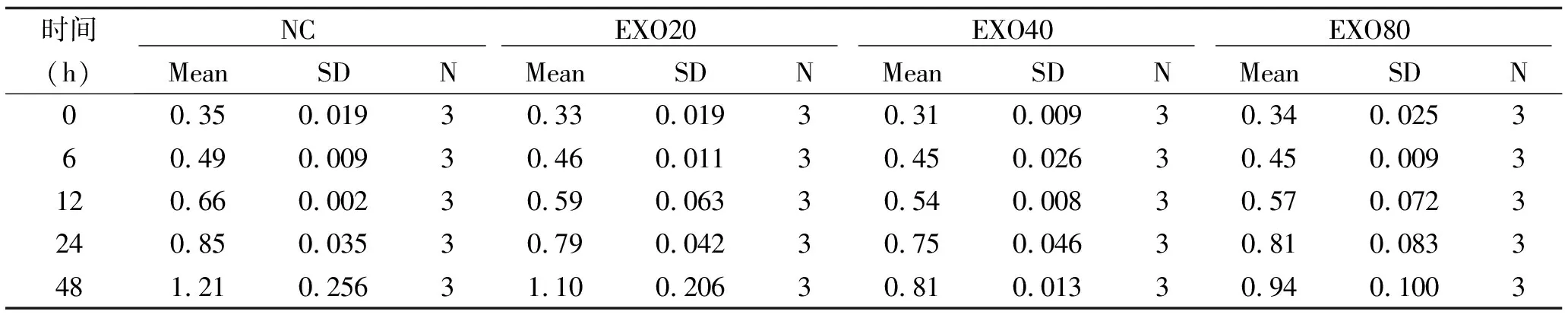
表2 CCK-8法检测各浓度外泌体加入HaCaT细胞的增殖情况
NC:不加外泌体组;EXO20:蛋白浓度20 g/L外泌体组;EXO40:蛋白浓度40 g/L外泌体组;EXO80:蛋白浓度80 g/L外泌体组
2.4 外泌体对HaCaT细胞的调控作用 根据加入外泌体情况分为三组:AD-外泌体组、正常人-外泌体组和对照组,利用q-PCR检测各组细胞的活化(K16)、分化(K10、IVL)、炎症指标(TSLP、IL-25、IL-33、CXCL1、CXCL2)。结果显示,较于正常人-外泌体组和对照组,AD-外泌体组中K16、K10、IVL,TSLP、IL-25、IL-33、CXCL2表达上调(P<0.05),CXCL1表达水平无统计学差异(P>0.05)(图5)。
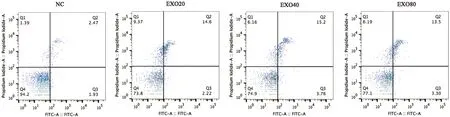
NC:不加外泌体组;EXO20:蛋白浓度20 g/L外泌体组;EXO40:蛋白浓度40 g/L外泌体组;EXO80:蛋白浓度80 g/L外泌体组
图2流式细胞仪检测各组细胞的凋亡情况
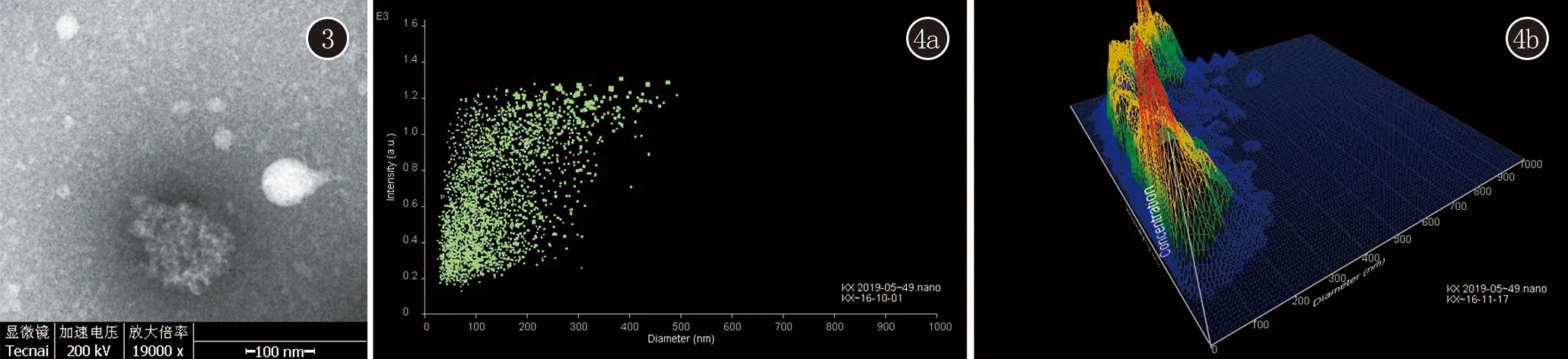
图3 透射电镜下外泌体结构(×400) 图4 NTA检测外泌体粒径大小 4a:外泌体粒径检测;4b:外泌体粒径三维模式图


NC:未加入外泌体的对照组;NH-EXO:加入蛋白浓度为40 g/L的正常人外泌体组;AD-EXO:加入蛋白浓度为40 g/L的AD外泌体组
图5qPCR法检测各组细胞的细胞因子的表达差异
3 讨论
特应性皮炎表现为皮肤增厚、瘙痒,有明显的家族遗传倾向,易患哮喘、过敏性鼻炎等过敏性疾病。大多从幼时发病,皮损迁延不愈、瘙痒剧烈,甚至影响患儿的身心健康[9-11]。目前,AD的发病机制尚不明确。因此,探索有关AD发生发展的分子标记具有重要意义。如果能利用现代实验手段找出AD患者中的一些表达差异的生物标记物,那么对AD的早期治疗具有非常重要的科学价值。随着分子生物学、免疫学等基础学科的迅猛发展,对AD的研究日益深入,
多种与AD的发生发展密切相关的生物标记物被发现,外泌体即是其中之一[12]。
近期多项研究揭示了各种来源的外泌体对KC的多种调控作用。Zhang等[13]的研究解释了肥胖者伤口愈合速度比正常人慢的现象,脂肪细胞源性外泌体通过直接与PUM2结合,促进其介导的NF-kB通路激活,进而诱导人KC炎症和凋亡。最近一项研究[14]显示,泛发性脓疱性银屑病中性粒细胞源外泌体较正常中性粒细胞诱导KC中IL-1β、IL-36、IL-18、TNF-α和C-X-C基序趋化因子配体等炎症基因的高表达。此外,患者的中性粒细胞比对照组分泌更多的外泌体,后被KC迅速内化,通过激活NF-kB和MAPK信号通路增加这些炎症分子的表达。综上研究,脂肪细胞和中性粒细胞源外泌体可以调控人KCs的增殖、凋亡和炎性因子的分泌,从而影响疾病的发生发展。基于以往研究,我们在本试验中拟探索AD患者外周血中外泌体能否对KC的活化、炎症产生影响。
首先收集我院AD患者和健康人的外周血样本各30例并分离血浆中外泌体,采用电镜与NTA来进行外泌体的结构验证,然后进行外泌体的功能研究:将不同蛋白浓度的外泌体分别与HaCaT细胞共培养,检测各组细胞的增殖、凋亡情况,目的是找出外泌体对细胞增殖凋亡的影响和它的最佳刺激浓度。结果发现,加入正常人-外泌体后的细胞增殖率较对照组显著降低、凋亡率明显升高;其中,加入40 g/L蛋白浓度刺激后的差异尤为显著。因此我们将该浓度的外泌体进行后续实验研究。根据加入外泌体情况将HaCaT细胞分为AD-外泌体组、正常人-外泌体组和对照组,检测三组细胞的活化(K16)、分化(K10、IVL)、炎症(TSLP、IL-25、IL-33、CXCL1、CXCL2)指标。结果显示,较正常人-外泌体组和对照组,AD-外泌体组中K16、K10、IVL、TSLP、IL-25、IL-33、CXCL2表达升高,而CXCL1差异无统计学意义。所以,AD-外泌体可以促进KC的增殖和炎症因子的分泌。得出结论:AD患者外周血外泌体可以抑制KC的凋亡并促进KC的增殖、活化及炎症因子的分泌,从而参与AD的发生发展。
在设计方面该实验有一定的不足之处,因各种客观因素,样本量较少,从而对研究结果产生一定的影响,后期有条件可适当对样本量进行扩充。此外,细胞实验中我们选用了人正常角质形成细胞系HaCaT,值得说明的是,细胞株与人体细胞间毕竟具有一定的变异性,目前两者差异能否对实验结果构成影响尚不明确。重要的是,外泌体中影响人KC活化、炎症的具体物质,还有待于进一步发现和研究。

