乳腺浸润性乳头状癌预后影响因素分析
韩琼 吴斌 袁茂林
乳腺恶性乳头状肿瘤包括浸润性乳头状癌(Invasive Papillary Carcinoma,IPC)、实性乳头状癌、包裹性乳头状癌。WHO乳腺肿瘤专家组将浸润性乳头状癌归类于浸润性乳腺癌的少见类型范畴,将实性乳头状癌、包裹性乳头状癌视为导管原位癌。乳腺浸润性乳头状癌是1种90%以上的浸润性成分呈乳头状形态的浸润性腺癌[1]。目前该肿瘤的预后研究较少,缺乏标准治疗方案。本研究以1413例的大样本数据来回顾性分析乳腺浸润性乳头状癌的特异性生存的影响因素,并讨论其治疗方法。
对象与方法
一、研究对象的来源
美国癌症研究所支持的SEER项目(www.seer.cancer.gov)大约覆盖了34.6%的美国人口,研究数据经过严格改进,在癌症监测领域提供基于人口统计数据方面的分析资料[2]。本研究从SEER*Stat 8.3.5软件端获取2018年11月新提交的SEER数据资料,获取1990~2016年间诊断为乳腺部位发生浸润性乳头状癌的女性病例。纳入标准:(1)1990~2016年间经病理确诊为浸润性乳头状癌(疾病编码为8503/3);(2)女性;(3)所有病例仅有一种恶性肿瘤。排除标准:(1)排除失访病例;(2)排除非病理确诊者;(3)排除分化、T、N、M、ER、PR、手术方式资料缺失者。随访的开始日期为病理明确诊断,随访截止日期为2016年12月31日,随访终点事件为病人死亡或随访日期截止,获取并分析研究对象的生存时间、生存状态、种族、婚姻状态、分化、T分期、N分期、M分期、ER、PR、手术情况、放疗是否、化疗与否等信息。
二、方法
将已婚、同居病例分为非单身组,将未婚、离异、分居、寡居病例分为单身组;按照诊断疾病时的实际年龄分为60岁及以下组、60岁以上组;将手术分为未手术、保乳手术、非保乳手术;T、N、M分期采用登记的AJCC第7版分期规定。应用IBM SPSS Statistics 25.0分析研究资料的临床病理特征;Cox比例风险模型单因素分析影响预后的因素,将P<0.10的影响因素纳入Cox多因素分析,以探究肿瘤特异性死亡的独立影响因素。采用GraphPad Prism 8作肿瘤特异性生存曲线图(Log-rank检验)。所有检验取双侧检验,设P<0.05为差异有统计学意义。
结 果
1.临床病理特征分布:纳入符合条件的病例1413例,随访时间为0~322个月,中位随访时间为65个月。年龄23~97岁,中位年龄为66岁。63.4%为60岁以上女性,病灶均发生于单侧乳房,原发病灶中有7例位于乳头区,92例位于中央乳晕区,186例位于内上象限,82例位于内下象限,442例位于外上象限,98例位于外下象限,5例位于腋尾区,326例病灶覆盖于象限处,175例病灶未具体描述。本研究中有48(3.4%)例为局部晚期,327(23.1%)例为淋巴结转移,14(1.0%)例为远处转移,106例因肿瘤死亡。治疗措施中有20例未接受手术、放化疗,564例仅接受手术治疗,2例仅化疗,1例仅放疗,141例接受了手术联合化疗,456例手术联合放疗,229例手术联合放化疗。其临床病理特征见表1。

表1 乳腺浸润性乳头状癌的临床特征
2.浸润性乳头状癌病例相关因素的生存分析:本研究中1年特异性生存率约99.4%,3年特异性生存率约为96.8%(生存曲线分布见图1)。根据N分期的生存曲线分布显示,不同N分期的组间生存曲线分布有显著差异,N分期越晚且有生存趋势越差的趋势。此外,不同的分化程度(P<0.001)、T分期(P<0.001)、N分期(P<0.001)、M分期(P<0.001)、手术情况(P<0.001)、化疗情况(P<0.001)、ER表达(P<0.001)、PR表达(P<0.001)的组间生存曲线分布具有显著差异性。Cox回归模型的单因素分析发现,婚姻、年龄、种族、偏侧、放疗无相关性,而不同的分化、T分期、N分期、M分期、手术、化疗、雌激素受体(ER)、孕激素受体(PR)影响预后,差异有统计学意义(P<0.05)。见表2。

图1 浸润性乳头状癌病例的肿瘤特异性生存曲线
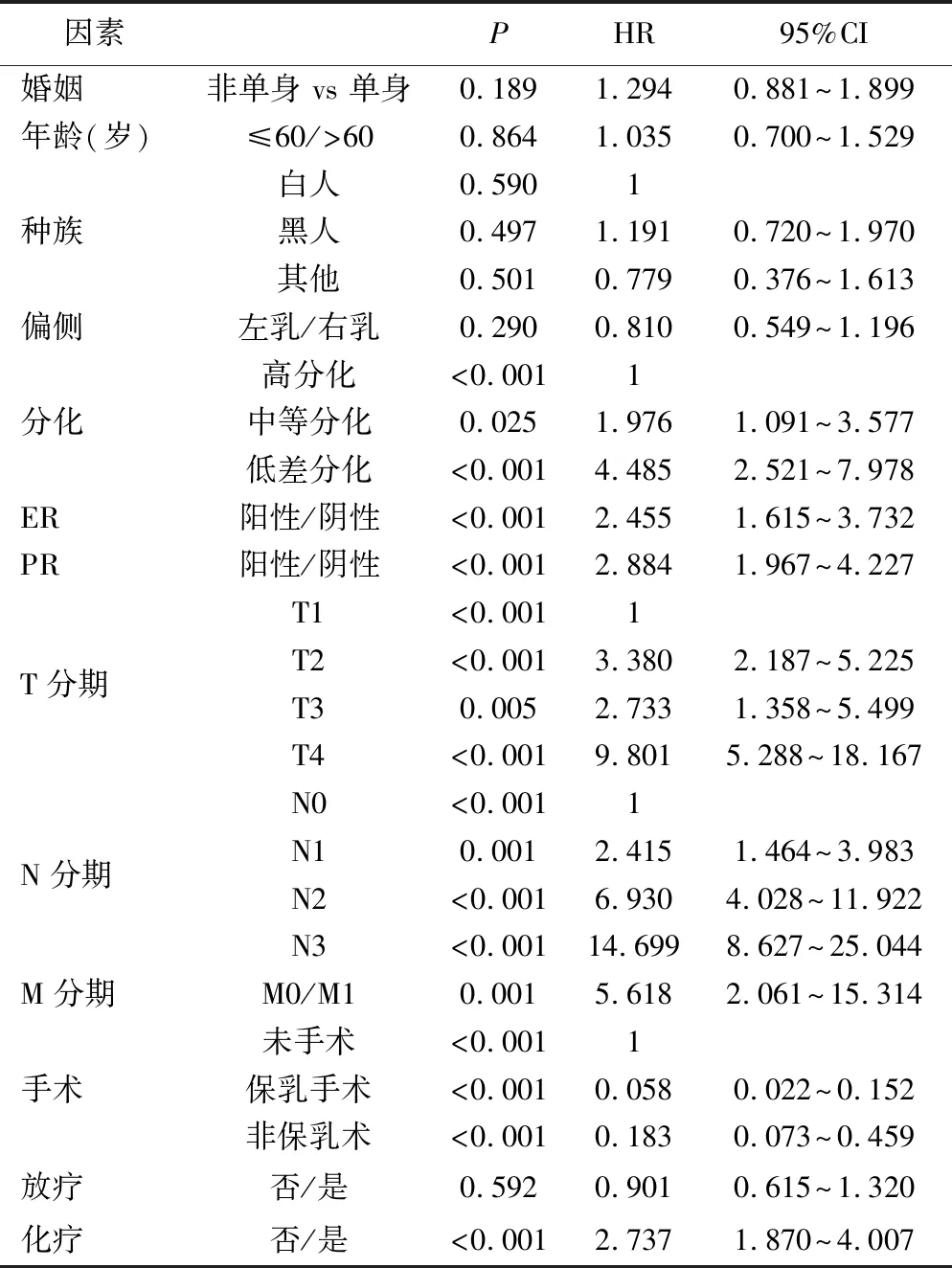
表2 Cox比例风险回归模型单因素分析
3.Cox比例风险回归模型分析肿瘤特异性死亡的影响因素:Cox单因素分析后出影响预后的各因素经调整后,多因素Cox比例风险回归模型分析发现分化程度、M分期、化疗与否对预后无显著影响,而T分期、N分期、PR、手术是影响肿瘤特异性生存的独立因素(P<0.05)。见表3。

表3 Cox比例风险回归的多因素分析结果
讨 论
浸润性乳头状癌在镜下表现为乳头状的浸润性成分由导管细胞围绕着间质纤维血管轴心紧密排列[3]。乳头状肿瘤的形态是动态改变的,乳头状形态在原位期、浸润期及远处转移灶可见,在侵袭过中发生丢失,从而产生如浸润性微乳头状癌等其他类型乳腺癌[4]。包裹性乳头状癌、实性乳头状癌、浸润性乳头状癌具有相似的形态学特征,相似的免疫表型和基因组表型[5]。浸润性乳头状癌的特征、预后不同于其他亚型,可能是浸润性乳头状癌的上皮细胞迁移基因如PLAT和CTSF等表达较包裹性乳头状癌高,转录谱表达存在着显著差异[6]。临床上鲜有浸润性乳头状癌的研究,常将其作为浸润性癌治疗,可能导致过度治疗。本研究主要讨论影响浸润性乳头状癌预后的因素和适宜的治疗方法。
通常乳腺癌组织分化级别越高,发生不良预后的可能性越大[7-9],现有第8版AJCC乳腺癌分期也纳入了分化对乳腺癌预后的影响[10]。有学者认为,浸润性乳头状癌作为特殊类型浸润癌,预后一般与分化级别有关[11]。这篇大样本研究经过调整影响因素后,发现分化级别不是预后的独立因素。相关性分结果显示,分化情况与年龄、种族、部位、ER、PR具有相关性。其中,ER阴性病例中,149/206(72.3%)为3级分化,45/206(21.8%)为2级分化,12/206(5.8%)为1级分化。耿珊珊等[12]研究发现,ER、PR可影响浸润性乳头状癌的预后,但非独立影响因素。通过对1413例完整信息的病例分析发现,PR独立影响预后,且PR阴性病例发生特异性死亡风险是PR阳性病例的2.136倍。
T、N、M分期对浸润性乳腺癌的预后有重要作用,国内外浸润性乳头状癌研究鲜有M1期或IV期的报道。本研究中远处转移病例14例,其中 2例未进行治疗,分别随访1个月、29个月后发生死亡;1例接受手术联合化疗,1例接受手术联合放化疗,分别随访14个月、30个月后死亡;6例接受治疗的病人在随访5~150个月内均存活,提示即使该病发生转移,采取治疗后仍然可以达到较为满意的生存效果。
手术是乳腺恶性肿瘤的主要治疗方式,有学者推荐乳腺乳头状癌病例不常规做前哨淋巴结活检[13]。因浸润性乳腺癌不同于包裹性乳头状癌、实性乳头状癌。本研究结果显示,浸润性乳头状癌的腋窝淋巴结转移占比23.1%,远处转移病例占比1.0%,在没有明确腋窝淋巴结转移的影像或病理依据时,建议对检查阴性的浸润性乳头状癌进行前哨淋巴结活检。本研究中保乳手术或非保乳手术都较未手术病例能获得生存获益,考虑到保乳手术联合放疗可以为病人带来美观需求,减少乳糜漏等风险。具体术式可以根据病人临床病理特征、意愿等方面进行个体化治疗。
一项局灶浸润性乳头状癌的研究发现,保乳手术联合放疗的总体生存时间(OS=16.8年)优于单纯肿瘤切除术(14.9年)、单纯乳房切除术(14.2年)[14]。另外一项524例浸润性乳头状癌研究显示,放疗后的总体死亡风险是不放疗的0.853倍[15]。放疗可以降低乳腺癌的局部复发率和死亡率。整合治疗方法后发现,手术联合放疗预后稍高于单纯手术治疗,这种差异无统计学意义,但可以作为保乳手术后的辅助治疗,而不推荐放射治疗作为常规治疗方案。
有文献报告1例Ⅲ期的乳腺浸润性乳头状癌的病灶在10年间仅增长了1.7 cm,免疫组化及转移情况几乎无改变[16]。考虑本病进展慢,预后较良好,部分学者不建议进行过度治疗[11,17]。生存分析显示化疗后病例预后较未化疗病例稍差,手术联合化疗效果也较单纯手术治疗差。化疗相关的影响因素有婚姻、年龄、种族、部位、分化、ER、PR、手术、放疗等。调整其他混杂因素后发现,化疗后病例发生肿瘤特异性死亡风险为未化疗者0.787倍,但差异不具有统计学意义,故化疗并不能带来明显的生存获益。
有个案研究报道乳头状癌病例接受手术联合他莫昔芬的治疗效果较好[18],浸润性乳头状癌的新辅助内分泌治疗甚至达到病灶完全缓解[19]。本研究中ER、PR阳性表达率高达85.4%、77.3%,考虑内分泌治疗的不良反应较少,推测内分泌治疗可能成为浸润性乳头状癌的有效治疗手段之一。
综上所述,乳腺浸润性乳头状癌的特异性生存率较好,要注意防止过度治疗。早期手术治疗可干预肿瘤进展,在一定程度上改善预后。手术方式可结合多方面考虑进行个体化手术治疗,但不建议常规行腋窝淋巴结清扫。总体上,浸润性乳头状癌的放化疗未见明显生存获益,而内分泌治疗可能是一种有效的治疗方式,但需要更多的前瞻性临床研究。

