rTMS治疗帕金森病认知障碍的研究进展
廖秋霞,温伟峰,刘初容
(广东三九脑科医院,广东 广州)
0 引言
帕金森病(Parkinson's disease,PD)是中老年常见的神经退行性疾病,发病率约0.2%[1],仅次于阿尔茨海默病 (Alzheimer's disease,AD),因中脑黑质致密部多巴胺能神经元变性导致,临床表现分两大类[2]:运动症状有运动迟缓、肌强直、静止性震颤、姿势步态异常等;和非运动症状有嗅觉减退、抑郁、认知障碍、睡眠-觉醒障碍、疲劳等,认知功能障碍是最常见的非运动症状之一[4],并常成为PD患者就医的主诉。
近年来很多研究发现,很多患者在疾病早期就出现了不同程度的认知功能损害,且很难被患者本人和照顾者发现,并且最终可能发展为帕金森病痴呆(PDD),严重降低患者的日常生活自理能力、社会功能和生存质量,加重家庭和社会的负担,成为PD患者致残致死的一大因素[5]。目前,没有PD的治愈手段,常通过药物和手术治疗缓解运动症状,对于认知障碍的治疗更加有限,且有些干预可能进一步加重认知损害[6]。
重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)是一种利用交变磁场无衰减通过颅骨产生感应电流,改变皮质兴奋性,影响脑内代谢和神经电生理活动的治疗技术,无创、安全性高,成为帕金森病认知障碍的新型康复治疗手段[7]。
1 PD认知功能障碍
1.1 临床表现特点
在疾病早期,PD多表现为轻度认知障碍(PD-MCI)[6],可表现出五个认知域的损害:①视空间结构能力,对于面孔再认能力、视运动速度和协调能力、视觉信息综合加工处理能力下降;②注意力和工作记忆;③计划执行功能和思维能力;④记忆力,患者的长时记忆、短时记忆和瞬时记忆均可能受累;⑤言语能力,主要表现为言语的流畅性降低、字数减少、音量降低,但理解能力正常,可能与患者的构词能力和运动障碍有关[8]。
在Hobson等[9]长达16年的随访研究中发现,约有90%的PD-MCI最终进展为PDD。与AD患者相比,PDD的记忆障碍表现较轻微,但在视空间障碍和执行能力障碍方面的表现更为突出,且更容易伴发抑郁、幻觉、易激惹等精神行为症状[10]。
1.2 相关神经病理机制
1.2.1 神经递质紊乱
许多研究显示,PD患者的认知功能损害与多种神经递质系统的退行性变密切相关,并且PD-MCI不同的认知域损害可能与不同的神经递质系统紊乱相关[11]。Kehagia等[12]提出的“双重综合征”假说,认为多巴胺能系统紊乱与执行功能障碍有关,而胆碱能系统和去甲肾上腺素能系统紊乱则与PD患者的注意力、记忆、视空间能力损害有关,虽然这些神经递质通路影响认知功能的具体机制尚未明确。
1.2.2 脑萎缩
PD脑萎缩的发病机制尚不明确,但许多临床影像学和尸检结果显示,PD患者可能存在不同程度多个脑区域的萎缩,且以额叶为多,在PD-MCI和PDD更为明显[13]。2005年,Naganosaito等[14]研究发现,PDD患者的扣带回、颞叶、背外侧前额叶、尾状核及丘脑区域出现广泛的萎缩性改变。无独有偶,多年后Weintraub等[15]也发现了PD-MCI患者出现了海马、颞叶、前额叶、枕叶、顶叶萎缩,PDD萎缩更为显著。不同解剖部位脑萎缩,对于认知障碍的影响也有差别。前额叶在脑的高级神经功能(包括注意、记忆、执行和决策、逻辑推理、思维等)起支配地位,内有广泛的神经纤维投射到大部分皮质和皮质下结构,产生直接或间接的联系,这也是PD患者出现工作记忆、视空间和执行功能障碍的发病机制,并且额叶萎缩对于额-纹状体通路的损害也会导致多巴胺失调。颞叶萎缩则与我们的长时记忆和语言功能相关,在AD中最为典型。枕叶区损害可能导致视空间障碍。
1.2.3 LB形成
Braak等[16]的研究显示,PDD患者的主要病理改变是,脑组织内α-突触核蛋白沉积形成路易小体(LB),并且LB的数量和认知障碍程度相关,皮质内LB也与AD患者病理学改变存在相关性[17]。
2 rTMS影响PD认知功能的可能机制
临床上,rTMS利用多系列重复性的刺激达到长时程刺激效应,以及对于大脑远隔区域的刺激,高频率(≥5HZ)刺激可以提高皮层兴奋性,低频率(≦1HZ)刺激则相反。对于应用rTMS治疗PD的研究结果证明,影响治疗效果的磁刺激参数有:刺激部位、刺激频率、强度、刺激脉冲数和持续治疗时间。目前临床上,关于rTMS治疗PD的机制比较被大家接受的观点有三点:
①改变皮质兴奋性:PD的主要特征是中脑黑质多巴胺能神经元丢失,导致纹状体系统的多巴胺递质减少,乙酰胆碱系统功能相对增强,皮质- 基底核-丘脑皮质环路兴奋抑制处于失衡状态。在PD病理生理机制研究中,fMRI结果证实,PD患者的辅助运动区和背外侧前额叶兴奋性减低,而初级运动皮质区和运动前区的兴奋性增高[18]。因此,临床上可利用TMS改变皮层兴奋性的作用,去减缓PD临床症状;②促进神经递质的释放:rTMS可通过激活皮质到基底核的投射纤维,间接地激活中脑多巴胺能神经元通路,刺激DA释放[19]。也可以增加PD的血流灌注,影响脑内儿茶酚胺代谢,促进DA的释放和抑制DA的分解[20];③神经可塑性:rTMS通过内生感应电流,影响脑内神经电生理活动,改变皮层兴奋性和脑内代谢,促进损伤神经修复,从而促进皮质功能重组[21]。
3 rTMS在PD认知障碍治疗的临床应用
早在1994年,Pascual-Leone[22]等就报道了6例PD患者经过TMS,显著改善了运动反应时间。近年来,关于rTMS在PD的康复治疗临床研究较少,这些研究也多应用于改善运动功能和抑郁睡眠等情绪障碍上,关于认知的报道更是少之又少。现将部分研究总结于表1。
目前,临床上rTMS应于PD的靶点有:初级运动皮质(M1)区、辅助运动皮质(SMA)区、双侧背外侧前额叶(DLPFC),刺激频率有低频(1HZ,<1HZ)和高频(5HZ,10HZ,15HZ,25HZ 等)。刺激左侧DLPFC可以改善学习、工作记忆和注意力、视空间等认知功能[23,26,28],刺激右侧DLPFC可以改善注意力、时间知觉能力,提高任务执行功能[27],也有报道了高频刺激右侧后顶叶改善视空间运动学习能力[25],可能与右顶叶的空间注意能力有关。但对于PD患者的语言功能,刺激口面部M1区对于言语清晰度、舌头灵活性、语速等方面有积极影响,但刺激DLPFC没有明显效果[24],这也提示PD患者的言语障碍与运动功能减退有关。并且rTMS对于这些功能的改变,效果可以持续一段时间[28]。但这些报道,普遍研究的样本量较少,且磁刺激治疗的时间和随访时间较短,代表性不够。尚未能形成关于rTMS应用参数的可以指导临床的统一标准。
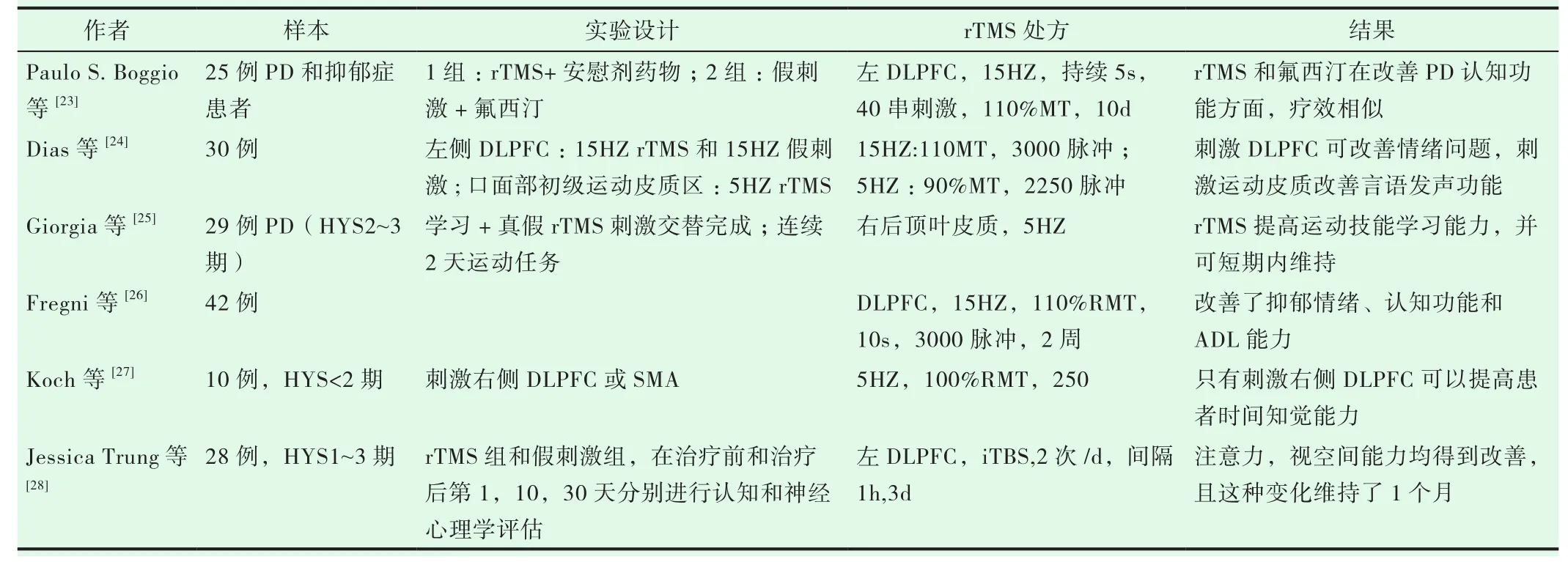
表1 近年来关于rTMS改善PD认知功能的部分临床研究
4 总结
随着科技的发展,TMS技术的磁场强度和设备性能有了较快的提高,临床普及度越来越广,但关于TMS的不良反应报道,仍然是很少的。一般来说,25HZ以下的重复刺激几乎不可能引起癫痫发作,临床上患者主诉头皮疼痛和轻微头晕较多,这些在治疗结束后可短时间内消失[29]。目前,在临床上应用rTMS技术改善PD的运动症状和PD-MCI、PDD认知功能研究较少,对于治疗的参数标准没有指南指导,以及影响PD的作用机制也不明确,这些有赖于未来更大样本量的实验研究去实现。
综上所述,rTMS可以改善PD患者的认知功能和ADL能力,提高他们的生活质量,且无植物神经功能和内脏副作用(与药物干预相比)、非侵入性以及成本低廉(与手术干预相比),在临床有很大的推广价值。

