微柱离心-HPLC法测定半乳糖化去甲斑蝥素脂质体的包封率*
周 卿,杨 鑫,余 兰,蒲家志
(1 遵义医科大学药学院药物分析教研室,贵州 遵义 563003;2 遵义医科大学药学院2014级学生,贵州 遵义 563003)
去甲斑蝥素是(norcantharidin,NCTD)是采用人工方式合成的抗肿瘤药物斑蝥素的衍生物,在临床上对于原发性肝癌有较好治疗效果,也对胃癌、食管癌、乳腺癌等有一定疗效,但由于其在人体内代谢快、需要增加给药次数以保证药效,但同时该药对泌尿系统有较强的刺激性,需要严格控制使用剂量,为提高药物的生物利用度和保证用药的安全,研究具有靶向特性的新剂型有其必要性[1-4]。脂质体作为一种新型的载药系统,具有天然的靶向性、可改善药物的组织分布,提高疗效、降低毒副作用等特点而收到广泛关注。为提高NCTD在肝脏部位的特异靶向性,课题组合成了一种连接半乳糖基的胆固醇配体(2-(5-胆甾烯-3-b-氧基)-1-(1′,2′,3′,4′-四-O-a-D-半乳糖-6-醇)乙酯)用于制备NCTD脂质体,期望利用哺乳动物肝实质细胞膜表面的去唾液酸糖蛋白受体(asialoglycoprotein receptor,ASGPR)可特异性识别端基含有半乳糖或氨基半乳糖的载体的特性,提高NCTD在体内的滞留时间及改善在组织中的分布特性[5-6]。为评价及控制Gal-NCTD-Lips的质量,课题组通过比较选择了葡聚糖凝胶微柱离心法结合HPLC法测定其包封率,并考察了影响因素,为Gal-NCTD-Lips的质量控制提供了理论依据。
1 仪器与试药
1260型高效液相色谱仪,美国安捷伦科技有限公司;RE-2000E型旋转蒸发仪,上海亚荣生化仪器厂;AXTGL16M-Ⅱ型离心机,盐城分析仪器有限公司;TU-1810型紫外分光光度计,北京普析科技有限公司;BT125D型万分之一分析天平,北京赛多利斯科学仪器有限公司。
去甲斑蝥素原料药(含量:97.5%,批号:16110805),南京泽朗医药科技有限公司;去甲斑蝥素对照品(含量:98.00%,批号:17052003),北京世纪奥科生物技术有限公司;Gal-NCTD-Lips(实验室自制);Sephadex G-50,瑞典pharmacia公司;甲醇、乙腈均为色谱纯,其余试剂均为分析纯,二次蒸馏水。
2 方法与结果
2.1 Gal-NCTD-Lips的制备
准确称取一定质量的磷脂和半乳糖化胆固醇配体(3:1),以及去甲斑蝥素(药脂比1:12)于茄型烧瓶中,加入20 mL氯仿使其完全溶解,40 ℃水浴中旋转减压蒸发除去氯仿,使其在瓶内壁上形成薄膜,在瓶内加入10 mL pH 7.0的PBS缓冲溶液,静置30 min使其脂质薄膜充分水化溶胀,探头超声(功率400 W)10 min,得半透明乳白色的Gal-NCTD-Lips混悬液[7]。
2.2 NCTD的含量测定
2.2.1 色谱条件
色谱柱:Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相:0.1%磷酸:乙腈(92:8);流速:1 mL/min;检测波长:211 nm;进样量为20 μL,柱温25 ℃。
2.2.2 专属性考察

图1 NCTD的色谱图
取NCTD对照品溶液、空白脂质体(blank-Gal-Lips)破乳液、Gal-NCTD-Lips破乳液,在“2.1.1”项色谱条件下进样分析,色谱图见图1,在该色谱条件下,样品中其它辅料不干扰NCTD的测定,保留时间为6.7 min。
2.2.3 线性关系
精密吸取NCTD对照品溶液,用PBS(pH 7.0)稀释并定容为浓度为0.03、0.06、0.09、0.12、0.15、0.18 mg/mL的标准系列溶液,在“2.1.1”项色谱条件下进样分析,记录峰面积A,以峰面积A对NCTD浓度c进行线性回归,得线性方程A=657.24c+0.44,r=0.9994。结果在0.03~0.18 mg/mL范围内,线性关系良好。
2.2.4 精密度实验
精密吸取NCTD对照品溶液,用PBS(pH 7.0)溶液稀释并定容为浓度为0.03 mg/mL、0.09 mg/mL、0.15 mg/mL的溶液,在“2.1.1”项色谱条件下进样分析,重复测定5次,记录峰面积,以峰面积计算RSD值分别为0.02%、0.04%、0.01%(n=5),表明该方法精密度良好。
2.2.5 加样回收率实验
精密吸取0.5 mL的blank-Gal-Lips,分别精密加入一定量NCTD对照品溶液,加甲醇稀释并定容至浓度为0.03 mg/mL、0.09 mg/mL、0.15 mg/mL,每个浓度各5份,在“2.1.1”项色谱条件下进样分析,三种浓度的加样回收率分别为97.9%、98.5%、98.9%(n=5),RSD分别为1.18%、0.89%、1.43%,表明该方法的准确度良好[8]。
2.3 葡聚糖凝胶微柱法方法学研究
2.3.1 葡聚糖凝胶微柱的制备
称取葡聚糖凝胶(SephadexG-50)适量,用PBS(pH 7.0)缓冲液溶胀24 h后,取5 mL注射器去掉内芯,底部垫入合适圆形滤纸垫片,将溶胀充分的SephadexG-50缓慢填入其中,排除气泡,以PBS缓冲溶液平衡1个柱体积,1000 r/min离心1 min,重复平衡、离心三次,得到高度约2 cm的凝胶微柱[9~11]。
2.3.2 离心力对空白脂质体过柱率的影响
吸取0.2mL blank-Gal-Lips,缓慢加到凝胶微柱上,静置吸附5 min后,加入0.5 mL PBS缓冲液,以不同的离心力(600 r/min、800 r/min、1000 r/min、2000 r/min)离心1 min,收集洗脱液,连续重复操作10次,合并洗脱液,加1 mL甲醇破乳后,PBS缓冲液定容至10 mL,于282 nm处测定吸光度A1,另取blank-Gal-Lips 0.2 mL,用PBS缓冲液稀释到5 mL,加1 mL甲醇破乳后,再用PBS缓冲液定容至10 mL,测定吸光度A0,计算blank-Gal-Lips的过柱率(过柱率=A1/A0×100%)。结果不同离心力下的blank-Gal-Lips过柱率分别为65.21%±2.35%、82.31%±1.82%、97.54%±1.16%、96.18%±0.98%(n=3),说明离心力过小,吸附在凝胶上的脂质体未能完全洗脱下来,离心力过大,会破坏凝胶内部结构,且洗脱液流出过快,洗脱不充分,所以选择离心力为1000 r/min。
2.3.3 离心时间对空白脂质体过柱率的影响
吸取0.2 mL blank-Gal-Lips,缓慢加到凝胶微柱上,静置吸附5 min后,加入0.5 mL PBS缓冲液,以1000 r/min离心不同时间(1 min、3 min、5 min),收集洗脱液,其余按“2.3.2”项方法测定blank-Gal-Lips的过柱率,结果不同离心时间的blank-Gal-Lips过柱率分别为98.21%±1.92%、97.45%±2.57%、98.52%±0.83%(n=3),说明离心时间5 min之内对脂质体的过柱率影响甚小,离心时间过长,微柱内部温度过高,会降低脂质体的稳定性,同时,会造成凝胶内部脱水而发生键的断裂,且1 min时可将98%的blank-Gal-Lips洗脱下来,所以选择离心时间为1 min。
2.3.4 脂质体上样量对空白脂质体过柱率的影响
吸取不同量(0.1 mL、0.2 mL、0.3 mL)blank-Gal-Lips,缓慢加到凝胶微柱上,静置吸附5 min后,加入0.5 mL PBS缓冲液,以1000 r/min离心1 min,收集洗脱液,其余按“2.3.2”项方法测定blank-Gal-Lips的过柱率,结果不同上样量的blank-Gal-Lips过柱率分别为97.93%±2.82%、98.35%±3.21%、98.16%±1.77%(n=3),说明当上样量大于0.2 mL,洗脱率不再增加,凝胶微柱对blank-Gal-Lips的吸附已饱和,故选择上样量为0.2 mL。
2.3.5 凝胶微柱对blank-Gal-Lips的吸附作用
在对离心力、离心时间、上样量优化的条件下,精密吸取blank-Gal-Lips 0.2 mL,缓慢加到凝胶微柱上,300 r/min离心3 min使blank-Gal-Lips进入微柱内,1000 r/min离心1 min,收集洗脱液。精密量取PBS缓冲液0.5 mL缓缓加于柱上,1000 r/min离心1 min,收集洗脱液,其余按“2.3.2”项方法测定,在282 nm下测其吸光度R过柱后。另取blank-Gal-Lips 0.2 mL,用PBS缓冲液稀释到5 mL,加1 mL甲醇破乳后,再用PBS缓冲液定容至10 mL,测定吸光度R过柱前,以回收率%=R1/R0×100%计算凝胶微柱对blank-Gal-Lips的平均回收率,结果为99.25%,RSD为1.20%(n=3),说明制备的凝胶微柱对blank-Gal-Lips几乎无吸附。
2.3.6 凝胶微柱对游离NCTD的吸附作用
用NCTD原料药配制浓度为1、1.5、2 mg/mL的溶液,分别取0.2 mL加到凝胶微柱上端,静置吸附5 min,加入0.5 mL PBS缓冲液,以1000 r/min离心1 min,收集洗脱液,连续重复操作10次,合并洗脱液,加1 mL甲醇破乳后,PBS缓冲液定容至5 mL,按“2.1.1”项色谱条件下进样分析,记录峰面积为A过柱后。另取同等浓度的NCTD溶液,分别取0.2 mL,用PBS缓冲液定容至5 mL,HPLC测定峰面积A未过柱,按吸附率%=(A未过柱-A过柱后)/ A未过柱×100%计算凝胶微柱对游离NCTD的吸附率为99.53%、100.13%、99.26%,RSD分别为0.12%、0.08%、0.17%(n=3)。说明制备的凝胶微柱在洗脱次数为10次时能对游离NCTD有效吸附。
2.4 包封率测定方法学验证
2.4.1 洗脱曲线
精密吸取Gal-NCTD-Lips混悬液0.2 mL加到凝胶微柱上端,静置吸附5 min,加入0.5 mL PBS缓冲液洗脱,以1000 r/min离心1 min,分别收集每次的洗脱液,加1 mL甲醇破乳后,PBS缓冲液定容至5 mL,按“2.1.1”项色谱条件下进样分析,记录峰面积,绘制峰面积与洗脱次数的洗脱曲线,见图2。可以看出1~7次洗脱出的是Gal-NCTD-Lips,从10~16次洗脱出游离NCTD,说明采用凝胶微柱的方法可以较好地实现脂质体与游离药物的分离,脂质体洗脱次数确定为7次。

图2 Gal-NCTD-Lips 与游离药物的洗脱曲线
2.4.2 柱回收率实验
在空白脂质体溶液1 mL中加入NCTD配制成浓度为1.6 mg/mL、2.0 mg/mL、2.4 mg/mL的NCTD溶液各3份,分别取0.2 mL于凝胶微柱上,按“2.4.1”项方法洗脱,收集7次洗脱液,按“2.2.1”色谱条件进样分析,计算加样回收率,结果见表1。
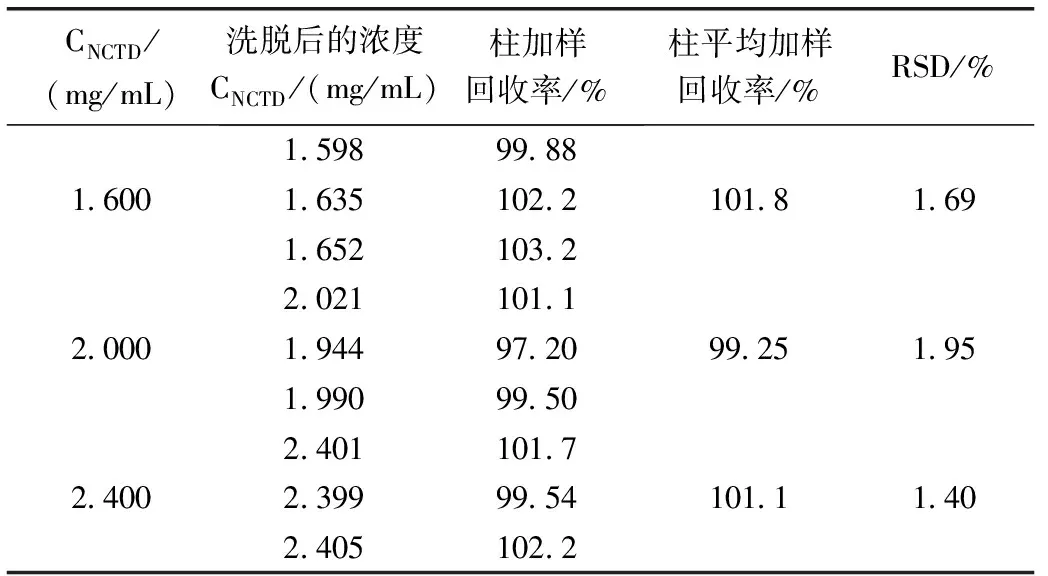
表1 凝胶微柱加样回收率测定结果(n=9)
2.4.3 包封率的测定
取不同批次的Gal-NCTD-Lips五批,分别精密量取0.2 mL于凝胶微柱的上端,静置吸附5 min,加入0.5 mL PBS缓冲液洗脱,以1000 r/min离心1 min,收集7次的洗脱液,合并洗脱液,加1 mL甲醇破乳后,PBS缓冲液定容至5 mL,按“2.1.1”项色谱条件下进样分析,测定Gal-NCTD-Lips中包载的NCTD药物浓度C1。同时分别量取各批次的Gal-NCTD-Lips 0.2 mL,用1 mL甲醇破乳后,PBS缓冲液定容至5 mL,在同样色谱条件下测定NCTD的浓度C0,计算Gal-NCTD-Lips的包封率(EE%=C1/C0×100%),结果Gal-NCTD-Lips的平均包封率为51.06%±2.65%(n=5)。
3 结 论
包封率是评价脂质体质量的重要指标之一,常用的测定方法有葡聚糖凝胶柱层析法、超滤离心法、透析法,微柱离心法等。实验中我们考察了以上几种方法,结果,葡聚糖凝胶柱层析法需要使用大量PBS溶液进行洗脱,洗脱样品所需溶液的体积较大而使得Gal-NCTD-Lips测定结果偏低;超滤离心法适合Gal-NCTD-Lips包封率的测定,但需使用特殊超滤管,实验成本较高,不易大量使用;透析法操作简单,但是受药物扩散速率的影响,重复性较差,且耗时过长;微柱离心法是以少量的葡聚糖凝胶自制层析柱,结合葡聚糖凝胶特有的分子筛功能,能实现脂质体和药物的有效分离,同时采用离心法可减少洗脱的时间,实验中通过回收率考察,说明凝胶微柱法准确,快速,可用于Gal-NCTD-Lips包封率的测定。
实验中还考察了水和PBS缓冲液(pH 7.0)作为洗脱液的洗脱效果,结果发现PBS缓冲液的洗脱效果优于水的,可能是Gal-NCTD-Lips在制备过程中是以PBS缓冲液(pH 7.0)为水化溶剂,选用其为洗脱液可以避免脂质体膜内外渗透压的改变而引起脂质体的破裂,同时NCTD在PBS缓冲液但由于制备脂质体时所用PBS缓冲液是稀释5倍后的,洗脱液仍需选择稀释5倍后的PBS缓冲液(pH 7.0)。

