超声造影评价大鼠失血性休克肾皮质血流灌注
胡经纬,曾 祯,李明星*,李 璇,胡卫中
(1.西南医科大学附属医院超声医学科,四川 泸州 646000;2.四川省医学科学院 四川省人民医院心血管超声及心功能科,四川 成都 610072)
失血性休克(hemorrhagic shock, HS)指短时间内有效循环血量大量丢失或大量减少,组织器官血液灌注不足。肾脏作为少有侧支循环的高灌注脏器,依靠血流灌注压力和血液流动来维持滤过与重吸收之间的平衡,HS时血压过低超过肾脏自我调节能力可致肾小球滤过率(glomerular filtration rate, GFR)降低,肾功能受损。肾脏微循环灌注改变在急性肾损伤(acute kidney injury, AKI)发展中扮演重要角色。早期有效监测肾脏血流动力学变化,能早期诊断、及早干预、最大程度减轻肾损伤、促进肾功能恢复。本研究超声造影(contrast-enhanced ultrasound, CEUS)运用定量分析技术实时观察大鼠肾脏血流灌注、特别是肾皮质的微循环灌注变化,以期为临床早期、有效干预和治疗HS提供依据。
1 材料与方法
1.1 实验动物及分组 健康成年雄性SD大鼠24只[体质量(300±50)g,成都达硕实验动物有限公司提供],于恒温动物房(25℃)适应性喂养3天,自由摄入食水,术前6 h停饲、停水。随机将大鼠分为假手术组(Sham组)、轻度HS组(T1组)、中度HS组(T2组)及重度HS组(T3组),每组6只。
1.2 HS模型建立 腹腔注射肝素钠溶液(10 mg/kg体质量)进行全身肝素化,15 min后以10%水合氯醛行腹腔麻醉(2 ml/kg体质量,规格10 ml:1 g),备皮后保定于手术台上。于颈部偏左侧做一纵形切口,钝性分离左侧颈总动脉,置入24G留置针并固定。连通多导生物转化器并实时监测平均动脉压(mean arterial pressure, MAP),记为MAP0。同法于左侧股总动脉及静脉内分别置入24G留置针,经左侧股总动脉迅速放血,MAP下降达到70% MAP0时记为MAP1。经左侧股总动脉少量放血,或左侧股总静脉少量补液(晶体∶胶体=2∶1),维持MAP160 min,标志T1组模型建造成功。以同样方法制备T2组(50%MAP0)、T3组(40%MAP0)动物模型。对Sham组仅行全身肝素化、腹腔麻醉、血管插管及监测MAP0操作。
1.3 仪器与方法 采用Siemens ACUSON S3000超声诊断仪,9L-4变频线阵探头,参数:深度3.5 cm、频率4.0 MHz、机械指数0.05。以SonoVue(上海Bracco公司)为超声造影剂,将5.0 ml生理盐水注入瓶内用力振荡,配置成六氟化硫微泡混悬液。模型建造成功后稳定10 min,行右肾CEUS。经左侧股总静脉置管团注造影剂(0.4 ml/kg体质量),随后迅速注入0.4 ml生理盐水进行冲管。采集右肾最大纵切面CEUS图像,连续观察3 min 。使用机载内置分析软件(auto tracking contrast quantification, ACQ)进行定量分析,ROI设置为0.05 mm2圆形取样框,放置在同一深度、与声束垂直的肾皮质区外层。绘制时间-强度曲线(time-intensity curve, TIC),经软件计算得出相关定量参数,包括峰值浓度(Peak)、达峰时间(time to peak, TTP)、AUC及平均通过时间(mean transition time, MTT),并进行组间分析。
1.4 肾功能检查 造影结束后经左侧股总静脉取静脉血2~3 ml,室温离心(4 000 r/min,5 min)后取上层血清,检测大鼠肾功血肌酐(creatinine, Crea)及尿素氮(urea nitrogen, Urea)。
1.5 病理学检查 经左侧股总静脉注入空气3~4 ml处死大鼠,迅速取大鼠右肾组织固定于10%中性甲醛,脱水24 h以上,石蜡包埋切片行HE染色,镜下观察病理改变。
1.6 统计学分析 采用SPSS 23.0统计分析软件。各参数以±s表示,组间比较使用单因素方差分析,两两比较使用LSD法。运用Pearson相关分析评价CEUS各指标与大鼠生化指标之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 CEUS表现 Sham组(图1A)可见造影剂迅速充盈到肾脏血管内,按肾动脉、肾皮质、肾髓质依次充盈增强,呈明显“树枝状”分布;达到TTP后造影剂开始缓慢廓清,按肾髓质、肾皮质、肾静脉顺序退出肾脏。T1组(图1B)造影剂进入肾脏时间较Sham组稍延迟。T2(图1C)、T3组(图1D)可见造影剂进入肾脏速度明显减慢,肾皮质增强明亮度较T1组明显降低;T3组造影增强灰暗,肾内动脉分支“树枝状”明显变细。
2.2 各组TIC定量分析比较 T1组TTP、AUC、MTT较Sham组增加(P均<0.05);T2组TTP、MTT较Sham组和T1组增加(P均<0.05),AUC较Sham组增加(P<0.05);T3组TTP、AUC、MTT较其余3组增加(P均<0.05),Peak较Sham组、T1组增加(P均<0.05)。见表1。
2.3 各组生化结果比较 Crea在Sham组、T1、T2和T3组依次升高,除外T1组与Sham组,其余各组间差异均有统计学意义(P均<0.05),T1组和T3组Urea较Sham组增加(P均<0.05)。见表2。
2.4 相关性分析 4组Crea与TTP、AUC、MTT 均呈显著正相关(r=0.789、0.790、0.800,P均<0.001)。
2.5 病理结果 大体观察,Sham组肾脏红润,T1肾脏较Sham组肉眼观无明显改变;T2组切面肾皮质较Sham组苍白,髓质颜色加深;T3组肾脏水肿黑红色,切
表1 各组大鼠肾皮质TIC曲线参数比较(±s)

表1 各组大鼠肾皮质TIC曲线参数比较(±s)
组别Peak(dB)TTP(s)AUC(dB·s)MTT(s)Sham组47.83±3.3515.71±1.972 578.83±87.5939.20±4.01T1组48.87±2.0925.50±5.54∗4 051.49±714.54∗61.01±10.13∗T2组51.52±8.1233.51±3.56∗#5 442.08±1292.99∗76.84±9.48∗#T3组59.02±2.30∗#41.94±3.46∗#▲9 920.77±582.24∗#▲122.34±8.07∗#▲F值5.74032.63368.17077.126P值<0.05<0.001<0.001<0.001
注:*:与Sham组比较,P<0.05;#:与T1组比较,P<0.05;▲与T2组比较,P<0.05

图1 各组大鼠超声造影图 A.Sham组; B.T1组; C.T2组; D.T3组

图2 各组大鼠肾脏病理图(HE,×200) A.Sham组; B.T1 组; C.T2 组; D.T3 组
面皮质肿胀、苍白更为严重,髓质呈暗红色。光镜下Sham组(图2A)肾小管、肾小球结构未见明显病理学改变;T1、T2、T3组肾小球未见明显收缩、硬化改变,肾小管内未见明显铸型结构。T1组(图2B)肾小管上皮细胞肿胀不明显,未见明显炎性细胞浸润;T2组(图2C)肾小管上皮细胞肿胀较T1组明显,间质内偶见少量炎性细胞浸润;T3组(图2D)肾小管上皮细胞明显肿胀,部分呈“气球样”改变,可见炎性细胞浸润。T1、T2、T3组均未见明显细胞凋亡。
表2 各组大鼠Urea、Crea比较(±s)
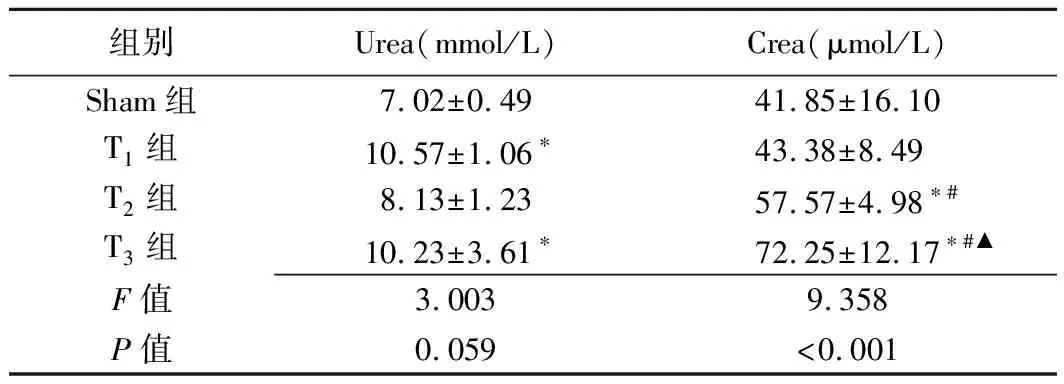
表2 各组大鼠Urea、Crea比较(±s)
组别Urea(mmol/L)Crea(μmol/L)Sham组7.02±0.4941.85±16.10T1组10.57±1.06∗43.38±8.49T2组8.13±1.2357.57±4.98∗#T3组10.23±3.61∗72.25±12.17∗#▲F值3.0039.358P值0.059<0.001
注:*:与Sham组比较,P<0.05;#:与T1组比较,P<0.05;▲:与T2组比较,P<0.05
3 讨论
HS是急诊和重症监护常见病症,机体有效循环血量大量丢失会迅速引起全身性低血压,引发机体组织器官低灌注。肾脏灌注量约占心排量的20%,HS时首先受到影响。肾脏结构复杂,功能涉及排泄代谢废物及对机体调节渗透压和酸碱平衡,很大程度上受肾脏血流灌注改变的影响;肾血流量(renal blood flow, RBF)90%供应肾皮质,准确测量肾皮质血流灌注变化可为评价肾功能改变提供依据[1-2]。
临床常用于评估肾脏血流灌注情况的影像学方法包括增强CT(contrast-enhanced computed tomography, CECT)、磁共振灌注成像(perfusion weighted imaging, PWI)、核素灌注成像(nuclear medicine imaging, NMI)及CEUS,但传统影像学方法用于肾病患者有其特定局限性和禁忌证[3]。部分肾功能不良患者无法耐受碘对比剂和钆对比剂的肾毒性;且CECT、NMI均有辐射,使其应用受限[4-5]。
CEUS可动态监测宏观血流和微循环变化[6]。超声造影剂微泡被限制在血池中,不渗入血管间质,也不被肾小球滤过和肾小管重吸收[7];其微泡直径1~5 μm,是理想的红细胞示踪剂,能进入几乎所有毛细血管,可使血管微结构可视化,达到监测毛细血管微循环水平血流动力学变化的目的;其惰性气体核心不被代谢,气泡溶解后数分钟内随呼吸排出,不通过肾脏排泄,无肾毒性。本实验建立大鼠HS模型,采用CEUS监测大鼠肾皮质微循环灌注变化,探讨以CEUS评估不同程度HS大鼠肾皮质血流灌注变化的可行性[8-9]。
本研究结果显示,随休克程度加重,TTP、MTT时间延长,AUC增加(P均<0.05),与罗志建等[10]、LI等[11]的结果一致。TTP指ROI内出现造影剂到达到峰值强度的时间,反映造影剂灌注速度;MTT是造影剂开始增强到峰值浓度下降一半的时间,反映其廓清速度。AUC为TIC下面积,反映一定时间内ROI内造影剂累积。发生休克时,全身性低血压导致炎性介质渗出,引起血管内皮活化、损伤,多种因素共同作用,最终导致肾皮质内微循环灌注降低,表现为灌注和廓清速度降低,TIC定向表现为TTP、MTT延长;释放的炎性细胞可吞噬造影剂微泡,导致造影剂廓清减慢,而被吞噬微泡仍保留声学活性,表现为AUC增加[12]。本研究中Peak值在Sham组、T1、T2和T3组依次升高,但仅T3组与Sham组、T3组与T1组差异有统计学意义(P均<0.05),可能因为Peak代表ROI内造影剂含量达到峰值时的浓度,为瞬间指标,无明显累积效应,不能很好地反映肾皮质微循环灌注变化。
肾脏最重要的功能之一是滤过和排泄血液中的含氮废物,Crea升高可作为肾功能下降的指标。本研究各HS组Crea值相比Sham组均升高,其中T1组与Sham组差异无统计学意义,提示随着休克程度加重,肾脏血流灌注下降,肾功能损伤进一步加重,与超声造影参数TTP、AUC、MTT的走向及统计学结果一致,证明CEUS能反映HS所致肾功能改变。既往研究[13]显示,Crea下降可在数小时至数日内发生。但Crea作为肾小球滤过率的替代标记物相对不准确,而CEUS有望通过监测肾皮质微循环灌注变化间接评估肾损伤。
本研究中采用TIC参数评估肾功能损伤程度,所获结果与生化指标Crea结果存在高度一致性,TTP、AUC、MTT与Crea均呈显著正相关,随缺血再灌注肾功能损伤程度增加而增高,而MTT与Crea相关性最高。
超声造影剂无肾毒性[8,14],可安全用于肾功能受损患者。CEUS具有实时性、便携性和可重复性,且能降低对金属和运动伪影的敏感性。利用CEUS可在数分钟内确定器官不同区域组织血流量,提供关于肾血流动力学及肾血流区域变化的信息。
本实验具有以下不足:①动物样本量相对较少;②基于麻醉并全身肝素化建造实验动物模型,与实际临床情况有所出入。
综上所述,CEUS各参数可为观察大鼠肾脏损伤早期肾皮质血流灌注变化提供可靠信息,TTP、AUC、MTT可作为评价早期肾损伤的敏感指标。

