Aβ25-35联合D-半乳糖诱导树鼩AD 模型的建立
郭玉倩 ,曾跃勤,吴 超,陆姜利,杨 艺,郑 红,梁 张
(1)昆明医科大学实验动物学部;2)分子临床研究院;3)科技处,云南昆明 650500)
阿尔茨海默病(Alzheimer's disease,AD)是常见的原发性老年性神经退行性疾病,是最常见的痴呆类型。临床表现主要为进行性记忆力下降、认知功能障碍、行为异常和人格失常等。我国每年新增大约30 万患者[1]。AD 患病率与年龄密切相关,年龄平均每增加6.1 岁,患病率升高1 倍;在85 岁以上老年人群中,AD 患病率可高达20%~30%。到2050 年,全球AD 患者将超过1 亿[2]。AD 不仅给患者带来巨大的痛苦,还给家庭和社会带来了沉重的精神压力和医疗、照料负担。由于发病原因不明确和发病机制复杂性,目前AD 治疗药物均不能逆转疾病进程[3]。因此,建立适宜的AD 动物模型有利于开展发病机制、药物研发和机理研究[4]。笔者以树鼩为研究对象,通过海马内注射Aβ25-35、皮下注射D-gal 和联合给药3 种方式建立AD 模型,旨在为AD 的研究提供理想的动物模型。
1 材料与方法
1.1 实验动物
24 只雄性树鼩来源于昆明医科大学实验动物学部,许可证:SCXK(滇)2015-0002);实验树鼩饲料、饲养笼均由昆明医科大学实验动物学部提供,动物自由饮水,单笼饲养。饲养室温度(22±2)℃,相对湿度50%~60%。
1.2 主要仪器
脑立体定位仪(成都仪器厂),水迷宫行为测试系统(成都泰盟公司),组织切片机、烤片机、包埋机(德国leica 公司),显微镜(日本尼康公司),恒温培养箱、冰箱(美国Thermo),粘附载玻片(福州迈新公司)。
1.3 主要试剂
Beta 淀粉样蛋白25-35、D-半乳糖(Sigma公司),兔抗鼠Aβ1-42一抗(Abcam 公司),PBS磷酸缓冲液(Solarbio 公司),柠檬酸钠、多聚甲醛、快捷型山羊抗兔/小鼠IgG(福州迈新公司),中性树胶(南京建成公司)。
1.4 方法
1.4.1 Aβ25-35 的孵育参照Zheng 等[5]方法,用生理盐水将Aβ25-35(5 mg/mL)配制成溶液,放置在37℃恒温培养箱孵育7 d,用于树鼩海马注射。
1.4.2 动物分组及处理24 只雄性树鼩,体重135~145 g,随机分为对照组(CT),D-半乳糖组(D),Aβ 组(A),D-半乳糖联合Aβ25-35(D+A)组。用3%戊巴比妥(30 mg/kg)腹腔注射麻醉树鼩。Aβ25-35在立体定仪下向A 组和D+A 组海马中1 次性注射4 μL 的Aβ25-35(5 mg/mL);CT 和D 组注射等量生理盐水,术后所有树鼩肌肉注射青霉素[22 000 U/(kg·d)]连续3 d,预防感染。向D 组和D+A 组皮下注射D-半乳糖[125 mg/(kg·d)],对照组和Aβ25-35组给予等量生理盐水,连续8 周。
1.4.3 Morris 水迷宫检测(MWM)在第9 周进行,每天早上9:00 点开始测试。泳池直径1.6 m,水温(21±1)℃。第1 天为搜索平台的适应训练,水迷宫设置为可见平台,将树鼩面朝向池壁,距水面高度10 cm 放下,30 s 后若树鼩没有找到平台,将其引导上平台。在平台停留10 s 后,把树鼩取出、充分擦干身体。第2~6 天进行定位巡航实验,设置为距水面下1 cm 的隐藏平台,实验操作同第1 天,记录树鼩找到平台的时间,如30 s 未找到平台,逃避潜伏期记为30 s。第7 天进行空间搜索实验,撤去平台,记录树鼩通过原平台位置的次数、运动轨迹。
1.4.4 免疫组化检测水迷宫实验结束后,心脏采血处死树鼩,生理盐水和多聚甲醛灌注固定树鼩脑组织,取大脑制成5 μm 石蜡切片,经脱蜡、柠檬酸钠修复、封闭、兔抗鼠Aβ1-42一抗孵育、二抗孵育、DAP 显色、苏木素染色、乙醇梯度脱水、二甲苯透明后,封片。显微镜下观察大脑皮层和海马细胞形态和Aβ1-42的表达。
1.5 统计学处理
实验结果得到的数据均采用SPSS 进行处理分析,树鼩脑片免疫组化染色结果采用image J 进行定量,所有数据以平均数±标准差表示,组间比较使用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 树鼩Morris 水迷宫
定位巡航实验中,从第4 天至第6 天,D-半乳糖组、Aβ25-35组和D-半乳糖联合Aβ25-35(D+A)组逃避潜伏期延长,与对照组(P<0.01;图1a)具有差异极显著性;在第6 天,D+A 组(P<0.05;图1A)逃避潜伏期显著长于D-半乳糖组、Aβ25-35组。在空间搜索实验中,结果显示相对于对照组相比(P<0.05;图1A),D、A 和D+A组穿越平台次数均显著性降低;D+A 组(P<0.05;图1A)穿越平台次数显著低于单因素诱导的D-半乳糖组和Aβ25-35组。
2.2 树鼩海马与皮层中Aβ1-42 的表达
免疫组化结果显示,在树鼩海马中,对照组神经元形态完整,胞质和细胞核结构清晰,细胞排列紧密。D 组、A 组和D+A 组细胞排列相对松散、核固缩,胞质内呈现不同程度棕色。对阳性面积定量分析显示,D 组、A 组和D+A 组显著高于对照组(P<0.05;图1B,Hip),而D+A 组Aβ1-42的表达最多,显著高于D 组和A 组。树鼩的大脑皮层中也有类似的结果,3 个处理组细胞固缩明显,胞质内呈现不同程度棕色。定量分析显示,D 组、A 组和D+A 组显著高于对照组(P<0.05;图1B,Cor),而D+A 组(P<0.05)Aβ1-42的表达显著高于D 组和A 组。
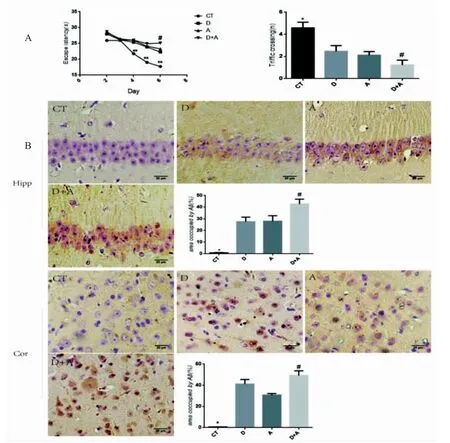
图1 树鼩不同处理水迷宫实验和大脑Aβ1-42表达分布情况(n=6)Fig.1 Morris water maze and Aβ1-42IHC(n=6)
3 讨论
为了探究AD 的机制和潜在治疗药物,建立合适的动物模型是关键的一步。理想的AD 动物模型将为解决药物靶点不明、临床前后药效学不一致等问题提供有力工具[6]。大小鼠等啮齿类动物是最常用的AD 模型,因其繁殖力强、利于大规模饲养、成本低和易于操作等优点广泛用于AD 动物模型研究。但由于与人类亲缘关系较远,仅能模拟部分病理学特征[7]。其他的动物模型,如犬和果蝇等也有局限性[8]。目前灵长类动物被广泛认为是最合适的AD 动物模型,但由于价格昂贵,饲养的经济和空间成本高、实验周期长等缺点,尚难以广泛应用。因此具有类似灵长类动物特征同时体型较小的动物是理想的AD 候选动物模型。通过全基因组测序和分子基础研究证实,攀鼩目动物树鼩为灵长目的近亲[9],具有较大的脑重比和复杂的行为特征,适合应用于神经退行性疾病研究[10-11]。与非人灵长类动物相比,树鼩体型小,成年体重平均150 g 左右,饲养的空间和经济成本低,繁殖周期短[12]。有研究已经证实,通过将孵育的Aβ1-40注射到大脑,引起树鼩认知功能障碍[13]并且临床治疗药物多奈哌齐可缓解树鼩症状[5]。D-半乳糖是一种动物体内的还原糖,皮下注射可以模拟自然衰老过程并诱导行为改变[14],同时还可促进认知功能障碍、神经元损伤、线粒体功能丧失和胆碱能系统异常[15-16]。但尚未见复合因素诱导树鼩AD 模型的报道。
AD 动物模型包括单因素诱导和复合因素诱导。复合因素AD 动物模型是使用2 种或者2 种以上的因子联合作用,以更全面地模拟AD 的病理改变。AD 复合模型的构建通常使用2 种诱导方法,一种为短暂性、局部性的诱导因子,常采用脑内注射Aβ[17]、链脲霉素等;另一种诱导方式通常为相对长期性、机体整体性的作用,与AD 时程长、病情严重的特点相符合,例如D-半乳糖注射衰老模型、高胆固醇饮食模型、丙烯醛诱导模型、金属离子紊乱模型[18]。AD 复合模型的优点是能研究多种因素在AD 发展中的作用以及因素间的相互作用关系。Morimoto 等[19]在大鼠脑内注射β 淀粉样蛋白25-35 或1-40 片段联合鹅膏蕈氨酸,观察到海马区神经元大量丢失和Aβ 沉积,胶质细胞活化。Laurent 等[20]用β 淀粉样蛋白联合2 价铁离子导致氧化应激反应,淀粉样蛋白沉积和神经细胞凋亡增加、记忆能力降低。
在AD 病理学中,认知功能障碍是典型的行为学变化[21-22]。脑内Aβ1-42是构成老年斑的核心病理学分子[23-24]。本实验以雄性树鼩为研究对象,通过海马内注射Aβ25-35、皮下注射D-gal 和联合给药三种方式,发现D-半乳糖、Aβ25-35和D+A 组树鼩均出现认知功能损伤,观察到大脑皮层和海马中Aβ1-42蛋白的表达增加。表明D-半乳糖、Aβ25-35单独和联合作用均能诱导树鼩AD 样病理改变。相对于单因子诱导,D-半乳糖和Aβ25-35复合因素诱导,树鼩认知障碍和分子病理学特征更显著,是更为合适的树鼩AD 造模方式,本实验进一步优化和丰富了树鼩AD 模型。

