ClC-3氯通道在二甲双胍抑制鼻咽癌细胞周期进程中的作用*
叶 东, 李坤钰, 蔡晓萍, 陈绮婷, 曾 志, 余小慧
(广东药科大学 1生命科学与生物制药学院, 2临床医学院, 广东 广州 510006; 3暨南大学基础医学院, 广东 广州 510632)
鼻咽癌是在我国南方及东南亚地区具有较高发病率的一种恶性肿瘤,在我国尤其好发于广东、广西、湖南等地。由于鼻咽部比较隐蔽,多数鼻咽癌患者被诊断时已处于中晚期,恶性程度比较高且具有极强的侵袭能力,严重影响人民群众的健康。二甲双胍是目前全球应用最广泛的口服降糖药之一,但近年的研究表明,其除了具有传统的降血糖作用外,还具有抑制胃癌[1]、肺癌[2]和卵巢癌[3]等肿瘤发生和发展的作用,其在肿瘤的预防和治疗中可能发挥重要作用。因此,探究二甲双胍对鼻咽癌周期进程的影响及作用机制将会为临床鼻咽癌的治疗提供相关参考。
二甲双胍的抗肿瘤作用机制尚不明确。加拿大研究团队通过“同源物动力学”蛋白片段互补分析技术发现二甲双胍至少能影响包括相关转运功能蛋白在内的745种蛋白的活性[4]。这提示二甲双胍的抗肿瘤作用可能与离子通道转运功能相关。正常的离子通道结构和功能是细胞进行生命活动的基础。氯离子通道普遍分布于各类生物体的细胞中,其中ClC-3氯通道(又称氯离子转运体ClC-3或氯离子通道蛋白3,基因符号为CLCN3)作为容积敏感性氯电流通道蛋白广泛表达[5-6]。研究表明ClC-3氯通道不仅仅只发挥离子通道的作用,还参与细胞周期调控等很多重要的生理活动[7-9]。
我们前期研究显示敲减ClC-3氯通道基因表达可使细胞停滞于G0/G1期进而抑制鼻咽癌细胞周期进程,提示ClC-3氯通道在鼻咽癌细胞周期进程调控中起着重要作用[10]。而二甲双胍对鼻咽癌细胞的作用是否与ClC-3氯通道有关尚未见报道。据此,本研究以低分化鼻咽癌CNE-2Z细胞为研究对象,采用流式细胞术、Western blot、膜片钳等实验方法,探讨二甲双胍对鼻咽癌细胞周期进程的影响以及ClC-3氯离通道在其中的作用,以期为临床治疗鼻咽癌提供参考。
材 料 和 方 法
1 细胞
本研究中所用到的人低分化鼻咽癌CNE-2Z细胞由广东医科大学病理教研室惠赠。
2 主要试剂
二甲双胍购于上海碧云天公司;RPMI-1640细胞培养基、胎牛血清及质粒转染专用培养液Opti-MEMI购于Gibco;CCK-8试剂盒购自Dojindo;抗ClC-3抗体购自Abcam;抗GAPDH抗体购自博士德生物科技有限公司; HRP标记的山羊抗兔 II 抗与山羊抗鼠 II 抗购自ProteinTech Group;质粒转染试剂LipofectamineTM3000购自Invitrogen。
3 主要方法
3.1鼻咽癌CNE-2Z细胞的培养 人低分化鼻咽癌CNE-2Z细胞用含有10%胎牛血清、1×105U/L青霉素和1×105g/L链霉素的RPMI-1640培养液,在含5% CO2、37 ℃培养箱中培养,每48 h进行1次传代。
3.2ClC-3氯通道基因高表达质粒pEZ-M03-ClC-3转染鼻咽癌CNE-2Z细胞 常规细胞培养方法培养CNE-2Z细胞;转染前1天将对数生长期的细胞接种于6孔板中,并用不含抗生素的培养液培养细胞;当细胞生长融合度达到50%~60%时进行细胞转染;细胞转染前各用100 μL Opti-MEMI培养液稀释pEZ-M03-ClC-3质粒和转染试剂LipofectamineTM3000,将2者混匀成转染复合体,在室温下,静置5~10 min;用无血清培养液将孔板中的细胞洗2~3次,并在每孔中加2 mL培养液;将以上制得的200 μL转染复合体加到培养孔板中进行瞬时转染,在正常培养条件下继续培养。除pEZ-M03-ClC-3转染组外,另外设置pEZ-M03空质粒对照组。
3.3CCK-8法检测细胞活力 取96孔板,设置6组,每组设置5个复孔。细胞种板后将96孔板置于含5% CO2、37 ℃的恒温细胞培养箱中培养12 h使细胞贴壁后,每孔加入100 μL含有不同浓度的二甲双胍培养液,浓度依次为0、0.625、1.25、2.5、5、10和20 mmol/L,加药后继续放置于含5% CO2、37 ℃的恒温细胞培养箱中培养48 h,每孔加入100 μL含有10% CCK-8的培养液,在含5% CO2、37 ℃的恒温细胞培养箱中避光孵育30 min后取出,在酶标仪上测定450 nm波长处吸光度(A)值。
3.4流式细胞术检测细胞周期分布 收集6孔培养板各孔的原始培养液作好标记。再用0.25%胰酶消化细胞,制成细胞悬液,分别收集细胞于含有原培养液的15 mL离心管中,常温下1 000 r/min 离心5 min,小心弃掉上清液后于离心管中加入1 mL预冷过的PBS缓冲液洗涤细胞,将细胞依次分装于1.5 mL EP管中,然后在低速冷冻离心机中4 ℃、1 000 r/min 离心5 min,弃掉上清液并加入1 mL预冷过的75%冰乙醇固定细胞,轻柔吹打均匀,放在4 ℃冰箱中保存过夜。用细胞周期检测试剂盒处理样品。将样品在低速冷冻离心机中4 ℃、1 000 r/min离心5 min,弃上清液。再用1 mL PBS缓冲液洗涤细胞,同样在低速冷冻离心机中4 ℃、1 000 r/min离心5 min,小心弃去上清液。往样品中加入100 μL RNase A 37 ℃水浴孵育30 min,再加入400 μL PI染料染色均匀,4 ℃避光30 min。用流式细胞仪测定细胞中DNA含量,用软件分析各时相细胞百分率。
3.5全细胞膜片钳技术记录细胞氯电流 按照常规细胞培养方法培养CNE-2Z细胞,消化后轻轻吹打制成单个细胞悬液;将细胞悬液滴到已消毒且直径为22 mm的圆形玻片上(100~200 μL/片),放置培养皿内,并在37 ℃培养箱内培养0.5~1 h,即等到细胞贴壁后方可开始后面的实验;拉制玻璃微电极;电镀电极银丝;充灌微电极内液;形成高阻抗封接,此时便可得到细胞贴附式膜片钳模式;建立记录系统;测定细胞膜电容;全细胞记录形成、测定电容之后,继续用等渗灌流液灌流,记录全细胞氯电流;当此氯电流达到峰值并趋于平稳后,改用高渗灌流液进行灌流,直到氯电流达到峰值并趋于平稳(20~30 min);再换低渗灌流液,待到最小值并趋于平稳(5~10 min),记录氯电流。
3.6Western blot检测ClC-3蛋白的表达 使用6孔培养板进行CNE-2Z细胞种板待贴壁后,加入10 mmol/L浓度的二甲双胍,同时设置不加药空白对照组。放置于5% CO2、37 ℃的恒温细胞培养箱中培养48 h后,收集细胞总蛋白并进行BCA蛋白定量,然后95 ℃加热3~5 min进行变性;用10%的SDS- PAGE进行蛋白分离后采用半干法进行转膜;5%脱脂奶粉室温下孵育封闭1~1.5 h后加入用抗体稀释液稀释的Ⅰ抗4 ℃孵育过夜;用TBST漂洗,每次5~10 min,洗涤3次;加入HRP标记的Ⅱ抗,在室温下孵育1 h后用TBST漂洗 5~10 min,洗涤3次;采用ECL化学发光法进行显影;采用图像分析软件Image J进行图像分析。
4 统计学处理
实验数据用SPSS 16.0统计软件进行分析。实验均重复3次以上,计量资料用均数±标准差(mean±SD)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 二甲双胍抑制鼻咽癌细胞的活力
在CNE-2Z细胞加入含有浓度依次为0、0.625、
1.25、2.5、5、10和20 mmol/L的二甲双胍培养液培养48 h,通过CCK-8法检测鼻咽癌细胞的活力,结果显示5 mmol/L、10 mmol/L和20 mmol/L浓度的二甲双胍都可有效抑制鼻咽癌细胞的活力,见图1。结合不同浓度二甲双胍对鼻咽癌细胞活力的影响,我们在后续研究中将采用10 mmol/L的浓度作为二甲双胍的加药浓度。
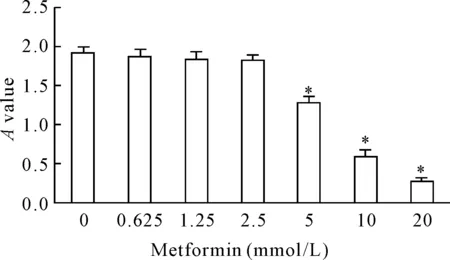
Figure 1.Metformin inhibited the viability of nasopharyngeal carcinoma cells at 5, 10 and 20 mmol/L. Mean±SD.n=3.*P<0.05vs0 mmol/L group.
图1 二甲双胍抑制鼻咽癌细胞的活力
2 二甲双胍阻抑鼻咽癌细胞周期停滞在G0/G1期
加入10 mmol/L的二甲双胍处理CNE-2Z细胞48 h后,收集细胞,通过流式细胞术分别检测二甲双胍加药组和空白对照组的细胞周期分布,结果如图2所示。正常培养48 h的空白对照组CNE-2Z细胞的G0/G1期细胞所占的百分率为(56.9±2.8)%,S期细胞所占的百分率为(32.1±1.7)%,G2/M期细胞所占的百分率为(11.0±1.1)%;而在二甲双胍加药组,G0/G1期细胞所占百分率显著提高到(69.9±3.0)%,S期细胞所占百分率下降到(23.5±1.5)%,G2/M期细胞所占百分率减少到(6.5±1.5)%。结果表明二甲双胍可阻抑鼻咽癌CNE-2Z细胞的周期,使其停滞在G0/G1期。

Figure 2.Arrest of CNE-2Z cells at G0/G1phases by metformin. The cell cycle distribution was analyzed by flow cytometry in the control cells and the cells treated with metformin at 10 mmol/L for 48 h. Mean±SD.n=3.*P<0.05vscontrol group.
图2 二甲双胍阻抑鼻咽癌细胞周期于G0/G1期
3 二甲双胍抑制鼻咽癌细胞的氯电流
在CNE-2Z细胞加入10 mmol/L的二甲双胍培养48 h后,收集细胞,通过膜片钳分别检测二甲双胍加药组和空白对照组的细胞在等渗溶液和低渗溶液中的全细胞氯电流,结果发现10 mmol/L的二甲双胍作用48 h后可使鼻咽癌细胞的氯电流明显降低,见图3,表明二甲双胍可阻抑鼻咽癌细胞的氯电流。
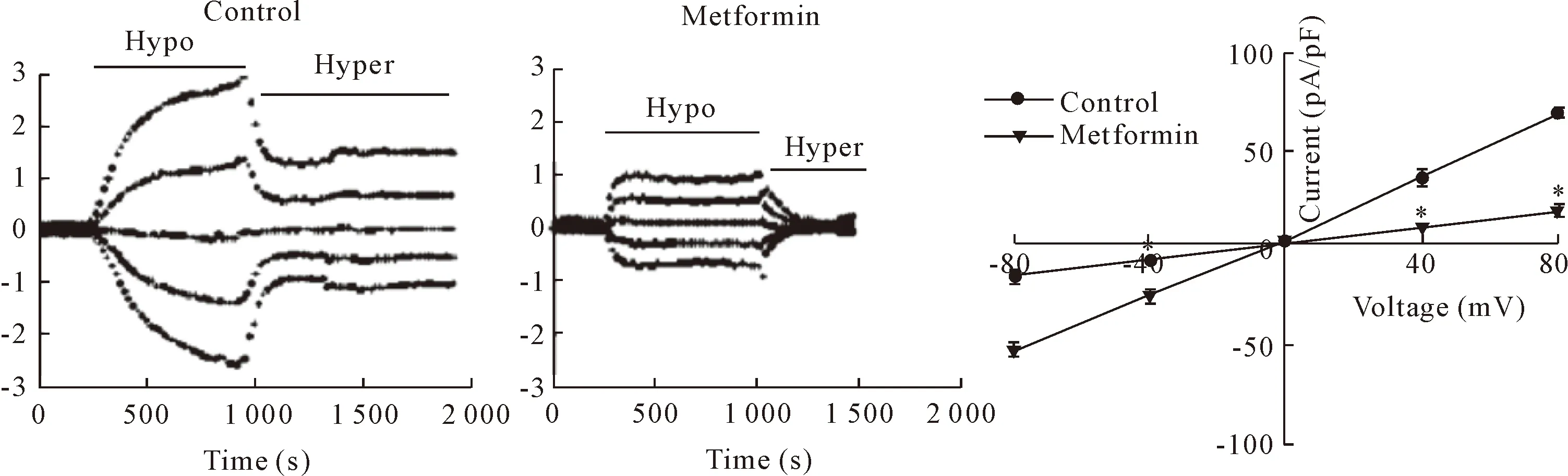
Figure 3.Inhibition of hypotonicity-activated Cl-currents by metformin in the CNE-2Z cells Hypo: hypotonic perfusion liquid; Hyper: hypertonic perfusion liquid. Mean±SD.n=3.*P<0.05vscontrol group.
图3 二甲双胍抑制鼻咽癌细胞氯电流
4 二甲双胍抑制ClC-3氯通道蛋白的表达
在CNE-2Z细胞加入10 mmol/L的二甲双胍培养48 h后,收集细胞提取总蛋白,通过Western blot检测各组细胞ClC-3氯通道蛋白的表达情况,结果发现10 mmol/L浓度的二甲双胍加药作用48 h后,鼻咽癌细胞ClC4-3氯通道蛋白的表达水平明显受到抑制,见图4。
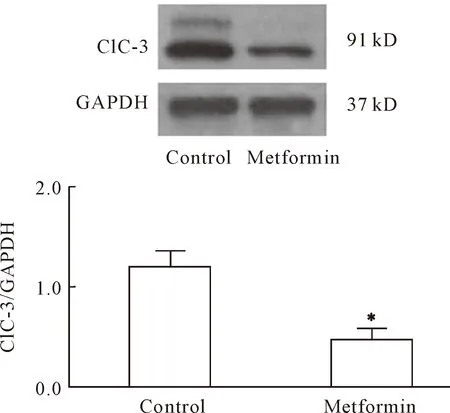
Figure 4.Inhibition of ClC-3 protein expression by metformin in the CNE-2Z cells. The protein levels of ClC-3 and the control GAPDH were determined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
图4 二甲双胍抑制ClC-3氯通道蛋白的表达
5 ClC-3氯通道蛋白高表达可逆转二甲双胍对CNE-2Z细胞周期分布的影响
构建质粒pEZ-M03-ClC-3并转染鼻咽癌CNE-2Z细胞后,Western blot检测显示质粒pEZ-M03-ClC-3转染后的鼻咽癌CNE-2Z细胞中ClC-3氯通道蛋白高表达,见图5。细胞周期检测结果显示,PEZ-MO3-ClC-3质粒转染组细胞的G0/G1期细胞比率明显低于二甲双胍单独处理组,表明ClC-3氯通道蛋白高表达可逆转二甲双胍对CNE-2Z细胞周期分布的影响,见图6。
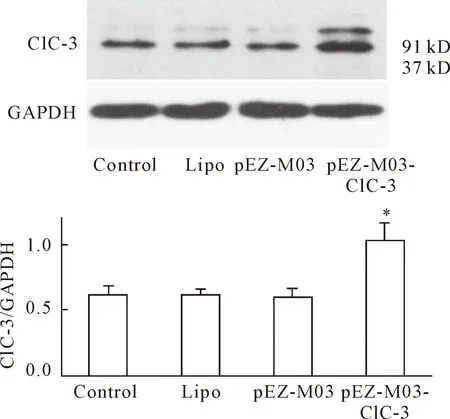
Figure 5.Over-expression of ClC-3 protein expression by pEZ-M03-ClC-3 plasmid transfection in the CNE-2Z cells. The protein levels of ClC-3 and the control GAPDH were determined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
图5 pEZ-M03-ClC-3质粒转染后,鼻咽癌CNE-2Z细胞ClC-3氯通道蛋白高表达
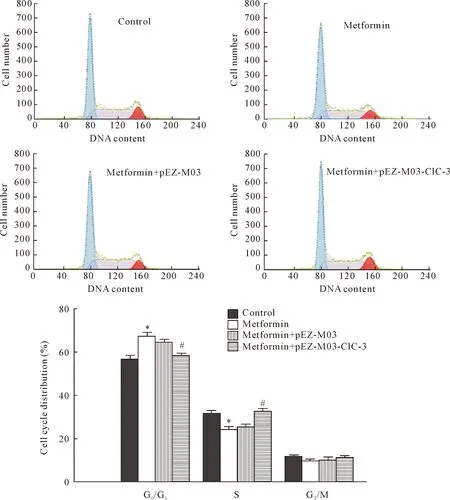
Figure 6.ClC-3 chloride channel protein over-expression reversed the effect of metformin on the cell cycle distribution of the CNE-2Z cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmetformin group.
图6ClC-3氯通道基因高表达可逆转二甲双胍对CNE-2Z细胞周期分布的影响
讨 论
在用二甲双胍治疗糖尿病的过程中,研究发现其具有抑制肿瘤的发生和发展的作用,但是二甲双胍的抗肿瘤作用机制尚不明确。最新研究显示二甲双胍能影响包括转运蛋白在内的745种蛋白的活性[4],其抗肿瘤作用可能与离子通道转运功能密不可分。氯通道在周期进程和周期分布的调节中发挥重要作用[11-13]。ClC-3氯离子通道蛋白的表达和分布是呈现细胞周期依赖性的[14],提示ClC-3可能参与细胞周期调控。在鼻咽癌细胞中,cyclin D1可调节ClC-3氯离子通道蛋白的表达与活性[15]。我们前期研究显示沉默ClC-3氯通道基因表达可使细胞停滞于G0/G1期进而抑制鼻咽癌周期进程,提示ClC-3氯通道在鼻咽癌周期进程和周期调控中起着重要作用[10]。
由此本研究提出3个关键科学问题:(1)二甲双胍是否可以抑制鼻咽癌细胞周期进程?(2)二甲双胍是否影响鼻咽癌细胞ClC-3氯通道功能和蛋白表达?(3)二甲双胍是否通过抑制ClC-3氯通道功能和蛋白的表达使细胞周期停滞?
首先,我们证明了二甲双胍是通过阻抑鼻咽癌细胞周期使其停滞在G0/G1期从而抑制鼻咽癌周期进程的:本研究结果显示二甲双胍使鼻咽癌细胞处在G0/G1期的细胞百分数明显高于非加药空白对照组,G0/G1期细胞增加,S期和G2/M期细胞减少,这提示二甲双胍是影响细胞周期从G0/G1期进入S期的重要因素之一。其次,我们证明了二甲双胍作用于鼻咽癌细胞后,可以影响鼻咽癌细胞的氯通道功能和蛋白表达:本研究结果显示二甲双胍抑制鼻咽癌细胞细胞氯电流和ClC-3氯通道蛋白的表达。最后,我们证明了二甲双胍是通过抑制ClC-3氯通道蛋白的表达使细胞周期停滞从而抑制鼻咽癌细胞周期进程的:本研究结果显示,二甲双胍组G0/G1期细胞所占的百分率明显高于非加药空白对照组,二甲双胍可阻抑鼻咽癌细胞周期使其停滞在G0/G1期;高表达ClC-3氯通道蛋白的质粒pEZ-M03-ClC-3转染鼻咽癌CNE-2Z细胞后,二甲双胍对鼻咽癌细胞周期的影响被逆转。我们前期的研究发现ClC-3氯通道蛋白可以通过影响相关周期蛋白cyclin D1、CDK4/CDK6、p21和p27的表达来调控细胞周期[10]。二甲双胍抑制鼻咽癌细胞ClC-3氯通道蛋白的表达后,可能影响了CDK4/CDK6、P21/27等相关周期蛋白的合成和活性,进而影响细胞周期从G0/G1期通过进入S期,具体的机制需要进一步验证。
综上所述,二甲双胍通过抑制鼻咽癌细胞ClC-3氯通道蛋白的表达和氯通道功能使细胞周期停滞于G0/G1期,从而抑制鼻咽癌细胞的周期进程

