5-吡唑甲酰胺类衍生物的设计、合成与生物活性
李康明,李延赛,易阳杰,徐雷涛,叶 姣,欧晓明,李建明,胡艾希
(1.湖南大学化学化工学院,长沙 410082; 2.湖南化工研究院,长沙 410007)
吡唑类衍生物是一类五元含氮杂环化合物[1],具有降血糖[2]、杀虫[3]、杀菌[4]和除草[5]等广谱生物活性.目前,已上市的吡唑酰胺类农药有唑虫酰胺[6]、氯虫苯甲酰胺[7]和溴氰虫酰胺[8]等杀虫剂,以及呋吡菌胺[9]、吡噻菌胺[10]和氟唑菌酰胺[11]等杀菌剂.王海洋等[12]发现含1,2,4-三氮唑的吡唑酰胺类化合物对小菜蛾和黏虫具有较好的活性.石玉军等[13]利用拼接原理设计合成的含吡啶结构的吡唑酰胺类化合物具有较好的杀虫活性.钟良坤等[14]合成了一系列含芳基异噁唑啉结构的吡唑-5-甲酰胺类化合物,在500 mg/L浓度下对黏虫具有杀虫活性,致死率均在80%以上.洪宇等[15]通过活性亚结构拼接的方法设计合成了一类含七氟异丙基结构的吡唑酰胺类衍生物,该类化合物对黏虫具有较好的杀虫活性,致死率为60%~100%.Yan等[16]基于生物电子等排及骨架跃迁原理,设计合成了具有良好杀菌活性的含噻唑结构的吡唑酰胺类化合物,其EC50值低至3.04 mg/L.
呋喃酚作为一个重要的生物活性片段,具有杀虫[17]、杀菌[18]和除草[19]等活性.噻唑类衍生物具有低毒和高效等优异特点,受到了广泛关注.Iwataki等[20]报道了氨基噻唑类化合物及其生物活性,在125 mg/L浓度下,部分化合物对黏虫、小菜蛾和螨虫的致死率为100%.张画轻等[21]报道了含噻唑环的邻甲酰氨基苯甲酰胺类衍生物及其杀虫活性,发现该类化合物对稻飞虱具有较好的杀虫活性,致死率≥74%,优于阳性对照氯虫苯甲酰胺.Ye等[22]发现N-(4-叔丁基)-5-(1,2,4-三唑-1-基)噻唑-2-基)丙酰胺在25 mg/L浓度下对立枯丝核病菌的抑制率>80%.沈芳等[23]发现4-(7-甲氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-基)-2-苄亚氨基噻唑具有较好的杀虫活性,对红蜘蛛的抑制率达到67.7%.
本文以5-吡唑甲酰胺为基本骨架,利用骨架跃迁及生物电子等排原理,将呋喃环与吡唑环以酰胺键的方式组合到同一个分子中,制得N-[4-(2,2-二甲基-2,3-二氢苯并呋喃-5-基)]-1-甲基-3-乙基-4-氯-5-吡唑甲酰胺(A1~A6); 在此基础上,插入噻唑环作为新的连接链,制得N-[4-(7-烷氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-基)噻唑-2-基]-5-吡唑甲酰胺(B1~B4); 然后,再扩充噻唑环上取代基范围,制得含噻唑取代的5-吡唑甲酰胺类化合物(C1~C13); 共设计合成了23个新的含噻唑或呋喃结构的5-吡唑酰胺类化合物; 并测试了其杀菌与杀虫活性; 同时,采用量子化学计算进一步探讨了相关化合物的活性.目标化合物的结构经核磁共振波谱(NMR)和高分辨质谱(HRMS)确认,设计思路及合成路线如Scheme 1所示.

A1: R=CH3; A2: R=Et; A3: R=n-Pr; A4: R=Bn; A5: R=CO-2,4-Cl2-C6H3.B1—B4,C5—C8,C11—C13: R1=H; B1,B3: R2= ; B2,B4: R2= ; C1: R1=COCH3,R2=CH3; C2: R1=C(NOCH3)CH3,R2=CH3; C3,C9: R1=CO2C2H5,R2=CH3; C4,C10,R1=1,2,4-triazol-yl; R2= n-Bu; C5: R2=2,4-Cl2-5F-C6H2; C6,C11: R2=CH3CH2CO2CH2; C7,C12: R2= ; C8,C13: R2= Scheme 1 Design strategy and general synthetic routes of the novel 5-pyrazole carboxamide derivatives
1 实验部分
1.1 试剂与仪器
二环己基碳二亚胺、1-羟基苯并三唑、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、N,N-二甲基甲酰胺及氯化亚砜均为分析纯(国药集团化学试剂有限公司); 1-甲基-3-乙基-4-氯-5-吡唑甲酸和3-溴-1-(3-氯吡啶-2-基)-5-吡唑甲酸(工业用品,纯度98%,湖南化工研究院).
INOVA-400MB型核磁共振波谱(NMR)仪,TMS为内标,美国Varian公司; RY-1型熔点仪,天津市天分仪器厂; ZF-2型三用紫外显色仪,上海安亭电子仪器厂; MAT 95XP型高分辨质谱(HRMS)仪,美国Thermo公司.
1.2 实验过程
参照文献[24]方法合成7-甲氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-胺、7-乙氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-胺、7-丙氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-胺和7-(苄氧基)-2,2-二甲基-2,3-二氢苯并呋喃-5-胺; 参照文献[25]方法合成5-乙酰基-2-氨基-4-甲基噻唑、2-氨基-4-甲基噻唑-5-羧酸乙酯、4-(叔丁基)-5-(1H-1,2,4-三唑-1-基)噻唑-2-胺、4-(2,4-二氯-5-氟苯基)噻唑-2-胺和(2-氨基噻唑-4-基)丙酸甲酯和1-(2-氨基-4-甲基噻唑-5-基)乙-1-酮O-甲基肟.
1.2.1 目标化合物A1~A6的合成 将1.90 g(10 mmol)1-甲基-3-乙基-4-氯-5-吡唑甲酸和10 mL二氯亚砜混合,搅拌回流反应6 h,用薄层液相色谱(TLC)监测至反应完全,减压旋转除去过量的二氯亚砜,得到棕色液体1-甲基-3-乙基-4-氯-5-吡唑甲酰氯.
将0.20 g(1.0 mmol)7-甲氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-胺、0.13 g(1.3 mmol)三乙胺和20 mL二氯甲烷加入反应瓶中,在冰浴及搅拌下缓慢滴加0.23 g(1.1 mmol)1-甲基-3-乙基-4-氯-5-吡唑甲酰氯(溶于5 mL二氯甲烷),继续搅拌0.5 h,用TLC监测至反应完全; 用去离子水洗涤,分液,水相用二氯甲烷萃取,合并有机相,旋转蒸发回收溶剂,经柱层析分离得到灰色固体N-[4-(7-甲氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-基)]-1-甲基-3-乙基-4-氯-5-吡唑甲酰胺(A1),收率68.8%.
参照化合物A1的合成方法,分别用不同取代的苯并呋喃-5-胺与1-甲基-3-乙基-4-氯-5-吡唑甲酰氯进行缩合反应,制得化合物A2~A5,收率32.7%~66.0%.
将0.72 g(2.4 mmol)3-溴-1-(3-氯吡啶-2-基)-5-吡唑甲酸、0.46 g(2.4 mmol)1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)、0.32 g(2.4 mmol)1-羟基苯并三唑(HOBt)和10 mLN,N-二甲基甲酰胺(DMF)混合,室温下搅拌30 min,加入0.41 g(2.0 mmol)7-乙氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-胺和0.5 mL三乙胺,于120 ℃继续搅拌8.0 h; 将反应液倒入去离子水中,析出固体,粗产物经柱层析得淡黄色固体N-(7-乙氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-基)-3-溴-1-(3-氯吡啶-2-基)-5-吡唑甲酰胺(A6),收率48.2%.
化合物A1~A6的合成条件和理化数据列于表1.
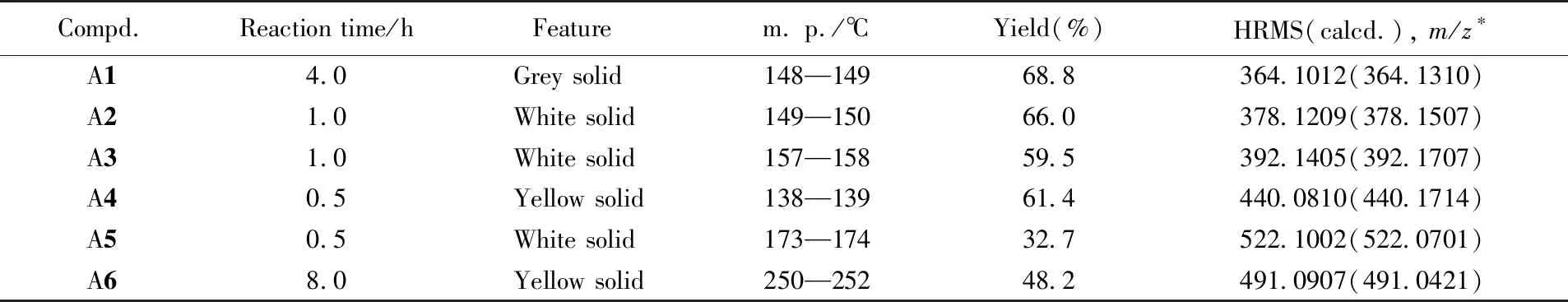
Table 1 Physical data and HRMS results of compounds A
*m/z=M+1.
1.2.2 目标化合物B1~B4的合成 将0.55 g(2.0 mmol)4-(7-甲氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-基)噻唑-2-胺、0.42 g(6.0 mmol)碳酸钾和10 mL丙酮混合,室温搅拌下缓慢滴加0.44 g(2.2 mmol)1-甲基-3-乙基-4-氯-5-吡唑甲酰氯的丙酮溶液(10 mL),回流反应4.0 h; 旋转蒸发回收溶剂,加入二氯甲烷,用去离子水洗涤,用二氯甲烷萃取,合并有机相,干燥后旋转蒸发除去溶剂,再用乙酸乙酯和石油醚重结晶,得到白色固体N-[4-(7-甲氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-基)噻唑-2-基]-1-甲基-3-乙基-4-氯-5-吡唑甲酰胺(B1),收率28.1%.
参照化合物B1的合成方法,以4-(7-乙氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-基)噻唑-2-胺为原料合成了化合物B2,收率30.9%.
参照化合物A6的合成方法,分别以4-(7-甲氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-基)噻唑-2-胺和4-(7-乙氧基-2,2-二甲基-2,3-二氢苯并呋喃-5-基)噻唑-2-胺为原料合成了化合物B3~B4,收率分别为31.6%和52.4%.化合物B1~B4的合成条件和理化数据列于表2.

Table 2 Physical data and HRMS results of compounds B
*m/z=M+1.
1.2.3 目标化合物C1~C13的合成 参照化合物B1的合成方法,分别用不同取代的噻唑-2-胺与1-甲基-3-乙基-4-氯-5-吡唑甲酰氯反应制备了化合物C1~C8,收率33.5%~69.4%.参照化合物A6的合成方法,分别用不同取代的噻唑-2-胺与3-溴-1-(3-氯吡啶-2-基)-5-吡唑甲酸缩合制备了化合物C9~C13,收率40.7%~63.4%.
化合物C1~C13的合成条件和理化数据列于表3,化合物A~C的核磁共振波谱表征数据列于表4.

Table 3 Physical data and HRMS results of compounds C
*m/z=M+1.

Table 4 1H NMR and 13C NMR data of compounds A—C
Continued

Compd. 1H NMR(400 MHz, CDCl3), δ13C NMR(100 MHz, CDCl3), δA48.19(s, 1H, NH), 7.45(d, J=7.5 Hz, 2H, Ph-H), 7.38—7.27(m, 3H, Ph-H), 7.08(s, 1H, benzofuran-H), 6.99(s, 1H, benzofuran-H), 5.19(s, 2H, OCH2), 4.15(s, 3H, NCH3), 3.03(s, 2H, CH2), 2.66(q, J=7.6 Hz, 2H, CH2), 1.52(s, 6H, 2CH3), 1.26(t, J=7.6 Hz, 3H, CH3)156.45, 149.72, 145.69, 143.24, 137.13, 131.42, 129.88, 128.92, 128.59, 128.01, 127.73, 111.25, 107.99, 107.45, 87.99, 71.43, 43.49, 40.84, 28.29, 19.40, 12.95A58.32(s, 1H, NH), 8.07(d, J=8.4 Hz, 1H, C6H3), 7.54(s, 1H, benzo-furan-H), 7.37(d, J=8.4 Hz, 2H, C6H3), 7.26(s, 1H, benzofuran-H), 4.16(s, 3H, NCH3), 3.09(s, 2H, CH2), 2.67(q, J=7.5 Hz, 2H, CH2), 1.49(s, 6H, 2CH3), 1.26(t, J=7.5 Hz, 3H, CH3)162.03, 156.55, 149.80, 147.93, 136.04, 133.67, 133.47, 131.39, 130.52, 129.67, 127.24, 116.42, 114.81, 107.62, 89.30, 43.36, 40.97, 28.18, 19.42, 12.96A68.47—7.39(m, 3H, pyridine-H), 6.91(s, 1H, benzofuran-H), 6.83(s, 1H, pyrazole-H), 6.78(s, 1H, benzofuran-H), 4.01(q, J=7.0 Hz, 2H, CH2), 2.94(s, 2H, CH2), 1.47(s, 6H, 2CH3), 1.37(t, J=7.0 Hz, 3H, CH3)155.50, 148.85, 146.66, 145.22, 143.34, 139.99, 139.52, 129.40, 129.20, 128.27, 127.98, 125.80, 110.66, 110.14, 106.42, 87.80, 64.49, 43.38, 28.15, 14.79B110.11(s, 1H, NH), 7.27—7.03(m, 3H, benzofuran-H+thiazole-H), 4.21(s, 3H, NCH3), 3.95(s, 3H, OCH3), 3.07(s, 2H, CH2), 2.68(q, J=7.6 Hz, 2H, CH2), 1.54(s, 6H, 2CH3), 1.27(t, J=7.5 Hz, 3H, CH3)156.08, 155.58, 150.89, 150.07, 147.58, 144.54, 129.15, 128.41, 127.39, 115.47, 109.30, 108.94, 106.20, 88.18, 55.95, 43.26, 41.14, 28.25, 19.22, 12.71B210.38(s, 1H, NH), 7.30(s, 1H, benzofuran-H), 7.28(s, 1H, benzofu-ran-H), 7.02(s, 1H, thiazole-H), 4.22(t, 2H, J=7.2 Hz, CH2), 4.21(s, 3H, CH3), 3.06(s, 2H, CH2), 2.69(q, J=7.6 Hz, 2H, CH2), 1.54(s, 6H, 2CH3), 1.47(t, J=7.0 Hz, 3H, CH3), 1.28(t, J=7.6 Hz, 3H, CH3)156.10, 155.62, 154.05, 150.97, 150.12, 148.07, 143.79, 129.23, 128.74, 127.29, 115.55, 111.16, 106.14, 88.02, 64.59, 43.36, 41.17, 28.28, 19.21, 14.95, 12.69B38.54—7.44(m, 3H, pyridine-H), 6.98(s, 1H, pyrazole-H), 7.19—6.86(m, 3H, benzofuran-H+thiazole-H), 3.90(s, 3H, CH3), 3.06(s, 2H, CH2), 1.52(s, 6H, 2CH3)157.53, 154.97, 150.65, 148.37, 147.80, 146.87, 144.58, 139.56, 137.26, 128.86, 128.51, 128.05, 126.92, 125.89, 115.56, 111.40, 109.32, 106.60, 88.27, 55.83, 43.17, 28.23B410.83(s, 1H, NH), 8.55—7.43(m, 3H, pyridine-H), 6.97(s, 1H, pyrazole-H), 7.18—6.76(m, 3H, benzofuran-H+ thiazole-H), 4.14(q, J=7.0 Hz, 2H, CH2), 3.04(s, 2H, CH2), 1.50(s, 6H, 2CH3), 1.43(t, J=7.0 Hz, 3H, CH3)157.61, 155.02, 150.71, 148.41, 148.16, 146.90, 143.80, 139.54, 137.24, 128.87, 128.77, 128.02, 126.87, 125.88, 115.55, 111.38, 111.06, 106.54, 88.08, 64.45, 43.22, 28.22, 14.92C110.00(s, 1H, NH), 4.22(s, 3H, NCH3), 2.69(t, 2H, J=7.6 Hz, CH2), 2.67(s, 3H, CH3), 2.54(s, 3H, COCH3), 1.27(t, J=7.6 Hz, 3H, CH3)190.46, 157.35, 155.72, 155.51, 150.25, 128.64, 126.17, 109.39, 41.26, 30.43, 19.17, 18.09, 12.65C24.21(s, 3H, NCH3), 3.96—3.97[2s, (2.25+0.75)H, OCH3], 2.69(t, 2H, J=7.6 Hz, CH2), 2.46—2.51[2s, (0.75+2.25)H, CH3], 2.25, 2.31[2s, (2.25+0.75) H, CH3], 1.27(t, J=7.6 Hz, 3H, CH3)C310.06(s, 1H, NH), 4.32(q, J=6.9 Hz, 2H, OCH2), 4.20(s, 3H, NCH3), 2.69—2.65(m, 5H, CH3+CH2), 1.36(t, J=7.0 Hz, 3H, CH3), 1.26(t, J=7.4 Hz, 3H, CH3)162.52, 157.92, 156.72, 155.70, 150.22, 128.72, 116.74, 109.31, 60.96, 41.25, 19.18, 17.10, 14.34, 12.67C49.88(s, 1H, NH), 8.27(s, 1H, 1,2,4-triazole-H), 8.11(s, 1H, 1,2,4-triazole-H), 4.18(s, 3H, NCH3), 2.69(q, J=7.5 Hz, 2H, CH2), 1.27(t, J=7.6 Hz, 3H, CH3), 1.16(s, 9H, 3CH3)156.73, 155.70, 152.53, 152.48, 150.22, 147.36, 128.68, 119.78, 109.18, 41.19, 35.95, 29.58, 19.20, 12.70C510.16(s, 1H, NH), 7.82(d, 1H, C6H2), 7.50(d, 1H, C6H2), 7.26(s, 1H, thiazole-H), 4.20(s, 3H, NCH3), 2.68(q, J=7.6 Hz, 2H, CH2), 1.27(t, J=7.6 Hz, 3H, CH3)158.02, 155.64(d), 155.55, 150.17, 144.75, 132.77(d), 131.91, 128.90, 126.87(d), 120.87(d), 12.67, 19.21, 41.15, 109.14, 114.53, 118.55(d)C69.98(s, 1H, NH), 6.89(s, 1H, thiazole-H), 4.20(s, 5H, COCH2+NCH3), 3.73—3.70(m, 2H, CH2), 2.71—2.61(m, 2H, CH2), 1.32—1.22(m, 6H, CH3+CH3)170.17, 156.39, 155.51, 150.10, 144.01, 129.08, 111.54, 109.03, 61.13, 41.12, 37.01, 19.1, 14.18, 12.68
Continued

Compd. 1H NMR(400 MHz, CDCl3), δ13C NMR(100 MHz, CDCl3), δC710.06(s, 1H, NH), 7.89(d, J=8.5 Hz, 1H, benzofuran-H), 7.57(s, 1H, thiazole-H), 6.48(d, J=8.5 Hz, 1H, benzofuran-H), 4.22(s, 3H, NCH3), 3.86(s, 3H, OCH3), 3.00(s, 2H, CH2), 2.68(q, J=7.3 Hz, 2H, CH2), 1.55(s, 6H, 2CH3), 1.27(t, J=7.4 Hz, 3H, CH3)157.30, 156.15, 155.52, 155.15, 150.04, 146.24, 129.31, 127.67, 114.18, 111.09, 109.72, 108.87, 102.80, 88.27, 55.41, 41.14, 40.08, 28.67, 19.23, 12.73C810.02(s, 1H, NH), 7.88(d, J=8.6 Hz, 1H, benzofuran-H), 7.57(s, 1H, thiazole-H), 6.47(d, J=8.7 Hz, 1H, benzofuran-H), 4.22(s, 3H, CH3), 4.09(q, J=7.0 Hz, 2H, CH2), 3.01(s, 2H, CH3), 2.69(q, J=7.6 Hz, 2H, CH2), 1.55(s, 6H, 2CH3), 1.41(t, J=7.0 Hz, 3H, CH3), 1.28(t, J=7.6 Hz, 3H, CH3)157.33, 155.59, 155.56, 155.20, 150.04, 146.31, 129.38, 127.57, 114.4, 110.86, 109.61, 108.88, 103.77, 88.19, 63.59, 41.10, 40.19, 28.69, 19.23, 14.96, 12.72C98.58—7.48(m, 3H, pyridine-H), 6.95(s, 1H, pyrazole-H), 4.27(q, J=7.0 Hz, 2H, CH2), 2.61(s, 3H, CH3), 1.31(t, J=7.1 Hz, 3H, CH3)162.25, 158.79, 155.90, 155.24, 148.22, 147.00, 140.00, 137.25, 128.98, 128.35, 126.08, 116.73, 111.84, 61.02, 16.92, 14.27C108.47(s, 1H, 1,2,4-triazole-H), 8.09(s, 1H, 1,2,4-triazole-H), 8.77—7.52(m, 3H, pyridine-H), 6.86(s, 1H, pyrazole-H), 1.10(s, 9H, 3CH3)C118.54—7.45(m, 3H, pyridine-H), 6.91(s, 1H, pyrazole-H), 6.82(s, 1H, thiazole-H), 4.18(q, J=7.1 Hz, 2H, CH2), 3.67(s, 2H, CH2), 1.26(t, J=7.0 Hz, 3H, CH3)170.21, 157.07, 154.83, 148.35, 146.99, 143.50, 139.67, 137.67, 128.91, 128.23, 126.02, 111.72, 111.44, 61.25, 36.90, 14.15C127.69(d, J=8.6 Hz, 1H, benzofuran), 8.55—7.43(m, 3H, pyridine-H), 7.40(s, 1H, thiazole-H), 6.92(s, 1H, pyrazole-H), 6.47(d, J=8.7 Hz, 1H, benzofuran-H), 3.84(s, 3H, OCH3), 2.98(s, 2H, CH2), 1.54(s, 6H, 2CH3)157.71, 157.13, 156.37, 155.90, 148.62, 146.87, 144.74, 139.49, 138.17, 129.00, 128.08, 127.23, 125.84, 114.38, 111.49, 110.02, 109.05, 103.08, 88.55, 55.42, 40.02, 28.64C1310.74(s, 1H, NH), 7.65(d, J=8.6 Hz, 1H, benzofuran-H), 8.55—7.43(m, 3H, pyridine-H), 7.39(s, 1H, thiazole-H), 6.85(s, 1H, pyrazole-H), 6.43(d, J=8.7 Hz, 1H, benzofuran-H), 4.07(q, J=7.0 Hz, 2H, CH2), 2.99(s, 2H, CH2), 1.54(s, 6H, 2CH3), 1.40(t, J=7.0 Hz, 3H, CH3)157.85, 157.10, 156.09, 155.85, 148.65, 146.85, 146.48, 139.49, 138.45, 129.03, 128.12, 127.10, 125.83, 114.62, 111.51, 109.66, 108.69, 104.05, 88.54, 63.63, 40.12, 28.66, 14.93
1.3 生物活性测试
委托国家农药创制工程技术研究中心湖南化工研究院有限公司生测中心测定了目标化合物的杀菌活性和杀虫活性.杀菌活性测试靶标为辣椒疫霉病菌(Phytophythoracapsici)、烟草赤星病菌(Alternariaalternata)、小麦赤霉病菌(Gibberellazeae)、黄瓜灰霉病菌(Botrytiscinerea)和油菜菌核病菌(Sclerotoniasclerotiorum).杀虫活性测试靶标分别为黏虫、蚕豆蚜及棉红蜘蛛.采用农药生物活性筛选测定技术测定和计算抑制率[26].
1.4 DFT计算
利用Gasian09软件[27]完成离散傅里叶变换(DFT)计算,采用密度泛函理论B3LYP方法在气相中寻找并优化所有极小值点,对所有元素使用了6-311G(d,p)基组,频率分析验证所有优化得到的不动点的性质,分别具有0个(极小点)或1个虚频(过渡态).在密度泛函理论B3LYP方法的基础上利用Multiwfn 3.6软件计算了分子范德华表面静电势[28,29],并利用VMD程序绘制得到静电势图.
2 结果与讨论
2.1 目标化合物的核磁共振波谱表征
化合物A主要由苯并呋喃环和吡唑环构成,化合物B在化合物A的基础上引入了噻唑环,化合物C则主要由噻唑环和吡唑环构成,因此在氢谱上比较好区分.除化合物A6外,其余化合物的酰胺键上的活泼氢均出现在δ8.25附近.由于化合物B和C中存在噻唑环,酰胺键上的活泼氢则出现在更低场(δ10.00附近).在13C NMR谱中,烷基碳作为sp3杂化的碳原子,其δ位于0~90之间,芳香环上的碳作为sp2杂化的碳原子,其δ位于100~160之间.此外,化合物中酰胺结构的羰基碳原子的δ最高(约为158).
2.2 生物活性
采用农药生物活性筛选测定技术测试了目标化合物的杀菌和杀虫活性,结果列于表5.
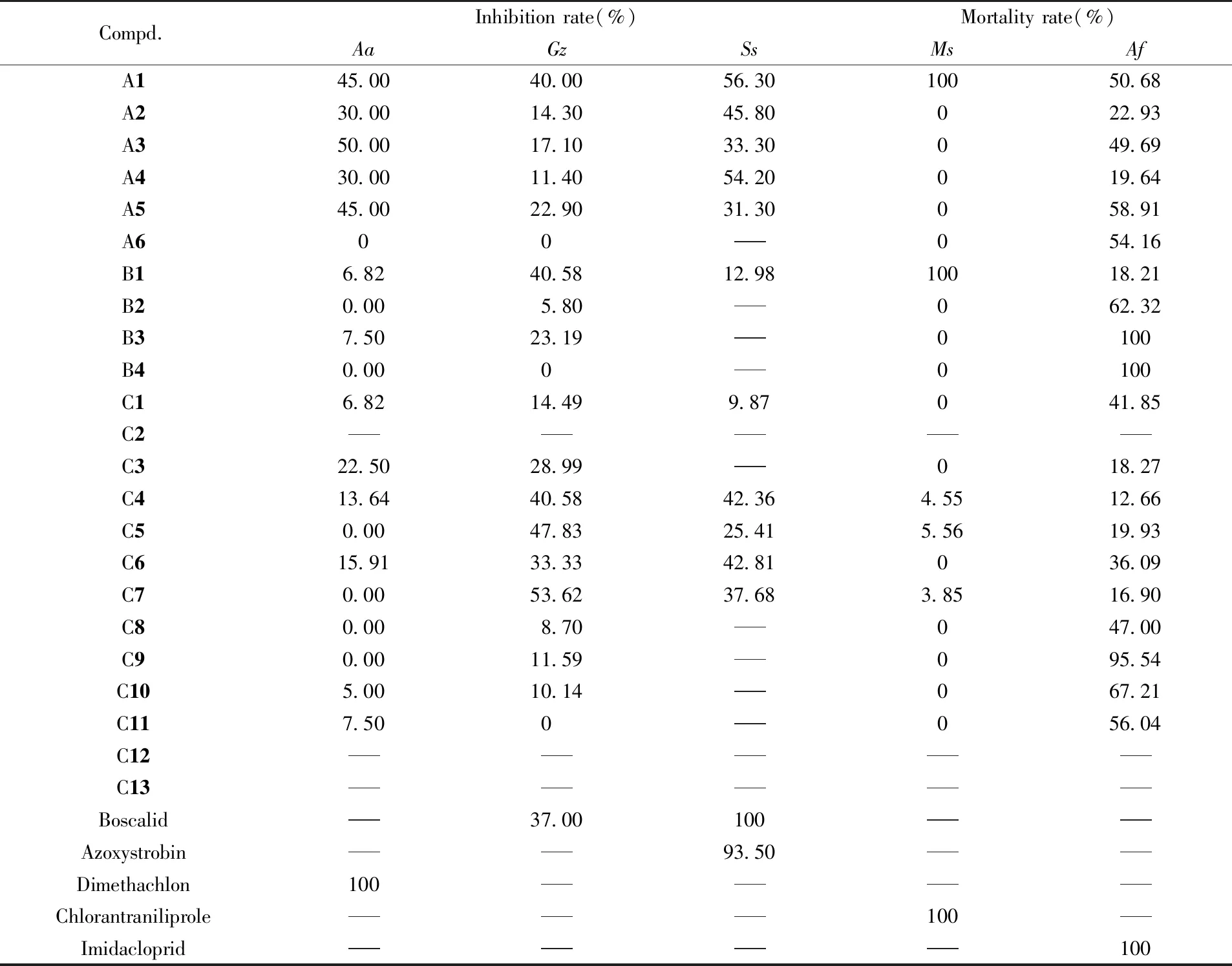
Table 5 Bactericidal and insecticidal activities of compounds A—C*
*---: Not determined;Aa:Alternariaalternata;Gz:Gibberellazeae;Ss:Sclerotonia;Ms:Mythimnaseparate;Af:Aphisfabae.
由表5可见,目标化合物在25 mg/L浓度下对辣椒疫霉病菌(Phytophythoracapsici)、烟草赤星病菌(Alternariaalternata)、小麦赤霉病菌(Gibberellazeae)、黄瓜灰霉病菌(Botrytiscinerea)和油菜菌核病菌(Sclerotoniasclerotiorum)的离体抑菌活性表现一般,其中化合物A3对烟草赤星病菌及C7对小麦赤霉病菌的抑制率>50%,化合物A1和A4对油菜菌核病菌的抑制率>50%,而其余化合物的抑菌效果不明显,相关数据未列出.在500 mg/L的浓度下,大部分化合物对蚜虫表现了较好的杀虫活性,其中化合物B3和B4对蚜虫的致死率达到100%,与对照药剂吡虫啉相当,化合物C9的致死率为95.54%,化合物C10的致死率为67.21%; 大部分化合物对黏虫的杀虫活性较弱或无活性,仅化合物A1和B1对黏虫表现出较好的杀虫活性,致死率为100%,与对照药剂相当.所有目标化合物对棉红蜘蛛几乎无灭杀效果,数据未列出.通过分析化合物结构与杀蚜虫活性之间的构效关系发现,在呋喃酚吡唑酰胺骨架上插入噻唑环可显著提升化合物的杀蚜虫活性,去掉呋喃酚或异构化呋喃酚时杀蚜虫活性出现不同程度的减弱.在保留噻唑环和吡唑酰胺骨架的基础上,对噻唑环侧链进行修饰,得到了杀蚜虫活性较好的化合物C10和C11.同时,我们发现吡唑环上取代基的改变对杀蚜虫活性有较大影响,当吡唑环上3位取代基为溴,1位取代基为3-氯-吡啶基时杀蚜虫活性最佳.
2.3 DFT计算
根据前线子轨道理论可知,最高占据分子轨道(HOMO)和最低占据分子轨道(LUMO)分别能够优先提供和接收电子,这2个分子轨道是影响生物活性的重要量子化学参数.本文采用密度泛函理论(DFT)的Becke三参数混合泛函方法(B3LYP)对化合物B1,B3及阳性对照药吡虫啉进行了结构优化(Scheme 2),并对其前沿分子轨道进行了分析.
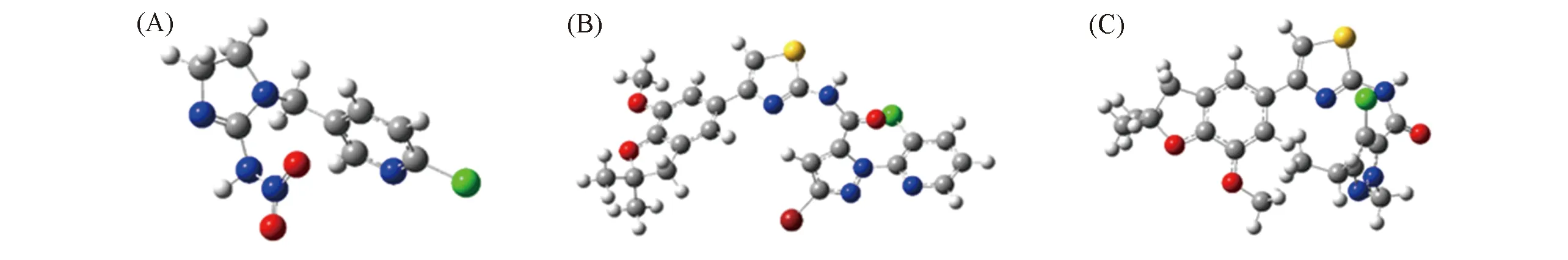
Scheme 2 Molecular structure optimization diagrams of compound imidacloprid(A),B3(B) and B1(C)
经过几何优化后发现,化合物B3和吡虫啉具有相似的几何空间,其分子内部均存在一定的夹角,而化合物B1的几何空间却与吡虫啉不同.这可能是因为当化合物以一定夹角存在时容易与蛋白识别并结合,从而达到灭杀蚜虫的效果.这也与化合物B3的杀蚜虫活性优于化合物B1的结果一致.
图1示出了化合物B1和B3与对照药剂吡虫啉的前线分子轨道.

Fig.1 LUMO(A,C,E) and LUMO(B,D,F) maps for imidacloprid(A,B),B3(C,D) and B1(E,F) The green parts represent positive molecular orbital,and the red parts represent negative molecular orbital.
化合物B1,B3,B4及吡虫啉的轨道能级数据列于表6.从前沿轨道能级来看,当分子的轨道能级差与阳性对照吡虫啉的轨道能级差相近时化合物会表现出较好的杀蚜虫活性.当化合物的轨道总能量与阳性对照吡虫啉相近时,化合物的抑制活性与阳性对照相当.

Table 6 Frontier molecular orbital energies and acaricidal activities of compounds B1,B3,B4 and imidacloprid
a.1 Hartree=4.35974417×10-18J=27.2113845 eV;b. ΔE=ΔELUMO-ΔEHOMO.

Fig.2 ESP-mapped molecular vdW surface of compoud B1(A),B3(B) and imidacloprid(C)
分子范德华表面静电势(ESP)是研究和预测分子之间相互作用的关键.图2示出了利用Multiwfn 3.6软件计算所得分子范德华表面静电势,并利用VMD程序绘制得到静电势图,得到了阳性对照吡虫啉、化合物B1及B3的分子尺寸、结构和电荷密度.由图2可见,阳性对照吡虫啉的负电荷主要集中在吡啶环上的氯原子附近; 化合物B3的电荷也主要集中在嘧啶环和吡唑环附近,与阳性对照的电荷分布相近; 而化合物B1的电荷却主要集中在呋喃环及羰基附近,说明化合物电荷分布与活性密切相关.当化合物与阳性对照电荷分布相近时,会表现出与阳性对照相近或相当的活性.
3 结 论
生物活性测试结果表明,在25 mg/L浓度下,化合物A3对烟草赤星病菌的抑制率、C7对小麦赤霉病菌的抑制率以及A1和A4对油菜菌核病菌的抑制率均大于50%; 在500 mg/L浓度下,部分化合物对黏虫和蚜虫有良好的杀虫活性,其中化合物A1和B1对黏虫的致死率均为100%,化合物B3,B4和C9对蚜虫的致死率分别为100%,100%和95.54%.对蚜虫杀虫活性的构效关系分析结果表明,在呋喃酚吡唑酰胺骨架上插入噻唑环能显著提升化合物的杀蚜虫活性,当去掉呋喃酚或其异构体时活性减弱.在保留噻唑环和吡唑酰胺骨架的基础上,对噻唑环侧链进行改造得到了杀蚜虫活性较好的化合物C10和C11.吡唑环上氯吡啶基的引入可提升化合物对蚜虫的杀虫活性.

