微波辅助下铑催化二芳基膦酰胺与炔烃的C—H活化/环化反应
周春妮,郑子昂,彭望明,王洪波,张玉敏,王 亮,肖 标
(江汉大学化学与环境工程学院,光电化学材料与器件教育部重点实验室,武汉 430056)
环状膦酰胺是一类重要的含膦有机化合物,在合成化学中是制备有机中间体的重要砌块[1],在医药和农药分子中,环状膦酰胺结构通常是化合物表现生物活性的位点,在化工新材料中它又是许多光电材料和阻燃材料的核心结构[2].更重要的是这类化合物与人的生命活动密切相关.因此,发展简便高效、绿色的合成方法以构建环状膦酰胺分子受到了广泛关注.目前,合成膦酰胺分子的方法主要有膦酰氯与胺的酰化反应、膦酸衍生物与胺的缩合反应、膦氧化物与胺的偶联反应以及伯膦酰胺的烷基化等衍生方法[3].这些策略主要用于制备非环状结构的膦酰胺,对于环状膦酰胺的合成却不适用.近年来,过渡金属催化的C—H活化/环化反应因具有较高的原子和步骤经济性而得以快速发展,成为金属催化领域最活跃的研究课题之一[4~6].该合成策略不仅可以选择性活化C—H键,还避免了导向基的移除,并且导向基能够参与反应形成环化产物[7].因此,在构建杂环化合物方面具有明显优势,也为环状膦酰胺分子的合成提供了一种绿色、高效的方法[8,9].
Glorius等[10]研究了[RhCp*(CH3CN)3](SbF6)2(CP*: 五甲基环戊二烯基)催化N,N-二异丙基苯基膦酰胺与芳基炔烃的C—H活化/环化反应,以中等收率获得了相应的环状膦酰胺化合物.但是,该反应膦酰胺底物的适用范围较窄.Lee等[11]研究了[RhCp*Cl2]2催化二苯基膦酰胺的C—H活化/环化反应,当使用活化的烯烃作为底物时,可获得五元环状膦酰胺,当使用炔烃作为底物时,可获得六元环状膦酰胺.Duan等[12]报道了Pd(OAc)2催化N,N-双取代二芳基膦酰胺的不对称分子内C—H芳基化反应,该反应的对映选择性是由手性配体实现的,由Taddol衍生化的NP配体效果最好,对映选择性高达95%.Dong等[13]利用C—H活化反应作为关键步骤,实现了[IrCp*Cl2]2催化环状膦酰亚胺与炔烃的串联Grignard[3+2]环化反应,该方法能够高效地构建具有螺环结构的新型膦酰胺分子.Han等[14]利用N-五氟苯基膦酰胺基团作为导向基,研究了Pd(OAc)2催化的二芳基膦酰胺分子内的C—H胺化反应.Cramer研究组[15]将联萘骨架引入到环戊二烯基阴离子中,制备了一种新型手性铑催化剂,实现了不对称苯基膦酰胺与炔烃的C—H活化/环化反应,以优异的对映选择性获得了手性六元环状膦酰胺化合物.
尽管利用C—H活化/环化反应合成环状膦酰胺的研究已取得了一些进展,但继续探索微波条件下的C—H活化/环化反应[16],并快速构建环状膦酰胺衍生物的研究仍然十分必要.基于前文[17~20]对C—H键活化反应的研究成果,我们认为通过调节二芳基膦酰胺氮原子上的取代基可以改变含氮导向基的N—H键酸性,从而提高底物与催化剂的配位性能.此外,含氟官能团是许多药物和农药的重要结构单元,特别是含多氟取代的化合物通常具有较好的生物活性[21].基于此,本文研究了一种微波(MW)条件下的N-五氟苯基-二芳基膦酰胺与炔烃的C—H活化/环化反应.此方法不仅能提高反应效率、缩短反应时间,而且能够快速合成含氟环状膦酰胺衍生物.
1 实验部分
1.1 试剂与仪器
磷酸钾、磷酸钠、磷酸氢二钠、磷酸二氢钠、碳酸钾、碳酸钠、碳酸氢钠和乙酸钾乙酸钠购自国药集团化学试剂有限公司; 碳酸银、氧化银、乙酸银和三氟乙酸银[RhCp*Cl2]2购自萨恩化学技术(上海)有限公司; 氟化银购自上海贤鼎生物科技有限公司; 所用试剂均为分析纯产品,未经过纯化直接使用; 叔丁醇、乙醇、甲苯、二甲苯、1,2-二氯乙烷(DCE)、四氢呋喃和1,4-二氧六环乙腈均按照《实验室化学品纯化手册》[22]报道方法进行干燥处理; GF254薄层层析和柱层析用硅胶(200~300目,山东青岛海洋化工厂).
Discover(单模)型微波合成仪(美国CEM公司); Bruker Avance Ⅱ 400 MHz型超导核磁共振仪(德国Bruker公司); Bruker microTOF-QⅡ型高分辨质谱仪(德国Bruker公司); Bruker TENSOR27型傅里叶变换红外光谱仪(直接涂片测定,德国Bruker公司); WRS-2型微机熔点仪(上海圣科仪器设备有限公司).
1.2 实验过程
C—H活化/环化反应路线如Scheme 1所示.向干燥的10 mL微波反应管中依次加入N-五氟苯基二苯基膦酰胺(1a,0.15 mmol)、二苯乙炔(2a,0.18 mmol)、[RhCp*Cl2]2(0.006 mmol)、Ag2CO3(0.30 mmol)、NaHCO3(0.15 mmol)和1.5 mL DCE,将混合物置于微波合成仪(120 W)中于110 ℃反应15 min.将反应液冷却至室温,加入乙酸乙酯(20 mL)稀释,过滤并浓缩.粗产品经硅胶柱层析[V(乙酸乙酯)∶,V(石油醚)=1∶,5~1∶,2]纯化得化合物3a.化合物3b~3s按相同方法合成.
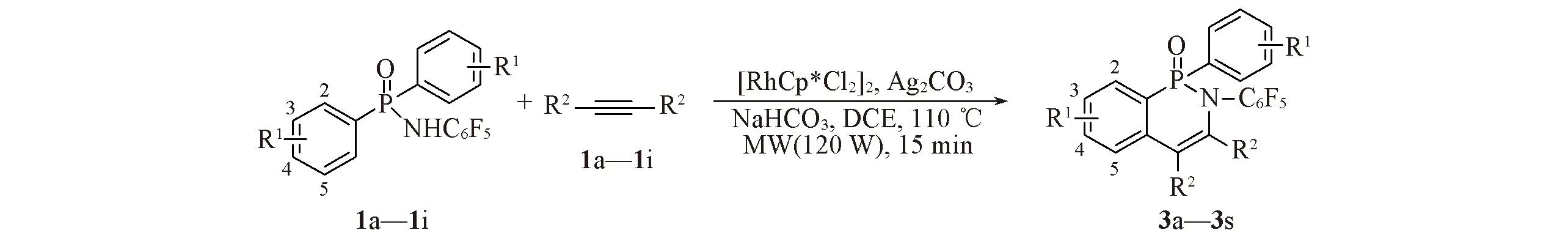
Scheme 1 C—H activation/cyclization of diaryl phosphoramides and alkynes
化合物3a~3s的理化数据见表1,核磁共振数据见表2,核磁共振谱图和质谱图见图S1~S35(见本文支持信息).

Table 1 Appearance,yields,melting points,HRMS and IR data of compounds 3a—3s
Continued
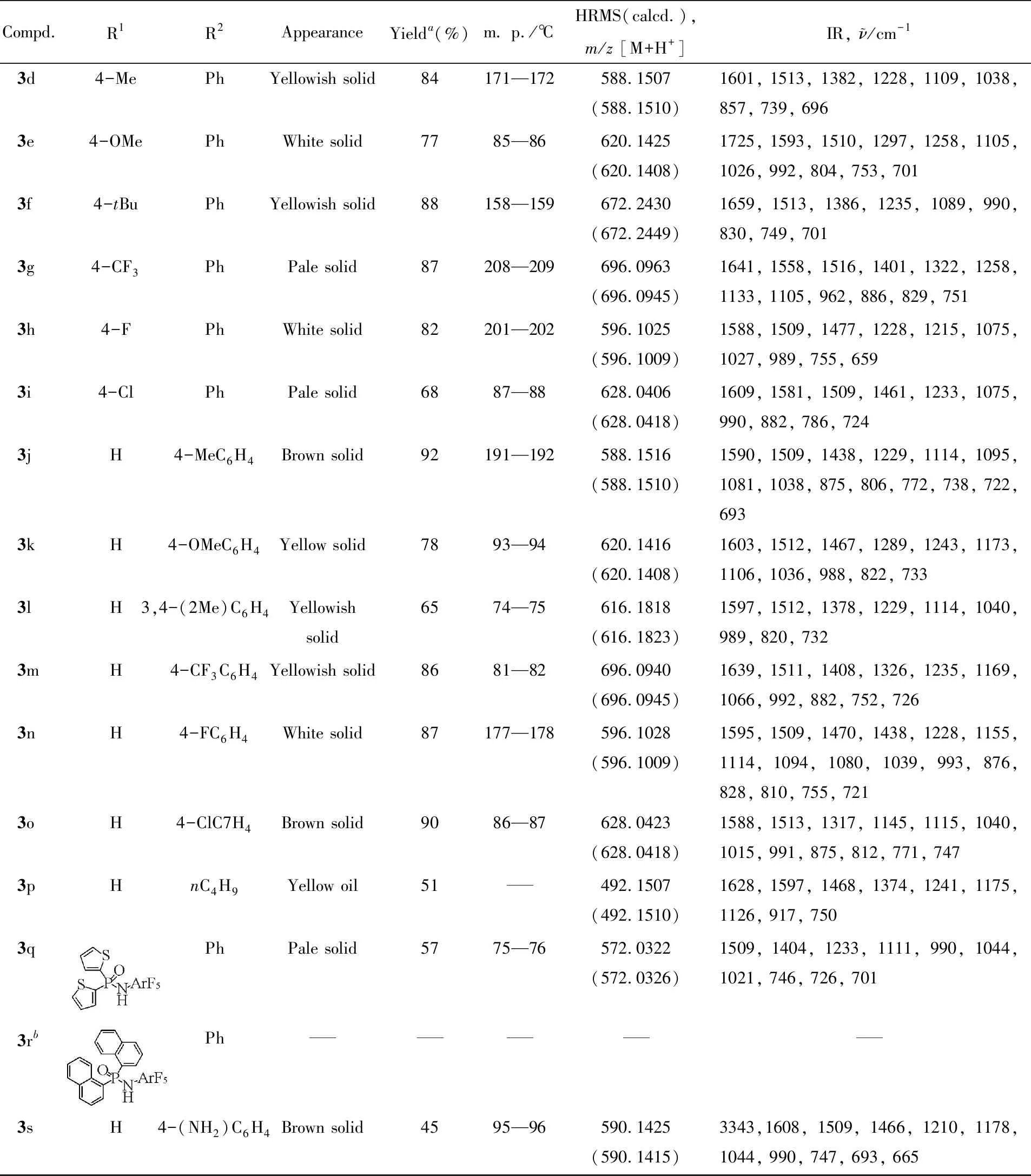
Compd.R1R2AppearanceYielda(%)m. p./℃HRMS(calcd.),m/z [M+H+]IR, ν/cm-13d4-MePhYellowish solid84171—172588.1507(588.1510)1601, 1513, 1382, 1228, 1109, 1038, 857, 739, 6963e4-OMePhWhite solid7785—86620.1425(620.1408)1725, 1593, 1510, 1297, 1258, 1105, 1026, 992, 804, 753, 7013f4-tBuPhYellowish solid88158—159672.2430(672.2449)1659, 1513, 1386, 1235, 1089, 990, 830, 749, 7013g4-CF3PhPale solid87208—209696.0963(696.0945)1641, 1558, 1516, 1401, 1322, 1258, 1133, 1105, 962, 886, 829, 7513h4-FPhWhite solid82201—202596.1025(596.1009)1588, 1509, 1477, 1228, 1215, 1075, 1027, 989, 755, 6593i4-ClPhPale solid6887—88628.0406(628.0418)1609, 1581, 1509, 1461, 1233, 1075, 990, 882, 786, 7243jH4-MeC6H4Brown solid92191—192588.1516(588.1510)1590, 1509, 1438, 1229, 1114, 1095, 1081, 1038, 875, 806, 772, 738, 722, 6933kH4-OMeC6H4Yellow solid7893—94620.1416(620.1408)1603, 1512, 1467, 1289, 1243, 1173, 1106, 1036, 988, 822, 7333lH3,4-(2Me)C6H4 Yellowish solid6574—75616.1818(616.1823)1597, 1512, 1378, 1229, 1114, 1040, 989, 820, 7323mH4-CF3C6H4Yellowish solid8681—82696.0940(696.0945)1639, 1511, 1408, 1326, 1235, 1169, 1066, 992, 882, 752, 7263nH4-FC6H4White solid87177—178596.1028(596.1009)1595, 1509, 1470, 1438, 1228, 1155, 1114, 1094, 1080, 1039, 993, 876, 828, 810, 755, 7213oH4-ClC7H4Brown solid9086—87628.0423(628.0418)1588, 1513, 1317, 1145, 1115, 1040, 1015, 991, 875, 812, 771, 7473pHnC4H9Yellow oil51492.1507(492.1510)1628, 1597, 1468, 1374, 1241, 1175, 1126, 917, 7503qPhPale solid5775—76572.0322(572.0326)1509, 1404, 1233, 1111, 990, 1044, 1021, 746, 726, 7013rbPh3sH4-(NH2)C6H4Brown solid4595—96590.1425(590.1415)3343,1608, 1509, 1466, 1210, 1178, 1044, 990, 747, 693, 665
a.Yield after purification by column chromatography on silica gel;b.no reaction.

Table 2 1H NMR,13C NMR and 31P NMR data of compounds 3a—3s
Continued

Compd.1H NMR(400 MHz, CDCl3), δ13C NMR(100 MHz, CDCl3), δ31P NMR(162 MHz, CDCl3), δ3b8.25(ddd,J=14.7, 7.6, 1.3 Hz, 1H), 7.53—7.46(m, 1H), 7.41(dd, J=7.5, 2.9 Hz, 1H), 7.39—7.33(m, 3H), 7.33—7.30(m, 1H), 7.26—7.22(m, 3H), 7.21—7.18(m, 2H), 7.16—7.03(m, 4H), 6.88(dd, J=8.1, 4.5 Hz, 1H), 2.29(s, 3H), 2.19(s, 3H)146.27(d,J=11 Hz), 141.80(d, J=10 Hz), 140.55(d, J=11 Hz), 139.47(d, J=6 Hz), 136.66, 134.79(d, J=5 Hz), 134.45(d, J=12 Hz), 132.95(d, J=2 Hz), 132.19(d, J=2 Hz), 131.82, 131.48(d, J=12 Hz), 130.74, 130.22, 130.09, 129.33, 128.99, 128.79, 128.32, 127.70, 127.49, 125.87, 125.73, 125.15(d, J=9 Hz), 122.47, 121.21, 118.83(d, J=10 Hz), 21.32(d, J=6 Hz), 20.63(d, J=4 Hz)21.693c7.68(d,J=13.6 Hz, 1H), 7.62—7.45(m, 2H), 7.39—7.27(m, 3H), 7.25—7.12(m, 5H), 7.09(dd, J=8.3, 5.5 Hz, 1H), 7.02(dd, J=9.8, 6.1 Hz, 2H), 6.93(p, J=3.5 Hz, 3H), 2.37(d, J=6.7 Hz, 3H), 2.34(s, 3H)138.55, 138.24, 138.10, 137.47, 137.33, 136.21(d,J=6 Hz), 135.36(d, J=4 Hz), 133.57(d, J=3 Hz), 133.29(d, J=2 Hz), 132.41(dd, J=11, 2 Hz ), 131.60, 131.32, 130.18,(d, J=11 Hz), 130.02, 129.36, 129.13(dd, J=11, 2 Hz ), 128.28, 128.14 , 128.10, 127.97, 127.50, 126.97, 126.85, 123.64, 122.40, 122.27(d, J=7 Hz), 21.29, 21.0518.743d7.67(dd,J=13.0, 7.9 Hz, 2H), 7.58(dd, J=14.0, 7.8 Hz, 1H), 7.26—7.21(m, 3H), 7.21—7.12(m, 5H), 7.06—7.00(m, 2H), 6.98(d, J=4.9 Hz, 1H), 6.96—6.89(m, 3H), 2.39(s, 3H), 2.31(s, 3H)143.40(d,J=3 Hz), 142.70(d, J=2 Hz), 139.49, 138.76(d, J=6 Hz), 137.40, 135.45(d, J=3 Hz), 132.19(dd, J=11, 1 Hz ), 131.71, 130.26, 130.15, 129.32, 129.13, 128.99, 128.24, 128.11, 127.96, 127.48, 127.23, 127.14, 126.85, 122.10(d, J=2 Hz), 121.04, 119.76, 22.00, 21.6918.833e7.71(dd,J=12.2, 8.6 Hz, 2H), 7.62(dd, J=13.8, 8.5 Hz, 1H), 7.25—7.10(m, 5H), 7.03—6.99(m, 2H), 6.97—6.86(m, 6H), 6.66(dd, J=4.4, 2.4 Hz, 1H), 3.85(s, 3H), 3.70(s, 3H)163.00(d,J=3 Hz), 162.56(d, J=3 Hz), 140.95(d, J=7 Hz), 140.13, 137.35, 135.47(d, J=4 Hz), 134.19(dd, J=13, 2 Hz), 132.21(d, J=12 Hz), 131.65, 131.56, 129.24, 128.15, 128.08, 128.01, 127.50, 126.91, 122.67, 121.54(d, J=6 Hz), 121.28, 113.81(d, J=14 Hz), 113.20(d, J=5 Hz), 112.98(d, J=10 Hz), 55.33, 55.1518.753f7.71(dd,J=12.8, 8.2 Hz, 2H), 7.65(dd, J=13.8, 8.1 Hz, 1H), 7.45(d, J=3.2 Hz, 1H), 7.44—7.37(m, 2H), 7.25—7.12(m, 6H), 7.04(d, J=2.9 Hz, 2H), 6.98—6.89(m, 3H), 1.31(s, 9H), 1.19(s, 9H)156.35(d,J=3 Hz), 155.55(d, J=3 Hz), 139.32, 138.59(d, J=6 Hz), 137.53, 135.60(d, J=3 Hz), 132.04(dd, J=12, 2 Hz), 131.71, 130.05, 129.93, 129.40, 128.19, 128.08, 127.89, 127.50, 126.86, 126.82, 125.19(d, J=4 Hz), 124.58(d, J=4 Hz), 123.74(d, J=10 Hz), 122.09(d, J=7 Hz), 120.86, 119.58, 35.16, 35.08, 31.02, 30.9218.483g7.88(dd,J=12.9, 8.1 Hz, 2H), 7.77(dd, J=13.8, 8.0 Hz, 1H), 7.69(dd, J=8.2, 2.7 Hz, 2H), 7.57(d, J=7.9 Hz, 1H), 7.40(d, J=4.4 Hz, 1H), 7.24—7.02(m, 5H), 7.00—6.80(m, 5H)141.31, 139.60(d,J=6 Hz), 135.91, 135.38, 134.92(dd, J=19, 3 Hz), 134.60(dd, J=18, 3 Hz), 134.45(d, J=3 Hz), 134.09, 132.33(dd, J=11, 2 Hz), 131.37, 131.10, 130.99, 129.02, 128.80, 128.48, 127.81, 127.63, 125.90, 125.56(q, J=4 Hz), 125.42(q, J=4 Hz), 124.65(d, J=3 Hz), 123.91—123.58(m), 121.93(d, J=3 Hz), 121.53(d, J=7 Hz)15.383h7.86—7.75(m, 2H), 7.74—7.67(m, 1H), 7.29—7.11(m, 7H), 7.11—7.06(m, 1H), 7.04—6.98(m, 2H), 6.98—6.91(m, 3H), 6.89—6.85(m, 1H)166.72(dd,J=24, 4 Hz), 164.20(dd, J=18, 4 Hz), 141.96(dd, J=9, 7 Hz), 140.98, 136.58, 134.85, 134.73, 134.63, 132.99(dd, J=13, 10 Hz), 131.47, 129.06, 128.54, 128.30, 127.69, 127.32, 121.03(dd, J=7, 3 Hz), 119.29(d, J=3 Hz), 118.99(d, J=2 Hz), 115.93(dd, J=21, 15 Hz), 115.04(dd, J=22, 5 Hz), 113.62(dd, J=23, 11 Hz)16.77
Continued

Compd.1H NMR(400 MHz, CDCl3), δ13C NMR(100 MHz, CDCl3), δ31P NMR(162 MHz, CDCl3), δ3i7.72(dd,J=12.8, 8.2 Hz, 2H), 7.63(dd, J=13.9, 8.2 Hz, 1H), 7.46(dd, J=8.4, 2.8 Hz, 2H), 7.37(dt, J=8.2, 2.1 Hz, 1H), 7.26—7.21(m, 2H), 7.21—7.15(m, 2H), 7.15—7.09(m, 2H), 7.05—6.90(m, 5H)141.04, 140.57(d,J=7 Hz), 139.80(d, J=5 Hz), 139.38(d, J=3 Hz), 136.33, 134.73(d, J=3 Hz), 133.37(dd, J=12, 2 Hz), 131.68(d, J=12 Hz), 131.47, 129.69, 129.06, 129.00, 128.85, 128.59, 128.33, 127.70, 127.67, 127.53, 127.38, 126.79(d, J=10 Hz), 121.32, 121.16, 121.09, 120.0416.783j7.79(dd,J=13.2, 7.9 Hz, 2H), 7.727.67(m, 1H), 7.57—7.40(m, 4H), 7.39—7.33(m, 1H), 7.20(dd, J=8.0, 5.2 Hz, 1H), 7.08—7.00(m, 4H), 6.92(d, J=7.9 Hz, 2H), 6.74(d, J=7.9 Hz, 2H), 2.27(s, 3H), 2.09(s, 3H)139.36, 139.19(d,J=6 Hz), 137.91, 136.40, 134.29, 132.76(d, J=3 Hz), 132.42(d, J=4 Hz), 132.23(d, J=3 Hz), 132.06(q, J=1 Hz), 131.42, 131.35, 130.01(d, J=11 Hz), 129.17, 128.74, 128.35, 128.27, 128.22, 127.08, 126.96(d, J=4 Hz), 126.88, 123.61, 122.31(d, J=8 Hz), 21.15, 21.1318.253k7.78(dd,J=13.2, 7.7 Hz, 2H), 7.73—7.64(m, 1H), 7.58—7.47(m, 2H), 7.43(td, J=7.5, 3.5 Hz, 2H), 7.36(td, J=7.4, 2.8 Hz, 1H), 7.23(dd, J=8.0, 5.2 Hz, 1H), 7.07(d, J=8.6 Hz, 2H), 6.95(d, J=8.6 Hz, 2H), 6.77(d, J=8.7 Hz, 2H), 6.47(d, J=8.8 Hz, 2H), 3.76(s, 3H), 3.62(s, 3H)158.92, 158.25, 139.33(t,J=5 Hz), 132.77(d, J=2 Hz), 132.62, 132.12(td, J=12, 3 Hz), 130.65, 130.08, 129.96, 129.63, 128.28(d, J=13 Hz), 127.82(d, J=3 Hz), 127.05, 126.91, 126.81, 123.58, 122.32, 121.94(d, J=2 Hz), 116.20, 114.88, 113.49, 112.96, 55.09, 54.9018.283l7.79(dd,J=13.1, 7.6 Hz, 2H), 7.67(dd, J=14.3, 7.1 Hz, 1H), 7.567.39(m, 4H), 7.35(td, J=7.4, 2.6 Hz, 1H), 7.21(dd, J=7.9, 5.2 Hz, 1H), 6.96(d, J=8.0 Hz, 2H), 6.916.80(m, 2H), 6.76(d, J=7.7 Hz, 1H), 6.67(d, J=7.8 Hz, 1H), 2.18(s, 3H), 2.17(s, 3H), 2.00(s, 3H), 1.96(s, 3H)139.40(d,J=5 Hz), 139.21, 136.46, 135.88, 135.51, 134.92, 134.72, 132.79, 132.73(d, J=3 Hz), 132.15(d, J=2 Hz), 132.05, 131.31, 130.43, 130.01, 129.86(d, J=3 Hz), 129.17, 128.95, 128.68, 128.25(d, J=4 Hz), 127.04(t, J=8 Hz), 126.82, 123.67, 122.48(t, J=7 Hz), 19.66, 19.43, 19.2619.193m7.79(dd,J=13.2, 7.7 Hz, 2H), 7.75—7.68(m, 1H), 7.58(dd, J=12.1, 4.5 Hz, 2H), 7.52(d, J=8.2 Hz, 2H), 7.49—7.43(m, 3H), 7.31(d, J=8.0 Hz, 2H), 7.29—7.25(m, 2H), 7.18(d, J=8.1 Hz, 2H), 7.12(dd, J=8.0, 5.2 Hz, 1H)140.62, 138.43, 138.11, 137.60(d,J=6 Hz), 133.28(d, J=3 Hz), 133.05, 132.63(d, J=2 Hz), 132.28(d, J=10 Hz), 131.95, 130.77, 130.46(d, J=12 Hz), 129.68, 129.52, 128.68, 128.50(d, J=13 Hz), 128.44(d, J=14 Hz), 126.74(d, J=9 Hz), 125.29(q, J=4 Hz), 124.90(q, J=4 Hz), 124.68, 123.96, 122.70, 122.48, 122.14(d, J=7 Hz), 121.9817.783n7.77(dd,J=13.1, 7.6 Hz, 2H), 7.69(dd, J=14.2, 7.4 Hz, 1H), 7.54(dd, J=16.2, 8.1 Hz, 2H), 7.48—7.36(m, 3H), 7.21—7.07(m, 3H), 7.02(dd, J=7.8, 5.6 Hz, 2H), 6.94(t, J=8.6 Hz, 2H), 6.68(t, J=8.6 Hz, 2H)163.30, 162.95, 160.82, 160.50, 138.75, 138.44(d,J=5 Hz), 133.16(d, J=8 Hz), 133.03(d, J=3 Hz), 132.44(d, J=2 Hz), 132.20(dd, J=11, 1 Hz), 131.27, 131.15(d, J=8 Hz), 130.61, 130.33(d, J=12 Hz), 129.30, 128.39(d, J=14 Hz), 127.43(d, J=4 Hz), 126.75(d, J=10 Hz), 123.71, 122.45, 121.52(d, J=7 Hz), 115.13(dd, J=28, 22 Hz)17.863o7.76(dd,J=13.2, 7.8 Hz, 2H), 7.72—7.66(m, 1H), 7.59—7.49(m, 2H), 7.48—7.39(m, 3H), 7.24(d, J=8.4 Hz, 2H), 7.15(dd, J=8.0, 5.2 Hz, 1H), 7.13—7.06(m, 2H), 6.98(s, 4H)138.42, 138.14(d,J=5 Hz), 135.44, 134.56, 133.55(d, J=4 Hz), 133.31, 133.10(d, J=3 Hz), 132.86, 132.49(d, J=2 Hz), 132.22(dd, J=10, 2 Hz), 130.56, 130.40, 130.29, 129.12, 128.58, 128.49, 128.36, 128.22, 127.66, 127.52, 126.75(d, J=9 Hz), 123.82, 122.56, 121.64(d, J=6 Hz)17.82
Continued

Compd.1H NMR(400 MHz, CDCl3), δ13C NMR(100 MHz, CDCl3), δ31P NMR(162 MHz, CDCl3), δ3p7.86—7.71(m, 2H), 7.62—7.52(m, 2H), 7.52—7.38(m, 4H), 7.32—7.23(m, 1H), 2.67—2.38(m, 4H), 1.76—1.51(m, 4H), 1.03(t, J=7.4 Hz, 3H), 0.94(t, J=7.4 Hz, 3H)149.69(d,J=11 Hz), 137.49(d, J=6 Hz), 132.53(dd, J=14, 2 Hz), 132.07, 131.96, 130.91, 130.40(d, J=13 Hz), 129.48, 128.33, 128.19, 126.56(d, J=15 Hz), 124.09, 123.63(d, J=10 Hz), 122.80, 113.76, 113.64, 33.99(d, J=5 Hz), 29.67, 22.58, 20.16, 14.09, 13.5923.933q7.77—7.75(m, 1H), 7.66(dd, J=5.9, 5.0 Hz, 1H), 7.59(dd, J=8.3, 3.6 Hz, 1H), 7.24—7.09(m, 6H), 7.04(d, J=7.6 Hz, 2H), 7.00—6.92(m, 3H), 6.85(dd, J=4.9, 2.7 Hz, 1H)148.21(d,J=7 Hz), 140.12, 137.70, 137.29(dd, J=13, 2 Hz), 135.47,(d, J=6 Hz), 134.50(d, J=4 Hz), 133.26(d, J=9 Hz), 132.95, 131.37, 130.88, 129.39, 128.45, 128.28, 128.06, 127.67, 127.33, 127.20, 126.97, 119.69, 118.19(d, J=5 Hz)6.873r∗3s7.77(dd,J=13.2, 7.8 Hz, 2H), 7.68(ddd, J=14.1, 7.6, 1.1 Hz, 1H), 7.56—7.46(m, 2H), 7.45—7.39(m, 2H), 7.37—7.27(m, 2H), 6.97—6.89(m, 2H), 6.81(d, J=8.4 Hz, 2H), 6.60—6.51(m, 2H), 6.28—6.20(m, 2H), 3.60(s, 2H), 3.52(s, 2H)145.90, 144.89, 139.76(d,J=2 Hz), 139.69, 132.70(d, J=3 Hz), 132.49, 132.18(d, J=3 Hz), 132.03(dd, J=11, 1 Hz), 131.51, 130.54, 130.22, 129.89(d, J=12 Hz), 128.35, 128.21, 127.72, 126.97, 126.85(d, J=5 Hz), 126.68, 125.80(d, J=4 Hz), 123.53, 122.27, 121.99(d, J=6 Hz), 114.81, 114.0318.56
* No reaction.
2 结果与讨论
2.1 反应条件的优化
以N-五氟苯基二苯基膦酰胺和二苯乙炔为模型底物,[RhCp*Cl2]2为催化剂,叔丁醇为溶剂,Ag2CO3为氧化剂,反应温度为110 ℃,在120 W微波条件下对碱进行了筛选,结果列于表3.
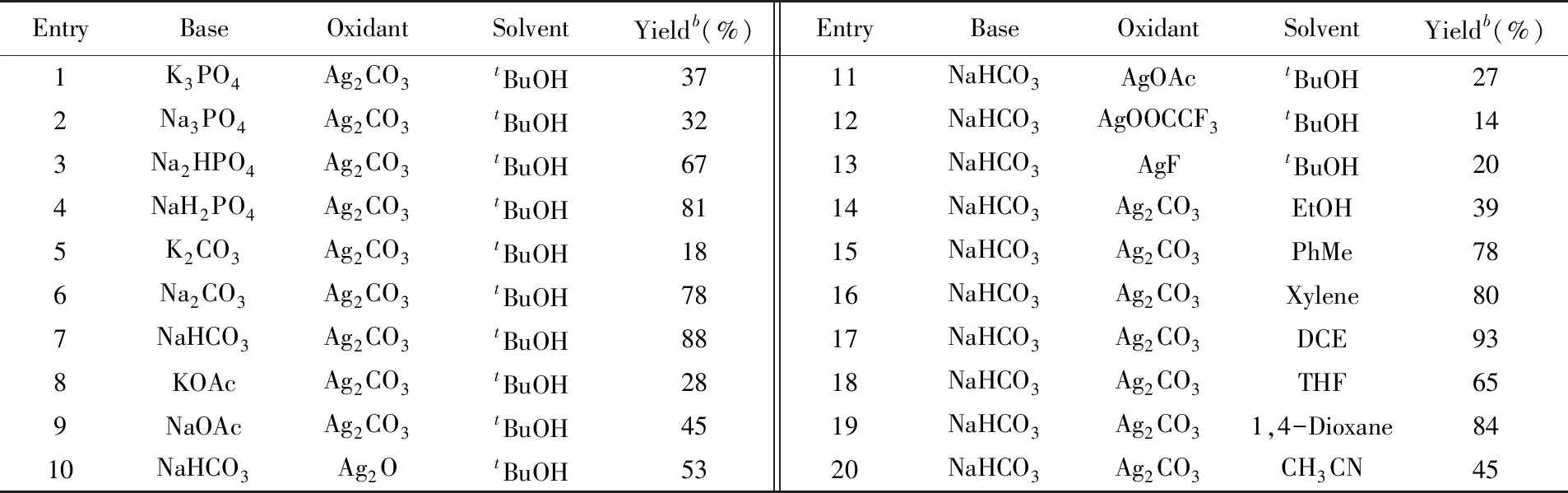
Table 3 Optimization of the reaction conditionsa

当使用K3PO4作为碱时,收率为37%(表3中Entry 1); 用磷酸钠作为碱时,收率略有下降(表3中Entry 2); 使用磷酸氢二钠时,收率提高至67%(表3中Entry 3); 用磷酸二氢钠作为碱时,收率进一步提高至81%(表3中Entry 4); 使用碳酸钾和碳酸钠作为碱时,收率分别为18%和78%(表3中Entries 5和6); 使用碳酸氢钠作为碱时,反应效果最好,收率高达88%(表3中Entry 7); 当用乙酸钾或乙酸钠参与反应时,收率均较低(表3中Entries 8和9).在此基础之上,对反应的氧化剂进行了考察.
当使用氧化银作为氧化剂时,收率下降至53%(表3中Entry 10).尝试使用其它的氧化剂(乙酸银、三氟乙酸银和氟化银)时反应效果均较差(表3中Entries 11~13).溶剂优化结果表明,当使用乙醇时收率下降至39%(表3中Entry 14); 当使用甲苯或二甲苯时收率分别为78%和80%(表3中Entries 15和16); 当使用1,2-二氯乙烷作溶剂时,收率提高至93%(表3中Entry 17); 尝试使用其溶剂,如四氢呋喃、1,4-二氧六环和乙腈,收率没有进一步提高(表3中Entries 18~20).
综上所述,最佳的反应条件是以[RhCp*Cl2]2为催化剂,Ag2CO3为氧化剂,NaHCO3为碱,1,2-二氯乙烷为溶剂,反应温度为110 ℃,微波(120 W)反应15 min.
2.2 底物适用范围
在最佳反应条件下对反应的底物适用性进行了考察,结果见表1.在芳基膦酰胺的苯环上引入各种供电子基团,如甲基、甲氧基或叔丁基时,均能很好适应反应体系,收率为62%~88%(产物3b~3f).苯环上取代基位置的改变对反应的影响较小,如甲基可以在膦酰胺官能团的邻位(产物3b),间位(产物3c)和对位(产物3d).在膦酰胺的苯环上引入各种吸电子基团,如三氟甲基、氟和氯,反应也能很好地进行,收率为68%~87%(产物3g~3i).对二苯乙炔底物的适用范围进行了考察,发现炔烃的苯环上引入各种供电子基团,如甲基甲氧基; 或者引入吸电子基团,如氟、三氟甲基氯,收率为65%~92%(产物3j~3o),其中,苯环上具有2个取代基的炔烃也能与发生C—H活化/环化反应,收率为65%(产物3l).
此外,4-辛炔也是一种较好的反应底物,收率为51%(产物3p).值得注意的是,该反应体系也适用于含有噻吩环的膦酰胺,收率为57%(产物3q).尝试使用含有萘环结构的膦酰胺作为反应底物时,反应不能够发生(产物3r).
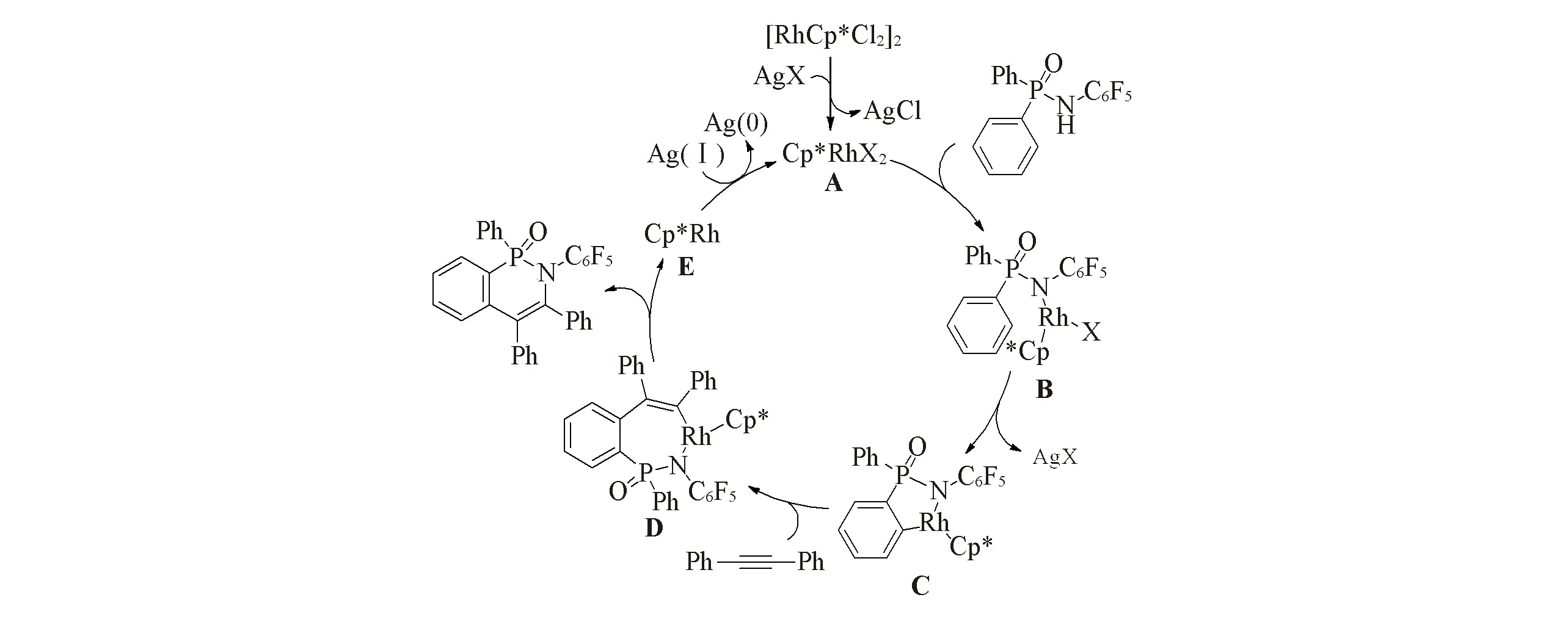
Scheme 3 Proposed mechanism of C—H activation/cyclization
2.3 放大量实验
在最佳的反应条件下进行了放大量实验.结果表明,当N-五氟苯基二苯基膦酰胺的用量扩大到5 mmol(1.916 g)时,也能够与二苯乙炔顺利进行反应,并获得2.373 g目标产物3a,收率为90%.可见,该反应在某种程度上具有潜在的放大效应和应用前景.
2.4 反应机理
在前期工作以及本文实验结果分析的基础上,提出了可能的反应机理[23~25].以N-五氟苯基二苯基膦酰胺与二苯乙炔的反应为例(如Scheme 3所示): 首先,催化剂[RhCp*Cl2]2被Ag(Ⅰ)活化,形成具有催化活性的铑物种Cp*RhX2.随后,Cp*RhCl2与底物的氮原子发生配位生成中间体B; 进一步通过邻位的C—H键断裂,形成五元环状铑络合物C.然后,炔烃与铑络合物C发生配位插入反应,形成七元环状铑络合物D.经过还原消除反应形成产物,并释放出Cp*Rh(Ⅰ).最后,Cp*Rh(Ⅰ)被Ag(Ⅰ)氧化为铑物种Cp*RhX2,完成整个催化循环.
2.5 合成应用
聚酰亚胺是一种性能优良的高分子聚合物材料,其普遍的合成方法是由二胺和二酐制备.因此,设计并合成具有不同结构的二胺单体,对于制备功能各异的聚酰亚胺具有重要研究价值.在最佳的反应条件下,N-五氟苯基二苯基膦酰胺能够与二(4-氨基苯基)乙炔发生反应,以45%的收率获得了具有环状膦酰胺结构的二胺化合物(产物3s).
3 结 论
研究了微波条件下[RhCp*Cl2]2催化二芳基膦酰胺与炔烃的C—H活化/环化反应,以中等到较好的收率获得一系列多氟取代的环状膦酰胺衍生物.该反应无需隔绝空气、操作简便、反应时间短、底物适用范围广泛,并且反应能够进行放大量实验.此合成方法成功应用于具有环状膦结构的聚酰亚胺二胺单体的制备.
支持信息见http:www.cjcu.jlu.edu.cn/20190571.

