含骨脱细胞基质电纺纤维的成骨性能
秦春萍,王先流,唐 寒,易兵成,刘 畅,张彦中
(东华大学化学化工与生物工程学院,上海 201620)
骨组织是人体硬组织的主要构成部分,担负支撑肢体、保护器官、造血、贮钙和代谢等机体功能,是人体最重要的组织器官之一.如果受到创伤、感染和骨肿瘤等引起的骨缺损,将给患者带来严重的生理和心理创伤.尽管骨骼具有自愈和再生能力,但大面积骨缺损仍需骨移植和替代治疗[1,2].目前,临床应用较多的骨移植替代物主要为自体骨和同种异体骨.但自体骨存在来源有限及对供体部位造成二次创伤等缺陷; 而同种异体骨则有免疫反应和携带疾病的风险[3].随着全球人口老龄化加剧,对骨缺损修复的临床需求大大增加.因此,研发人工骨替代物,特别是可诱导骨再生的骨替代物具有重要意义.其中,基于生物材料的骨组织工程技术(BTE)能够构建在组成、结构和功能上高度仿生天然骨的骨组织工程支架,在骨再生修复领域极具应用潜力[1].BTE支架一般应满足合适的力学性能、孔隙率、生物可吸收性和生物相容性等需求[1~4].目前,基于可降解聚合物和骨传导材料(如磷酸三钙和羟基磷灰石等)的骨组织工程支架广泛应用于BTE,而这些材料的生物活性不佳仍然是限制其应用功效的一个主要障碍[5].
近年来,科研工作者开始关注源于天然组织的生物活性材料,尤其是骨组织的衍生物(如脱钙骨和脱细胞骨)在骨组织再生中的作用[6,7].基于组织或细胞的脱细胞基质材料由于保留了天然组织细胞外基质(ECM)的特异性结构和生物活性成分,在应用于多种组织或器官的修复和重建时具有较好的修复和再生功效[8~10].源于骨组织的脱细胞基质(DBM)保留了天然骨组织的结构和生化信号,是一种极具潜力的生物活性材料,并有研究证明DBM具有骨诱导性[6,11,12].近年来,可塑填料、水凝胶和纳米微粒[13~15]等多种形式的DBM广泛应用于生物医学研究或临床实验.但制备方法的不同及供体间差异仍会极大地影响DBM的稳定性和临床表现; 且现有的DBM基支架的制备方法难以调控DBM的理化性能,难以适应不同应用场景[13].因此,发展新型的性能可调控的基于DBM的骨组织工程支架对于增强DBM的应用功效具有重要意义.
静电纺丝技术是一种简单可行的制备纳米纤维支架的方法,由于这种超细纤维结构可仿生天然ECM中的纳米纤维细度,从而影响细胞响应行为,并且纤维的理化性质可通过改变纺丝参数进行调控,因而广泛应用于骨组织工程支架的制备[16~18].由于可以保留合成聚合物的力学性能和可电纺性及天然材料的生物活性等优点,合成-天然材料杂化电纺已成为一种最常见的且简单有效的仿生纤维制备方法[19].Gao等[20]将半月板脱细胞基质(DMECM)与聚己内酯(PCL)共混电纺形成DMECM/PCL纤维,发现DMECM/PCL纤维有利于半月板细胞分泌胶原和糖胺聚糖及促进细胞外基质的有序排列.目前将DBM与电纺纤维结合用于骨组织工程的研究鲜有报道.本文首先制备了DBM,并通过酶消化法使其结构变得松散易于溶解; 通过静电纺丝技术制备了含有DBM的左旋聚乳酸(PLLA)电纺纤维(PLLA/DBM); 研究了PLLA/DBM电纺纤维对骨髓间充质干细胞(BMSCs)的增殖、黏附及成骨分化等行为的影响及体外生物矿化能力.
1 实验部分
1.1 试剂与仪器
新鲜猪股骨,购于上海龙源菜场; 左旋聚乳酸,分子量1×105,济南岱冈生物材料有限公司; 盐酸(HCl),上海凌峰化学试剂有限公司; 无水乙醚(纯度99.7%)、多聚甲醛(纯度95%)、氢氧化钠(NaOH,纯度96%)和十六烷基氯化吡啶(CPC,纯度98%),国药集团化学试剂有限公司; 六氟异丙醇(HFIP),分析纯,上海达瑞精细化学品有限公司; 胃蛋白酶,源于猪胃黏膜,美国Sigma-Aldrich公司; 动物基因组DNA快速抽提试剂盒,生工生物工程股份有限公司; DMEM/F12培养基,杭州吉诺生物医药技术公司; 胎牛血清(FBS)和链霉素/青霉素(P/S),美国Gibco公司; CCK-8试剂,日本同仁化学研究所; 碱性磷酸酶(ALP)试剂盒,南京建成生物工程研究所; 茜素红S染色液(ARS),pH=4.2,北京索莱宝科技有限公司; ALP显色试剂盒,上海碧云天生物技术有限公司; 4′,6-二脒基-2-苯基吲哚(DAPI)染料和鬼笔环肽染料,美国Invitrogen公司; 改良型模拟体液(SBF),无菌,福建飞净生物科技有限公司.
PB100型手持式组织匀浆仪,英国Prima公司; Nanodrop 2000c型分光光度计、MULTISKAN MK3型酶标仪、Nicolet 6700型傅里叶变换红外光谱(FTIR)仪和Quanta 250型环境扫描电子显微镜(ESEM),美国赛默飞世尔科技公司; HE safe1200A2型生物安全柜和HF90型二氧化碳培养箱,力康生物医疗科技控股有限公司; Nikon Ti-2型倒置荧光显微镜,日本Nikon公司; Phenom XL型扫描电子显微镜(SEM),复纳科学仪器有限公司; DSA30型接触角测量仪,克吕氏科学仪器有限公司; TXR1020N30-30型高压电源,大连泰思曼科技有限公司; KDS-100型微量注射泵,美国KD Scientific公司; D/Max2550VB+/PC 型X射线衍射(XRD)仪,日本理学公司.
1.2 DBM的提取与鉴定
将新鲜猪股骨松质骨切碎后在液氮中研磨至颗粒状,置于0.5 mol/L HCl中室温搅拌脱钙72 h,用去离子水洗涤24 h后经乙醇浸泡3.5 h及乙醚浸泡1.5 h进行脱脂,水洗后冻干得到脱钙骨; 将脱钙骨加入少量去离子水中,用手持式组织匀浆仪进行均质; 随后用1 mol/L的NaOH溶液处理3.5 h,于3500 r/min离心10 min,弃去上清液,重复3次以彻底除去NaOH溶液,冻干后研磨得到DBM粉末.
将DBM粉末和脱钙骨颗粒经过石蜡包埋并切片后进行苏木精-伊红(HE)染色和Masson三色染色,在光学显微镜下观察DBM中细胞核的去除情况与骨胶原分布情况.
用动物基因组DNA提取试剂盒提取天然骨组织和DBM中的双链DNA,通过Nanodrop 2000c分光光度计测定DNA含量.
1.3 PLLA/DBM电纺纤维的制备与表征
配制浓度为1 mg/mL的胃蛋白酶-HCl溶液(HCl浓度为0.01 mol/L),将DBM按5 mg/mL的浓度加入到胃蛋白酶-HCl溶液中,室温搅拌,反应48~72 h,使DBM中的蛋白成分在酶消化作用下水解,直至溶液中无肉眼可见的DBM颗粒; 用NaOH溶液调节pH值至7.4,冷冻干燥后获得可溶性DBM; 将PLLA与DBM分别以质量比10∶,0,9∶,1,7∶,3和5∶,5溶于HFIP中,磁力搅拌48 h,直至形成质量分数为8%的稳定、无明显颗粒的纺丝液; 在注射速率为1 mL/h,接收距离为15 cm,电压15 kV条件下进行静电纺丝; 将PLLA/DBM电纺纤维于室温真空干燥72 h以上,以去除纤维中残留的有机溶剂.根据PLLA与DBM的质量比,所得PLLA/DBM电纺纤维分别命名为PLLA/DBM-10/0,PLLA/DBM-9/1,PLLA/DBM-7/3和PLLA/DBM-5/5.
将PLLA/DBM电纺纤维固定在粘有导电胶的扫描电子显微镜样品台上,放入喷金仪喷金90 s,观察PLLA/DBM电纺纤维表面形貌,使用Image J1.44P软件测量纤维直径并分析纤维直径分布情况; 用FTIR光谱表征不同比例PLLA/DBM电纺纤维的组成,扫描波长范围为4000~400 cm-1,分辨率为4 cm-1,扫描次数为128次; 将样品平整铺于接触角载物台上,将3 μL去离子水滴在待测样品上,实时观测接触角变化并拍摄照片.
1.4 PLLA/DBM电纺纤维的生物特性评价
将PLLA/DBM电纺纤维包覆于直径为15 mm的玻片上,经UV光照射2 h、75%乙醇浸泡1 h、无菌PBS清洗3次进行灭菌.选用本课题组提取的大鼠骨髓间充质干细胞(BMSCs)进行细胞实验[21],培养基为含体积分数为15% FBS和1% P/S的DMEM/F12培养基.
将PLLA/DBM-10/0,PLLA/DBM-9/1,PLLA/DBM-7/3和PLLA/DBM-5/5电纺纤维置于24孔板内,选取第4代BMSCs,将胰酶消化后的细胞悬液按每孔2×104Cell的细胞密度接种于24孔板内,用培养基培养,每2 d更换培养基; 分别培养1,4,7 d,用CCK-8试剂检测细胞在纤维上的增殖情况.以种植在空白24孔板(TCP)中的细胞为空白对照.
将PLLA/DBM-10/0和PLLA/DBM-7/3置于24孔板内,选取第4代BMSCs,将胰酶消化后的细胞悬液按每孔5×103Cell的细胞密度接种于24孔板内; 分别培养2和24 h,用4%多聚甲醛固定细胞,先后用鬼笔环肽染液和DAPI染液分别对细胞骨架和细胞核进行荧光染色,随后在倒置荧光显微镜下观察.
将PLLA/DBM-10/0和PLLA/DBM-7/3置于24孔板内,选取第4代BMSCs,将细胞悬液按每孔1×104Cell的细胞密度接种于24孔板内,用培养基培养,每2 d更换1次培养基; 培养7 d时对细胞进行ALP染色,在倒置荧光显微镜下观察细胞的ALP分泌情况; 根据ALP定量试剂盒说明书对细胞ALP活性进行定量检测,于492 nm处测定反应液光密度(OD)值; 培养21 d时对细胞进行ARS染色,然后用10%的十六烷基氯化吡啶(CPC)溶液将染料洗脱,洗脱液于570 nm测定OD值进行染色定量.ALP活性定量和ARS定量结果除以相应时间点对应的细胞CCK-8数值,以消除细胞数量对定量结果的影响.
将PLLA/DBM-10/0和PLLA/DBM-7/3电纺纤维裁剪成5 mm×5 mm的小块,分别置于5 mL改良型模拟体液(SBF)中,于37 ℃摇床中振荡孵育14 d,每天更换SBF; 分别于第7和第14 d时取出纤维,用去离子水清洗后自然干燥; 通过SEM观察纤维表面磷灰石的形成情况.利用X射线衍射仪分析矿化样品的结晶结构,通过ESEM连接的能量色散X射线光谱仪(EDS)分析矿化样品的元素组成.
1.5 统计学分析
所有数据以平均值±标准差(Mean±SD)表示,采用Origin 8.0软件对实验数据进行分析,用单因素方差分析(One way ANOVA)分析数据间是否有显著性差异.当*P<0.05时认为有显著性差异,**P<0.01时认为有极显著性差异.
2 结果与讨论
2.1 DBM的制备与表征

Fig.1 Optical(A1,A2),HE staining(B1,B2) and Masson trichrome staining(C1,C2) images of demineralized bone matrix(A1—C1) and decellularized bone matrix(A2—C2)

Fig.2 DNA content comparison between decellularized bone matrix and the native bone(**P< 0.01)
猪股骨松质骨经过研磨、脱钙及脱脂处理后,变为白色脱钙骨颗粒[图1(A1)].进一步均质、脱细胞后,得到白色粉末状固体DBM[图1(A2)].对脱钙骨和DBM进行组织学染色,HE染色结果[图1(B1)和(B2)]表明脱钙处理后,脱钙骨中仍存在细胞核,但经脱细胞处理后,细胞核几乎被完全去除.由Masson三色染色结果[图1(C1)和(C2)]可见,成熟的骨胶原中有更多二糖苷链,交联度更高,在Masson三色染色中更倾向于着红色; 不成熟的骨质或软骨倾向于着蓝色[22].由Masson三色染色结果可知,经过脱细胞处理后,骨组织中的胶原成分得到保留,且脱细胞前后骨胶原结构没有明显变化.DNA含量检测结果(图2)显示,天然骨组织和DBM中DNA含量分别为(1730.37±602.28)和(8.53±2.21) ng/mg,表明经过脱细胞处理后,与天然骨组织相比,DBM中DNA含量显著下降,且低于以往研究中认可的脱细胞组织中DNA残留含量标准(低于50 ng/mg组织)[23].以上结果表明,本文采用的脱细胞处理方法能够有效去除骨组织中的细胞成分及细胞核,并较好地保留了骨基质中的胶原成分.

Fig.3 SEM images(A—D) and the corresponding diameter distributions(E—H) of PLLA/DBM-10/0(A,E),PLLA/DBM-9/1(B,F),PLLA/DBM-7/3(C,G) and PLLA/DBM-5/5(D,H) electrospun nanofibers
2.2 PLLA/DBM电纺纤维的形貌及性能
DBM经胃蛋白酶消化后,成为分散的胶原纤维,变为透明澄清溶液,用NaOH溶液调节pH值至7.4,冻干后形成的海绵状固体能够均匀分散于HFIP中,形成可电纺溶液.由图3可见,通过电纺可制备PLLA/DBM质量比分别为10∶,0,9∶,1,7∶,3和5∶,5的电纺纤维; PLLA/DBM-10/0,PLLA/DBM-9/1,PLLA/DBM-7/3和PLLA/DBM-5/5电纺纤维呈现较为均一的形貌,直径范围为100~400 nm[平均直径Dav分别为(305±52),(239±36),(221±48)和(169±53)nm].随着DBM比例增加,纤维直径有变细的趋势,这可能是因为DBM分子量较PLLA低,加入后使纺丝液黏度降低,分子链缠结程度较低,聚合物分子链获得较充分的电场力拉伸,使纤维直径变细.
图4(A)为PLLA/DBM电纺纤维和DBM粉末的红外光谱图.图4(A)中1753 cm-1附近的吸收峰为PLLA的酯键中的羰基伸缩振动峰,1640 cm-1附近的吸收峰为胶原成分酰胺键中的羰基伸缩振动峰,1550 cm-1附近的吸收峰为酰胺键中的—N—H弯曲振动峰和—C—N伸缩振动峰[24].结果表明,随着DBM含量升高,1640和1550 cm-1附近的吸收峰出现并增强,证明DBM与PLLA成功复合.
材料亲水性对于细胞的黏附和增殖有重要影响.由图4(B)可见,PLLA表面疏水性较强,不利于细胞黏附[25]; 随着DBM成分的引入,纤维的水浸润性明显增强.这可能是由于DBM中富含氨基及羧基等亲水性基团,因此DBM的引入使纤维表面亲水性增强.研究表明纤维直径可能影响材料的亲水性,纤维直径较小时,材料的比表面积较大,具有吸附介质以降低表面势能的趋势[26].纤维水浸润性的增强有利于后续细胞黏附和生长.

Fig.4 FTIR spectra(A) and water contact angles(B) of PLLA/DBM electrospun nanofibers(A) a.DBM; b.PLLA/DBM-10/0; c.PLLA/DBM-9/1; d.PLLA/DBM-7/3; e.PLLA/DBM-5/5. (B) a.PLLA/DBM-10/0; b.PLLA/DBM-9/1; c.PLLA/DBM-7/3; d.PLLA/DBM-5/5.
2.3 BMSCs在PLLA/DBM电纺纤维上的增殖和形貌
图5给出BMSCs在不同比例PLLA/DBM电纺纤维膜上培养1,4,7 d后的CCK-8检测结果.在各个时间点,各组纤维均能支持BMSCs的增殖.培养1 d时,与PLLA/DBM-9/1和PLLA/DBM-5/5电纺纤维相比,细胞在PLLA/DBM-10/0和PLLA/DBM-7/3电纺纤维上的增殖能力更强; 培养4 d时,PLLA/DBM-7/3电纺纤维对细胞增殖有最明显的促进作用; 培养7 d时,各组电纺纤维上的细胞增殖无显著性差异.以上结果表明,PLLA/DBM能支持BMSCs的增殖,没有细胞毒性,这可能是因为DBM的引入使纤维的亲水性增强,且其主要成分是与成骨相关的活性蛋白,能够为细胞黏附提供位点,促进细胞黏附及增殖等行为[19].在引入DBM的各组纤维中,PLLA/DBM-7/3电纺纤维对细胞增殖的影响较明显,因此选择该样品进行后续实验.

Fig.6 Cell morphologies of BMSCs cultured on PLLA/DBM-10/0(A,C) and PLLA/DBM-7/3(B,D) electrospun nanofibers after 2 h(A,B) and 24 h(C,D)
细胞早期的黏附和铺展对于后续的细胞增殖及分化等行为有重要的影响.对种植在PLLA/DBM-10/0和PLLA/DBM-7/3电纺纤维上2和24 h的细胞进行细胞核-细胞骨架染色,观察细胞在纤维表面的形貌.由图6可见,细胞种植2 h后,PLLA/DBM-10/0电纺纤维上的细胞呈圆形形貌,细胞铺展并不明显; 而PLLA/DBM-7/3电纺纤维上的细胞呈现出多边形形貌,其伪足向四周铺展.细胞种植24 h后,与PLLA/DBM-10/0电纺纤维相比,PLLA/DBM-7/3电纺纤维上的细胞数量更多,且呈现被拉长的形貌.以上结果表明,DBM的加入能够为BMSCs的黏附提供活性位点,有利于细胞铺展,尤其是沿细胞长轴方向的铺展,良好的细胞黏附和铺展行为将对成骨分化有促进作用.
2.4 BMSCs在PLLA/DBM电纺纤维上的成骨分化
将BMSCs分别在PLLA/DBM-10/0和PLLA/DBM-7/3电纺纤维上培养,7 d后进行ALP染色和定量检测; 21 d后进行ARS染色及定量,以研究DBM成分的引入对于BMSCs成骨分化的影响.ALP染色结果[图7(A,B)]表明,两组纤维上的细胞都分泌了碱性磷酸酶,但与PLLA/DBM-10/0电纺纤维相比,PLLA/DBM-7/3电纺纤维上的细胞有更明显的ALP染色阳性.ALP定量结果[图7(C)]与染色结果一致,与PLLA/DBM-10/0电纺纤维相比,PLLA/DBM-7/3电纺纤维上的BMSCs具有更强的ALP活性,证明DBM的引入能够促进BMSCs早期成骨分化.图7(D,E)给出PLLA/DBM电纺纤维上细胞ARS染色结果,PLLA/DBM-10/0电纺纤维上钙沉积较少,而PLLA/DBM-7/3电纺纤维上有明显的大片钙沉积.定量结果[图7(F)]与染色结果一致.以上结果证明,DBM的引入能够促进BMSCs的成骨分化,这可能是因为DBM的主要成分为Ⅰ型胶原,Ⅰ型胶原蛋白可以促进干细胞的成骨分化[27]; 另外,我们推测DBM中或许也含有骨形态发生蛋白家族(BMPs)的生长因子,能够通过WNT信号通路诱导成骨分化[28].

Fig.7 ALP staining(A,B), quantified ALP activity(C,**P<0.01),ARS staining(D,E) and ARS quantification(F,**P<0.01) of BMSCs cultured on PLLA/DBM electrospun nanofibers(A),(D) PLLA/DBM-10/0; (B),(E) PLLA/DBM-7/3.
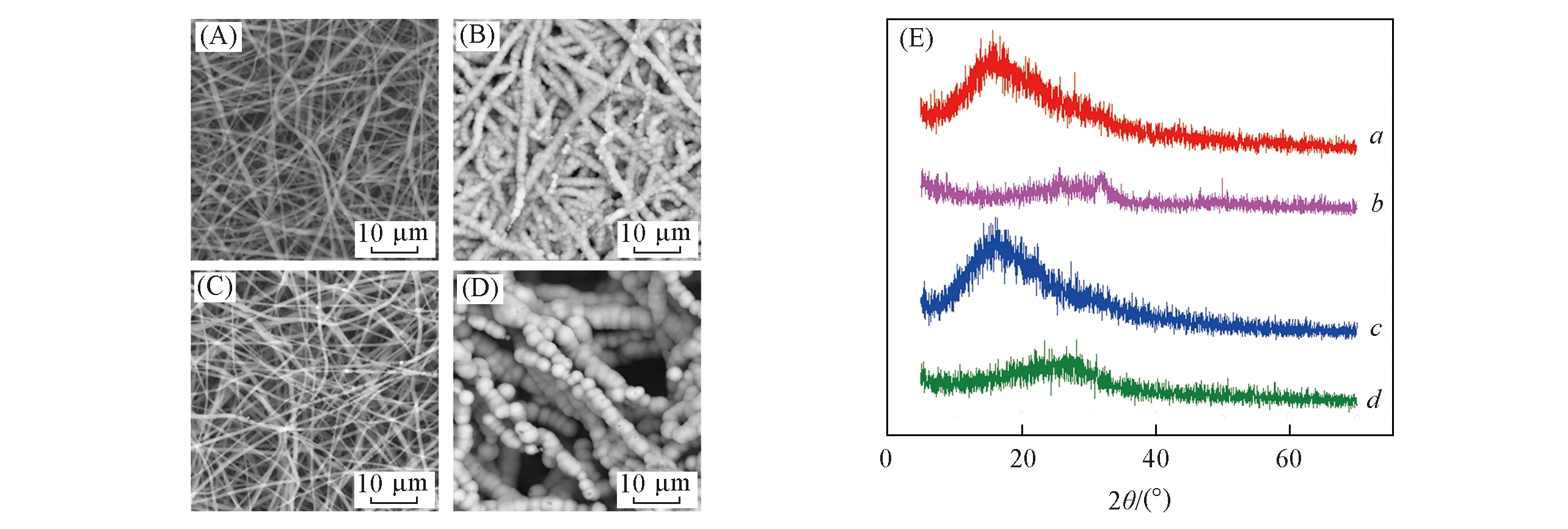
Fig.8 SEM images(A—D) and XRD patterns(E) of PLLA/DBM electrospun nanofibers after being incubated in SBF(A) PLLA/DBM-10/0,7 d; (B) PLLA/DBM-7/3,7 d; (C) PLLA/DBM-10/0,14 d; (D) PLLA/DBM-7/3,14 d.(E) a.PLLA/DBM-7/3; b.PLLA/DBM-7/3 after mineralization for 14 d; c.PLLA/DBM-10/0; d.PLLA/DBM-10/0 after mineralization for 14 d.
2.5 PLLA/DBM电纺纤维的生物矿化
通过将生物材料置于含有与人体血浆相近离子浓度的模拟体液(SBF)中孵育,检测材料表面磷灰石的形成情况,从而预测材料植入体内后的骨结合能力,减少实验动物的使用并缩短实验周期[29].将PLLA/DBM-10/0和PLLA/DBM-7/3电纺纤维分别置于SBF中孵育7和14 d,取出,通过SEM观察纤维表面的矿化情况,并通过XRD及EDS对纤维表面的矿化进行结构和元素分析.由图8(A—D)可见,矿化7 d时,PLLA/DBM-7/3电纺纤维上有明显的磷灰石沉积,并且磷灰石沿纤维方向生长,没有使纤维完全失去表面形貌; 而PLLA/DBM-10/0电纺纤维上仅有少量磷灰石沉积.矿化14 d时,磷灰石在PLLA/DBM-7/3电纺纤维上进一步沿纤维生长; 而PLLA/DBM-10/0电纺纤维上的矿化仍不明显.XRD结果[图8(E)]显示,矿化后的PLLA/DBM-7/3电纺纤维在26°和32°出现衍射峰,为羟基磷灰石的特征衍射峰,而PLLA/DBM-10/0电纺纤维中并未出现与羟基磷灰石吻合的衍射峰.EDS结果(表1)显示矿化14 d后,PLLA/DBM-10/0电纺纤维上仅含有少量Ca和P元素,几乎可以忽略不计; 而PLLA/DBM-7/3电纺纤维上的Ca和P元素分别达到10.43%和18.6%,Ca/P比值为1.78,接近天然羟基磷灰石的Ca/P比值(1.67).研究表明,胶原蛋白能够作为模板诱导磷灰石在其表面成核,形成矿化沉积[30].以上实验结果表明,DBM的引入确实有利于电纺纤维的生物矿化,可以预测其植入体内后能与天然骨有良好的融合,促进骨再生.

Table 1 Chemical composition of PLLA/DBM electrospun nanofibers after beingincubated in SBF by EDS analysis
3 结 论
通过脱细胞技术制备了DBM,再通过胃蛋白酶消化使DBM变为可溶形式,将可溶性DBM与PLLA共混电纺成功制备了PLLA/DBM电纺纤维,DBM含量最高可达50%.DBM的引入不会明显影响纤维形貌,各比例电纺纤维具有均一的形貌,且随着DBM的含量升高,纤维的水浸润性增强.含有DBM的纤维有利于BMSCs的黏附和铺展,无细胞毒性,ALP染色、定量及ARS染色及定量实验结果表明含有DBM的纤维有利于BMSCs向成骨分化.含有DBM的纤维能够在SBF中形成矿化层,可以预测其在体内具有良好的骨结合性.

