改良小鼠胚胎下颌下腺的获取及其体外器官培养模型的建立
刘志凯 乔翔鹤 苟黎明 李春洁
1.口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心 四川大学华西口腔医院头颈肿瘤外科,成都 610041;
2.口腔疾病与生物医学重庆市重点实验室 重庆医科大学附属口腔医院,重庆 401147
分支形态发生过程可见于哺乳动物的多种器官发生及发育过程中,这一分支形态的形成对于保证器官可以在有限的体积内获得最有效的功能形态具有重要意义,这一过程在多种器官(如肾、肺、下颌下腺等)中的具体发生及发展过程的研究已取得长足的进展[1-3]。最初对于这一过程的研究多是利用体内各发育阶段的器官进行组织切片及免疫组化染色来进行观察,但体外切片染色具有切片难度较大、形态不易维持等缺点。随着体外器官培养技术的发展,可以利用体外器官培养模型进行研究,便于直接地对相应器官上皮系统分支形态发生的具体过程进行连续地观察和干预[4]。
下颌下腺是研究器官分支形态发生过程的重要模型,在小鼠胚胎中获取下颌下腺组织进行体外器官培养是一种重要的研究方法。小鼠下颌下腺位于小鼠下颌骨内侧稍下方,解剖皮肤及筋膜即可见(如图1所示)。对妊娠13 d(E13)的小鼠胚胎而言,其唾液腺组织处于发育初期,始见5~6个初始分支[5]。两侧腺体位于下颌体与下颌角转折处内侧,紧贴于舌根两侧,表面有下颌皮肤及软组织覆盖,因此较难定位及分离。本研究对小鼠胚胎下颌下腺的获取方法进行改良,以有效地定位腺体组织,降低腺体获取的难度,保证获取腺体的完整性,为培养奠定基础;同时建立小鼠胚胎下颌下腺的体外器官培养模型,以对其在体内发育过程中的分支形态发生过程进行更好体外的模拟。

图 1 胚胎下颌下腺解剖位置(舌腹侧)Fig 1 Position of the embryonic submandibular salivarygland (ven- tral tongue side)
1 材料和方法
1.1 实验动物、主要试剂、器械及设备
实验动物为健康清洁级适龄(6周~4月龄)ICR小鼠(雄性∶雌性为1∶2,由成都达硕实验动物公司提供)。解剖显微镜(Nikon公司,日本),显微弯镊,尖端直径为0.05 mm×0.02 mm的显微直解剖镊及尖端直径为0.05 mm×0.01 mm的显微直解剖镊各2个(Dumont公司,瑞士),眼科剪,11号手术刀片及手术刀柄,纹式血管钳4个。灭菌橡胶手套、防护服、口罩、帽子等。
DMEM/F12培养液,青霉素溶液,链霉素溶液,L-抗坏血酸(Sigma公司,美国),小牛转铁蛋白(北京索莱宝科技有限公司),100 mm普通培养皿及50 mm玻底培养皿若干,Whatman Nuclepore Track-etch Membranes滤膜(直径13 mm,孔径0.1 μm,Whatman公司,英国),二氧化碳培养箱,pH试纸或pH计,碳酸氢钠,其他如移液器、移液器枪头、容量瓶、量筒、天平等实验室常用仪器。
1.2 ICR小鼠自然交配获得小鼠胚胎
给予ICR小鼠恒定的光照—黑暗周期,待ICR小鼠适应环境后(5~7 d),在光照周期结束前选择发情期雌鼠与雄鼠合笼(1只雄鼠与2只雌鼠),第二天上午8:00~9:00检查阴道栓,发现阴道栓者自笼中取出单独饲养,并将发现阴道栓的当日早晨记为怀孕第0天(E0)。
1.3 获取小鼠胚胎下颌下腺
1.3.1 制备暂时存放组织用的储存用培养基 在DMEM/F12液体培养基中,加入青霉素溶液和链霉素溶液,使其最终浓度分别达到100 U·mL-1和100 μg·mL-1,存储于4 ℃冰箱中。
1.3.2 游离子宫 以颈椎脱位法处死E13的怀孕ICR小鼠,75%乙醇浸泡消毒小鼠胸腹部,在小鼠腹部中线由耻骨联合直线剪开皮肤、肌肉及腹膜,暴露腹腔至剑突下方,牵开腹部皮肤及肌肉显露子宫,以小弯钳抬起子宫,剪刀剪开并分离子宫系膜游离子宫,在此过程中防止挤压子宫及胚胎,将游离出的包含胚胎的子宫置于盛有25 mL储存用培养基的100 mm培养皿中暂存(4 ℃,下同)。
1.3.3 游离胚胎 以显微直解剖镊打开子宫壁,并小心将胚胎从子宫分离,此过程中为了防止挤压损伤下颌下腺,操作时应夹持远离下颌下腺的组织部分,将游离出的胚胎置于盛有25 mL储存用培养基的100 mm培养皿中暂存。
1.3.4 获取胚胎下颌组织(显微镜下操作) 将胚胎置于解剖显微镜下,调节至适当放大倍数,侧向放置胚胎,以直镊固定胚胎体部,自颈部与颏部之间切下胚胎头部,再于口裂处舌头上方自前向后由平行于下颌长轴的方向切下下颌组织(主要包含麦克尔软骨、舌、下颌下腺、舌下腺、脊髓颈段及少量其他软组织),将切下的下颌组织置于盛有3 mL储存用培养基的35 mm培养皿中暂存。
1.3.5 获取胚胎下颌下腺(显微镜下操作) 传统方法为正中联合处向后分离下颌骨,最后留下的组织主要包含舌及下颌下腺。但此方法在旋转分离下颌骨及周围组织时,极易因组织间粘连使得下颌下腺与下颌组织一同分离,从而不能获得下颌下腺组织,降低获取成功率。本研究对此方法进行改良(如图2所示),舌尖指向十二点钟方向后,颈部皮肤及软组织失去张力向下颌前部退缩,以颈总动脉断裂后出血点为定位点,所需要的下颌下腺组织即在定位点正下方,通常镜下直接可见。首先将下颌下腺周围软组织粘连稍作分离,整个操作过程中应防止损伤下颌下腺腺体。随后从下颌下腺外侧离断下颌骨,两侧向前旋转分离,在不完全分离下颌骨的前提下即可见游离的下颌下腺。游离后从导管处将腺体锐性分离即可得到下颌下腺组织。这种方法获取下颌下腺组织的成功率较高,且获得的腺体更为完整。

图 2 改良的小鼠胚胎下颌下腺获取方法(从游离胚胎开始)Fig 2 Improved method for obtaining submandibular gland of embryo (starting from freeing embryo)
1.4 体外培养胚胎下颌下腺
1.4.1 制备培养下颌下腺用的培养用培养基 将储存用培养基在使用前即时加入L-抗坏血酸和小牛转铁蛋白,使其最终浓度分别达到150 μg·mL-1和50 μg·mL-1。
1.4.2 体外培养胚胎下颌下腺 将Whatman滤纸光面朝上,以镊子夹持将其漂浮于盛有200 μL培养用培养基的50 mm玻底培养皿中;用钳子将下颌下腺小心置于滤纸上(将腺体置于一滴培养液中,水平张开镊子然后慢慢合拢,借助液体的表面张力将液体及腺体同时抬起),将培养皿置于37 ℃、5%CO2的培养箱中,每隔24 h更换培养液,培养3 d或根据实验内容选择需要培养时长。培养24、48、72 h后,利用配备尼康摄像系统的倒置显微镜拍照记录下颌下腺分支形成情况。
2 结果
通过小鼠自然交配后怀孕,1只孕鼠可获得的胚胎数量不一,多为6~8枚,多者可达10枚以上,而同一胎中各胚胎发育程度并不完全一样。本文通过对胚胎下颌下腺进行了体外培养,为保证腺体生长营养供给,1张滤膜上最多放置培养6枚下颌下腺。
获得的所谓下颌下腺组织其实包含下颌下腺及舌下腺,二者通常难以分开,在玻底培养皿中培养时在倒置显微镜下可以看到舌下腺稍小,上皮芽较少,E13的胚胎中常只有1个上皮芽出现,与下颌下腺紧密相邻(此时的下颌下腺一般已有3~5个上皮芽)。刚解剖出的下颌下腺放在滤膜上经倒置显微镜观察时可见腺体形态尚未舒展,部分区域可见上皮芽组织重叠,而培养约2 h后,上皮芽形态尚未有明显变化,但腺体形态铺展开来,更有利于对其形态的观察和对上皮芽进行计数,故本实验中将解剖出来的腺体经滤膜法培养2 h后再行计数比较。
通过观察发现,体外培养的下颌下腺上皮分支形态发生过程即使在体外培养条件下仍然是十分活跃的。体外培养的下颌下腺可培养至72 h,若继续培养上皮芽数量将继续增加,但相互之间的重叠也将进一步加重,不利于计数观察。大多数腺体72 h后上皮分支数量仍会继续增加,但未见明显导管腔隙或腺泡腔形成。E14胚胎或稍更大的胚胎获得的下颌下腺腺体部分培养72 h后可见导管形成(图3、4)。在建立体外培养模型的过程中,部分下颌下腺存在形态溶解的现象,原因可能与培养时携带过多血液有关(如图3所示)。
3 讨论
唾液腺作为维持口腔正常功能的重要器官,其分泌唾液的功能在口腔卫生与食物消化方面具有重要作用。唾液腺损伤后的功能恢复与重建是研究的一个重要方向,而胚胎唾液腺的发育及其影响因素对下颌下腺功能重建具有积极意义[6-7]。同时,下颌下腺作为一个良好的研究模型是开展相关研究的重要基础[8]。国外相关的研究在20多年前就已开展[9],Sakai等[10]在2008年对胚胎相关的器官的培养进行了总结。国内的相关研究近年来有逐渐开展[11],但研究仍较少,其中胚胎器官的获取及培养的困难性是妨碍研究开展的重要因素。

图 3 培养不同时间的下颌下腺组织情况 倒置显微镜 × 40Fig 3 Submandibular gland tissue cultured for different times inverted microscope × 40
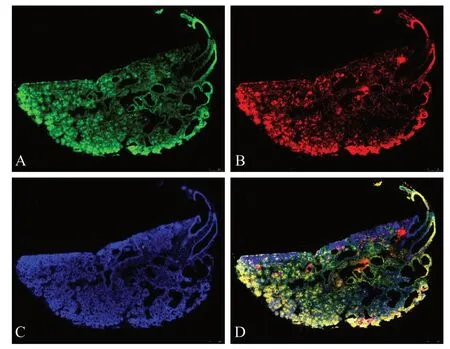
图 4 培养72 h的下颌下腺组织 免疫荧光染色 × 35Fig 4 Submandibular gland tissue cultured after 72 h immuno- fluorescent staining × 35
本文对传统的胚胎下颌下腺获取及培养方法进行改良,相较于传统的从下颌前部分离旋转的方法,采用腺体两侧旋转分离,能够有效地避免传统方法中腺体随颌骨一起被分离,造成不能获得腺体组织的结果,从而提高了腺体获取的成功率和腺体组织的完整性。而在获取后的培养过程中,通过加入各种发育相关影响因子的刺激,可在显微镜下直接观察到腺体发育情况。与从胚胎获取组织进行切片及免疫组化实验的方法相比,体外器官培养的方法结果观察更为直观,不易受切片及染色技术等因素的影响。但此方法不能对特定的分子进行定位,有一定的局限性。
E13胚胎下颌下腺一般已有3~5个上皮芽,同一胎中下颌下腺上皮分支最少者可仅出现2~3个上皮芽,处于E12左右的发展阶段。以往研究中常采用E12或E12.5的胚胎获取下颌下腺,然而实际操作中E12左右的胚胎下颌下腺因组织脆嫩黏稠而解剖困难,故最终本研究采用E13左右的胚胎下颌下腺进行实验。E13胚胎下颌下腺组织培养72 h后少见导管形成(如图4所示),而E14或孕期更长的胚胎腺体部分培养72 h即可见导管组织,推测原因可能是胚胎在孕鼠体内时间更长,下颌下腺导管上皮发育更为充分,使其在体外能够生长,具体原因仍待进一步研究。
本研究还发现,部分下颌下腺在培养24 h后出现了腺体形态溶解的情况,之前的体外培养研究中未提及此种现象。笔者认为出现这种情况的原因,可能是在获取下颌下腺组织的过程中,携带了过多的血液进入培养基。培养24 h后,红细胞破裂溶解,其内含有的相关组织溶解酶将腺体基质和腺泡溶解,造成腺体形态破坏消失。因此在获取下颌下腺的过程中,应将获得的组织与储存的胚胎分开保存,避免携带过多的血液进入下颌下腺培养基。
本文介绍了小鼠胚胎下颌下腺的体外器官培养模型的建立过程,改良了目前已有的胚胎下颌下腺获取方法,使得小鼠胚胎下颌下腺更容易获取;同时体外器官培养模型的建立,使得更直接地研究小鼠颌下腺发育及相关影响因素成为可能,为之后其他下颌下腺发育相关研究奠定基础。
利益冲突声明:作者声明本文无利益冲突。

