牛蛙腐皮病病原菌分离鉴定及药敏试验
戚建华 刘韵怡 童文涛 肖翎 赵祯 宋增福


摘要:【目的】明确浙江嘉善某养殖场引起牛蛙腐皮病的致病菌,并探究益生菌与牛蛙腐皮病病原菌间的相互作用,为今后利用益生菌防控牛蛙腐皮病的发生提供技术支持。【方法】通过常规的细菌分离纯化、人工回归感染试验、生理生化特性鉴定及16S rDNA序列扩增,确定引起牛蛙腐皮病的致病菌;根据药敏试验筛选抗菌药物,并从生物防控的角度探究枯草芽孢杆菌等益生菌与致病菌间的相互作用。【结果】从患病牛蛙的内脏及体表溃烂处共分离获得9株疑似致病菌株,经人工回归感染试验确定菌株NWt-2为引起牛蛙腐皮病的致病菌;综合其形态学特征、生理生化特性及分子生物学鉴定结果,可确定菌株NWt-2为布韦不动杆菌(Acinetobacter bouvetii)。菌株NWt-2对丁胺卡那、庆大霉素、哌拉西林、头孢氨苄和硫酸阿米卡星等5种抗菌药物高度敏感,对青霉素、复方新诺明、诺氟沙星、氟苯尼考、复方磺胺嘧啶、盐酸林可霉素和盐酸大观林可霉素等7种抗菌药物不敏感(耐药)。浓度为105 CFU/mL的枯草芽孢杆菌和紫色杆菌对菌株NWt-2有一定的抑制作用,抑菌圈直径分别为1.45±0.46和0.97±0.38 mm。【结论】布韦不动杆菌是引起浙江嘉善养殖牛蛙发生腐皮病的致病菌,可选用丁胺卡那、庆大霉素、哌拉西林、头孢氨苄和硫酸阿米卡星等抗菌药物进行防治。鑒于枯草芽孢杆菌对布韦不动杆菌具有一定的抑制效果,在当前病原菌对抗菌药物普遍存在耐药性的情况下,选择枯草芽孢杆菌等益生菌进行生物防控具有可行性。
关键词: 牛蛙;腐皮病;布韦不动杆菌;枯草芽孢杆菌;药敏试验
中图分类号: S947.2 文献标志码: A 文章编号:2095-1191(2020)02-0461-09
Isolation and identification of the pathogen of rot skin disease in Rana catesbiana and its drug sensitive test
QI Jian-hua1,2, LIU Yun-yi1,2, TONG Wen-tao1,2, XIAO Ling1,2,
ZHAO Zhen1,2, SONG Zeng-fu1,2*
(1National Demonstration Center for Experimental Fisheries Science Education (Shanghai Ocean University), Shanghai 201306, China; 2National Pathogen Collection for Aquatic Animals(Shanghai Ocean University), Shanghai 201306, China; 3Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education(Shanghai Ocean University), Shanghai 201306, China)
Abstract:【Objective】The bacterial pathogen of bullfrog(Rana catesbiana) rot skin disease in a farm of Jiashan, Zhejiang was determined, and the interaction between probiotics and bullfrog rot skin pathogens was explored to provide technical support for the use of probiotics to prevent and control bullfrog rot skin disease in the future. 【Method】Using conventional bacterial isolation and purification, artificial regression infection test, physiological and biochemical characteristics identification and 16S rDNA sequence amplification to determine the pathogenic bacteria that caused bullfrog rot skin disease. According to drug sensitivity tests, the antibacterial drugs were screened, and explored the interaction between probiotics such as Bacillus subtilis and pathogenic bacteria from the perspective of biological control. 【Result】Nine suspected strains were isolated from the viscera and body ulcers of the diseased bullfrog, and the artificial regression infection test determined that the strain NWt-2 was the pathogenic bacteria causing bullfrog rot skin disease. The strain NWt-2 was identified as Acinetobacter buvestris based on the morphological characteristics, physiological and biochemical characteristics and molecular biological identification results. The results of drug sensitivity test showed that the strain NWt-2 was highly sensitive to five antibacterial drugs such as amikana, gentamicin, piperacillin, cefalexin and amikacin sulfate; it was insensitive or resistant to seven antibacterial drugs such as penicillin, compound neonomine, norfloxacin, flufenicol, compound sulfadiazine, lincomycin hydrochloride and spectomycin hydrochloride. B. subtilis and Chromobacterium violaceum at a concentration of 105 CFU/mL had certain inhibitory effect on the strain NWt-2, and the diameter of the inhibition zones respectively were 1.45±0.46 and 0.97±0.38 mm. 【Conclusion】A. buvestris is a pathogenic bacteria that causes rot skin disease in Jiashan, Zhejiang. Antibacterial drugs such as amikacin, gentamicin, piperacillin, cephalexin and amikacin can be selected for prevention and treatment. In view of the certain inhibitory effect of B. subtilis on A. buvestris, under the condition that the pathogens are generally resistant to antibacterial drugs, it is feasible to select probio-tics such as B. subtilis for biological control.
Key words: Rana catesbiana; rot skin disease; Acinetobacter buvestris; Bacillus subtilis; drug sensitivity test
Foundation item:Shanghai Collaborative Innovation Center Fund Project(ZF1206); Nanjing Entrepreneurship Ta-lent 321 Project (D-8005-14-0005)
0 引言
【研究意义】牛蛙(Rana catesbiana)属于大型可食用蛙类,其肉质洁白细嫩、味道鲜美、营养丰富,是一种高蛋白、低脂肪、低热量、低胆固醇的营养保健食品,且牛蛙的皮、油、激素、腺体和胆汁等可作为工业、养殖业及医药业等行业的原材料,而具有极高的应用价值(高博,2017)。牛蛙是我国特种水产养殖的主要经济动物之一,其年销售量已超过15万t(Zhang et al.,2015)。与其他水产养殖动物一样,高密度养殖模式是多种疾病发生的诱因,严重阻碍了牛蛙养殖业的健康发展(杨春浩,2010;高博,2017)。饲养过程中应尽量降低养殖密度,避免因拥挤摩擦而造成体表破损,且要定期对养殖水质和环境进行消毒,减少疾病发生。但随着牛蛙放养密度不断增加和水体养殖环境的污染,蛙类腐皮病的发生越来越频繁,危害越来越严重,加之养殖户对抗生素的不合理使用,增强了病原菌的耐药性,且多重耐药菌株逐渐增多,致使细菌性病害防控难度增加。因此,寻找抗生素替代物是发展牛蛙绿色生态养殖的必然趋势。【前人研究进展】目前已报道的牛蛙疾病主要有由虹彩病毒等引起的病毒病(刘晓东等,2012),由车轮虫(Trichodina)、舌杯虫(Apiosoma)、斜管蟲(Chilodonella)和锚头蚤(Lernaea)等引起的寄生虫病(李巧玲等,2018),以及由假单胞菌(Pseudomonadaceae)、气单胞菌(Aeromomas)、爱德华氏菌(Edwardsiella)、链球菌(Streptococcus)、葡萄球菌(Staphylococcus)、变形菌(Proteus)、不动杆菌(Acinetobacter)、伊丽莎白菌(Elizabethkingia)和耶尔森氏菌(Yersinia)等引起的细菌性疾病(尹伦甫和陈公立,2010;杭小英等,2012;于喆等,2013;韩艳楠等,2016)。由于病原菌种类繁多,病因复杂且传播速度快、死亡率高等特点,在牛蛙疾病中以细菌性病害的危害最严重,是牛蛙养殖疾病防控的主要对象(卜令飞等,2019)。其中,腐皮病是牛蛙养殖过程中最常见的疾病,发病初期牛蛙头部和背面皮肤失去光泽,体色发黑,接着皮肤开始脱落腐烂,露出肌肉,随后腐烂区域逐渐扩散至整个背部;严重时指骨和颌骨外露,死亡率极高(卢仲春,1997)。牛蛙腐皮病可分为营养性腐皮病和创伤性腐皮病,其中,营养性腐皮病是由于长期摄食缺乏维生素饲料所导致,而创伤性腐皮病是因牛蛙相互撕咬、碰伤导致体表皮肤破损致使病原菌侵入引起发病(卢仲春,1997)。创伤性腐皮病因病原菌复杂多样,是牛蛙腐皮病防治的主要对象,且此病常与由嗜水气单胞菌(A. hydrophila)引起的红腿病并发,给牛蛙养殖业带来巨大经济损失(舒新华,1997a)。益生菌(Probiotics)作为一种具有多种生物功能的活菌制剂,不仅可避免使用抗生素产生的耐药性等副作用,达到防病治病的效果,还能促进养殖品种生长,已广泛应用于动物养殖生产(王源等,2018)。在目前研究较广泛的益生菌中,戊糖片球菌(Pediococcus pentosaceus)和短乳杆菌(Lactobacillus brevis)对唾液链球菌(S. salivarius)具有很好的抑制作用(Taheur et al.,2016),而双歧杆菌(Bifidobacterium)和乳酸菌(Lactobacillus)对大肠杆菌(Escherichia coli)具有较强的抑菌活性(Abdelhamid et al.,2018)。【本研究切入点】近年来,浙江嘉善牛蛙养殖场的牛蛙因皮肤腐烂而造成大批死亡,经济损失严重,因此急需明确其病因并采取有效的防治措施,以确保牛蛙养殖业的健康发展。【拟解决的关键问题】对浙江嘉善某牛蛙养殖场患腐皮病的牛蛙进行病原菌分离鉴定及药敏试验,并从生物防控的角度探究枯草芽孢杆菌(Bacillus subti-lis)等益生菌与牛蛙腐皮病病原菌间的相互作用,为今后利用益生菌防控牛蛙腐皮病的发生提供技术支持。
1 材料与方法
1. 1 试验材料
患腐皮病牛蛙由浙江嘉善某牛蛙养殖场送检,体重200~300 g/只;健康牛蛙购自浙江嘉善,体重150~250 g/只,共100只,活力良好,体表无损伤,置于水温为26 ℃的水族箱中暂养2周,观察确认无发病、死亡现象后用于后续试验。LB培养基购自生工生物工程(上海)股份有限公司;丁胺卡那、庆大霉素、四环素、哌拉西林、羧苄西林、头孢氨苄、青霉素、复方新诺明和诺氟沙星9种药敏纸片购自杭州天和微生物试剂有限公司,盐酸大观林可霉素、恩诺沙星溶液、氟苯尼考粉、复方磺胺嘧啶粉、盐酸林可霉素和硫酸阿米卡星6种药物购自广州白云山宝神动物保健品有限公司;麦氏浊度管购自深圳康泰生物制品股份有限公司;枯草芽孢杆菌、地衣芽孢杆菌(B. licheniformis)、蜡状芽孢杆菌(B.cereus)和紫色杆菌(Chromobacterium violaceum)益生菌由上海海洋大学微生物教研室提供。主要仪器设备:恒温培养振荡器(ZWY-240,上海智城分析仪器制造有限公司),生化培养箱(SPX-150B-Z,上海博迅实业有限公司),电热恒温鼓风干燥箱(DHG-9140A,上海一恒科技有限公司),Hirayama高压灭菌锅(HVE-50,广州华粤行仪器有限公司),光学显微镜(Olympus BX53F,上海启步生物科技有限公司)。
1. 2 试验方法
1. 2. 1 病原菌分离与纯化 选取患病牛蛙,用无菌水清洗其体表,再以75%酒精棉球反复擦拭,无菌操作下打开腹腔并采集肝脏、肠道、眼及体表溃烂组织,划线接种于LB培养基上,28 ℃培养24 h。挑取LB培养基上形态特征一致的优势单菌落划线分离,28 ℃培养24 h。
1. 2. 2 人工回归感染试验 将分离纯化的菌株分别转接至LB液体培养基中,28 ℃培养24 h。菌液在4 ℃下5500 r/min离心10 min,弃上清液,菌体沉淀加9 mL生理盐水振荡重悬后再次离心,重复3次。与麦氏浊度管比对,加入生理盐水制成浓度为6×108 CFU/mL的菌悬液。人工回归感染试验在52 cm×34 cm×44 cm的水族箱中进行,每组10只健康牛蛙,感染组用无菌注射器在牛蛙右侧腿部肌肉注射0.2 mL菌悬液,对照组注射等量生理盐水。试验过程中观察记录牛蛙发病症状,发现濒死牛蛙及时取出解剖,并对病灶区进行细菌分离。
1. 2. 3 生理生化特性鉴定 按细菌生化微量鉴定管说明对分离菌株进行生理生化特性鉴定。
1. 2. 4 病原菌鉴定 将人工感染试验中牛蛙死亡数最多的感染组病原菌从保存斜面培养基转接至LB培养基上,28 ℃培养24 h后观察菌落形态特征并进行革兰氏染色。同时将初步分离获得的疑似致病菌及人工感染试验分离得到的菌株分别接种于LB液体培养基中,28 ℃培养16~20 h,取1.5 mL菌液置于2.0 mL离心管中,4 ℃下12000 r/min离心2 min,弃上清液,菌体沉淀送至上海迈浦生物科技有限公司提取DNA,采用通用引物27F(5'-AGAGTTTGATC CTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTA CGACTT-3')进行PCR扩增,凝胶电泳检测扩增得到的16S rDNA序列。
1. 2. 5 药敏试验 从保存斜面培养基上挑取病原菌菌落接种于LB液体培养基中增菌培养24 h,然后将菌液稀释至107 CFU/mL,取100 μL菌液均匀涂布于营养琼脂培养基上,室温下干燥3~5 min,用无菌镊子将11种抗菌药物纸片均匀贴于培养基表面,每种药物设3组重复,28 ℃培养24 h后以游标卡尺测量抑菌圈直径,并记录数据。同时,参照张浩等(2018)的研究方法将盐酸林可霉素、恩诺沙星溶液、氟苯尼考粉等常用的蛙类疾病防治药物制成简易药敏纸片,观察记录其对病原菌的抑菌效果。
1. 2. 6 与益生菌间相互作用 将培养24 h的病原菌和枯草芽孢杆菌、地衣芽孢杆菌、蜡状芽孢杆菌及紫色杆菌均稀释至105 CFU/mL,在枯草芽孢杆菌菌液、地衣芽孢杆菌菌液、蜡状芽孢杆菌菌液和紫色杆菌菌液中分别加入灭菌药敏纸片,取出备用。无菌操作下,吸取100 μL病原菌菌液均匀涂布于LB培养基上,室温下干燥3~5 min,用无菌镊子将益生菌纸片均匀贴于培养基表面,各纸片距离不小于24 mm,每个培养基贴4片,设3组重复。将培养皿置于28 ℃培养箱中培养24 h后观察抑菌效果,并用游标卡尺测量记录抑菌圈直径。
1. 3 统计分析
试验数据采用Excel 2013进行整理统计,并以SPSS 17.0进行单因素方差分析(One-way ANOVA)。
2 结果与分析
2. 1 病原菌分离培养结果
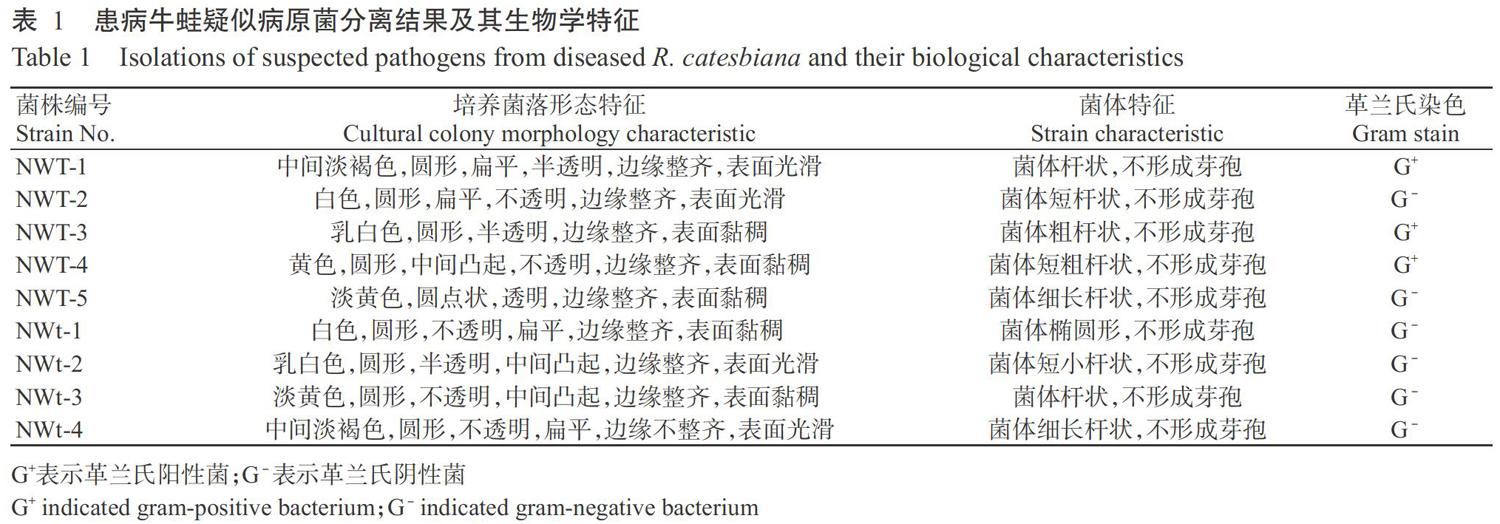
自然发病牛蛙体色发黑,头部及腿部关节处皮肤腐烂可见肌肉,剖解发现其肝脏呈红棕色(图1)。从患病牛蛙的内脏及体表溃烂处共分离获得9株疑似致病菌株,依次编号为NWT-1、NWT-2、NWT-3、NWT-4、NWT-5、NWt-1、NWt-2、NWt-3和NWt-4,各分离菌株的生物学特征详见表1。
2. 2 人工回归感染试验结果
人工回归感染试验结果(表2)显示,注射菌株NWt-2的牛蛙在第2 d开始出现死亡,至第7 d该处理组牛蛙全部死亡,且在其注射部位出现皮肤充血、发炎等症状,剖解发现牛蛙的肝脏肿大且呈红棕色,胃部胀气,部分牛蛙还出现关节肿大、腹腔积水肿胀等症状,与自然发病牛蛙的病症相似。对照组及注射其他分离菌株的牛蛙均未表现出明显病症,且死亡牛蛙数较少或未发生死亡现象。
2. 3 病原菌鉴定结果
2. 3. 1 病原菌的菌落形态观察及镜检结果 从注射菌株NWt-2死亡牛蛙个体的病灶区及内脏组织中分离纯化获得1株菌株,编号为7t1。将菌株NWt-2和菌株7t1分别接种在LB培养基上,28 ℃培养24 h后观察菌落形态并进行革兰氏染色,结果显示,菌株NWt-2的菌落形态为圆形,直径2~3 mm,呈乳白色、半透明,表面光滑、边缘整齐;革兰氏染色呈阴性,10×100倍油镜下观察其菌体呈短杆状,两端钝圓,大小为1~2 μm,单独或成双排列(图2-A)。菌株7t1的菌落形态及革兰氏染色结果(图2-B)与菌株NWt-2一致。
2. 3. 2 生理生化特性鉴定结果 菌株NWt-2和菌株7t1的生理生化特性鉴定结果详见表3。其中,葡萄糖、阿拉伯糖、甘露糖、赖氨酸、硝酸盐、戊二酸和尿素等反应结果均呈阳性,而明胶、鸟氨酸和淀粉等10项反应结果呈阴性。参照钟世勋等(2014)、王孝武等(2015)、李娟等(2018)、胡秀彩等(2019)的研究结果,初步判定菌株NWt-2为不动杆菌属(Acinetobacter)。
2. 3. 3 分子生物学鉴定结果 测序结果显示,菌株NWt-2的16S rRNA序列长1448 bp。应用BLAST (http://www.ncbi.nlm.nih.gov/blast)对菌株NWt-2的16S rRNA序列进行对比分析,结果显示,菌株NWt-2与A. bouvetii DSM(KB849725.1)的相似性最高,为99.44%,与其他不动杆菌属参考菌株的相似性也均在97.00%以上(表4)。基于16S rRNA序列相似性,通过MEGA 6.0构建系统发育进化树(图3)也发现,菌株NWt-2属于不动杆菌家族,与其亲缘关系最近的菌株为布韦不动杆菌(A. Bouvetii)(KB849725.1)。菌株7t1的16S rRNA序列相似性对比分析及其系统发育进化树分析结果与菌株NWt-2一致,可确定菌株NWt-2是引起牛蛙腐皮病的致病菌,为布韦不动杆菌。
2. 4 药敏试验结果
菌株NWt-2的药敏试验结果见表5。根据药敏试验判断标准可知,菌株NWt-2对丁胺卡那、庆大霉素、哌拉西林、头孢氨苄、硫酸阿米卡星等5种抗菌药物高度敏感,对四环素和羧苄西林中度敏感,对恩诺沙星溶液低度敏感,对青霉素、复方新诺明、诺氟沙星、氟苯尼考、复方磺胺嘧啶、盐酸林可霉素、盐酸大观林可霉素等7种药物不敏感(耐药)。
2. 5 菌株NWt-2与益生菌间的相互作用
菌株NWt-2与益生菌间的相互作用结果(图4)显示,浓度为105 CFU/mL的枯草芽孢杆菌和紫色杆菌对菌株NWt-2有一定的抑制作用,抑菌圈直径分别为1.45±0.46和0.97±0.38 mm。其中,以枯草芽孢杆菌对菌株NWt-2的抑制效果较好。
3 讨论
腐皮病是蛙类养殖中的一种常见细菌性疾病,但目前对于引起蛙类腐皮病致病菌的研究结论并不一致。舒新华等(1997b)对牛蛙腐皮病致病菌的研究表明,奇异变形杆菌(P. mirabilis)和克氏耶尔森氏菌(Y. kristensenii)均能独立引起牛蛙腐皮病;同时发现克氏耶尔森氏菌能与嗜水气单胞菌联合感染引起牛蛙腐皮—红腿并发症(舒新华等,1997a)。叶雪平(1999)研究认为,蛙类的烂皮病是由醋酸钙不动杆菌(A. calcoaceticus)所引起。乔志刚等(2000)对美国青蛙腐皮病病原菌的分离鉴定结果显示,嗜水气单胞菌是主要的致病菌,其次为布兰汉氏菌(Branhamella sp.)。谢凤等(2002)研究证实引起美国青蛙腐皮病的致病菌为鲁氏不动杆菌(A. lwoffii)。本研究从患腐皮病牛蛙的体表溃烂处和内脏分离获得9株疑似致病菌株,经人工回归感染试验证实菌株NWt-2可引起牛蛙出现腐皮病病症,且从人工感染试验死亡牛蛙体表病灶区及内脏组织中分离到1株与菌株NWt-2形态特征、生理生化特征及分子生物学特征一致的菌株,因此确定菌株NWt-2是引起牛蛙腐皮病的致病菌。通过对菌株NWt-2的16S rRNA序列进行BLAST对比分析及系统发育进化树分析,结果显示其与布韦不动杆菌的亲缘关系最近,相似性为99.44%。因此,确定引起浙江嘉善牛蛙养殖场牛蛙腐皮病的致病菌为布韦不动杆菌。
不动杆菌隶属于变形菌纲(Alphaproteobacteria)假单胞目(Pseudomonadales)莫拉菌科(Moraxellaceae),目前已有研究的不动杆菌主要有醋酸鈣不动杆菌、鲁氏不动杆菌、鲍曼不动杆菌(A. baumanii)、溶血不动杆菌(A. haemolytius)、琼氏不动杆菌(A. junii)和约翰逊不动杆菌(A. johnsonii)6种(叶雪平,1999;谢凤等,2002;顾泽茂等,2010;胡秀彩等,2019)。在蛙类疾病研究中,鲁氏不动杆菌和醋酸钙不动杆菌均能引起牛蛙腐皮病。本研究发现不动杆菌属中的布韦不动杆菌对牛蛙也存在致病性,是一种新发现的牛蛙腐皮病病原菌,但具体致病机理有待进一步探究。
目前,针对牛蛙腐皮病的防治手段仍然是药物治疗。陈超然等(2002)采用内服盐酸土霉素与外用稳定性淀粉二氧化氯(ClO2)相结合的方法对患腐皮病牛蛙进行治疗,孟思妤等(2012)采用内服盐酸土霉素与外用菌毒消(主要成分为醋酸、十二烷基苯磺酸和酚)对患腐皮病牛蛙进行治疗,两种方法虽然有一定的治疗效果,但难以根治。本研究的药敏试验结果表明,丁胺卡那、庆大霉素、哌拉西林、头孢氨苄和硫酸阿米卡星等5种抗菌药物对菌株NWt-2具有明显的抑制作用,因此可考虑选用这5种抗菌药物进行防治;但恩诺沙星溶液、盐酸林可霉素及氟苯尼考粉等常用水产抗菌处方药物对牛蛙腐皮病没有防治效果,可能是由于近年来牛蛙养殖户过量乱用滥用抗菌药物,致使病原菌耐药性不断增强(吴兴镇,2016),养殖户为了控制病害发生而不断增加抗菌药物浓度,最终给食品安全带来巨大隐患。
随着国家对抗生素类药物的使用限制,益生菌在绿色生态养殖中得到快速推广与普及。益生菌不仅能提高水产养殖品种的生长性能,还有助于提高机体免疫力,抑制肠道致病菌,同时在水体物质循环中发挥重要作用(谢宜涛和候晓敏,2018)。Taheur等(2016)从大麦、传统肉制品及发酵橄榄中分离出3株乳酸菌,均满足作为益生菌的标准,并证实其中的戊糖片球菌和短乳杆菌对唾液链球菌具有很好的抑制作用。Abdelhamid等(2018)研究表明,以MRS肉汤培养的双歧杆菌和乳酸菌的无细胞提取物(CFSM)对所有大肠杆菌均具有较强的抑菌活性,抑菌圈直径为11.77~23.10 mm。Singh等(2018)研究表明,山羊乳源乳酸菌对铜绿假单胞菌(Pseudomonas aeruginosa)和金黄色葡萄球菌(S. aureus)具有显著的抗菌作用,测试菌株的CFSM能降低病原体生物膜的形成活性。本研究从微生物防控病害的角度探讨菌株NWt-2与益生菌间的相互作用,结果表明,浓度为105 CFU/mL的枯草芽孢杆菌对菌株NWt-2具有一定抑制作用,但抑制效果不及抗菌药物明显,其原因可能是选择的益生菌种类、作用剂量等因素尚未优化,但可预见筛选高效益生菌预防牛蛙腐皮病将是特种水产动物生态养殖和疾病防治的新思路。
4 结论
布韦不动杆菌是引起浙江嘉善养殖牛蛙发生腐皮病的致病菌,可选用丁胺卡那、庆大霉素、哌拉西林、头孢氨苄和硫酸阿米卡星等抗菌药物进行防治。鉴于枯草芽孢杆菌对布韦不动杆菌具有一定的抑制效果,在当前病原菌对抗菌药物普遍存在耐药性的情况下,选择枯草芽孢杆菌等益生菌进行生物防控具有可行性。
参考文献:
卜令飞,王鑫毅,金珊,赵青松,陈寅儿. 2019. 一株牛蛙源金黄杆菌的分离鉴定及其致病特性[J]. 微生物学通报,46(6):1413-1422. [Bu L F,Wang X Y,Jin S,Zhao Q S,Chen Y E. 2019. Isolation,identification and pathogenic characteristics of Chryseobacterium sp. from Rana catesbiana[J]. Microbiology China,46(6):1413-1422.]
陈超然,陈昌福,孟长明. 2002. 盐酸土霉素与二氧化氯结合使用对牛蛙烂皮病的治疗效果[J]. 北京水产,(1):16-17. [Chen C R,Chen C F,Meng C M. 2002. Therapeutic effect of oxytetracycline hydrochloride combined with chlorine dioxide on bullfrog rotten skin disease[J]. Journal of Beijing Fisheries,(1):16-17.]
高博. 2017. 我國牛蛙产业现状及前景分析[D]. 厦门:集美大学. [Gao B. 2017. The status and analysis of prospects of bullfrog industry in our country[D]. Xiamen:Jimei University.]
顾泽茂,柳阳,陈昌福,朱健,谢骏,徐跑. 2010. 鲍曼不动杆菌斑点叉尾鮰株的分离与鉴定[J]. 华中农业大学学报,29(4):489-493. [Gu Z M,Liu Y,Chen C F,Zhu J,Xie J,Xu P. 2010. Isolation and identification of Acinetobacter baumannii from the diseased channel catfish[J]. Journal of Huazhong Agricultural University,29(4):489-493.]
韩艳楠,余银春,王鑫毅,王丽,刘晓琳,金珊,赵青松. 2016. 牛蛙致病变形菌的鉴定及其敏感药物筛选[J]. 微生物学通报,43(6):1280-1287. [Han Y N,Yu Y C,Wang X Y,Wang L,Liu X L,Jin S,Zhao Q S. 2016. Identification and sensitive drug test of pathogenic Proteus vulgaris from Rana catesbeiana[J]. Microbiology China,43(6):1280-1287.]
杭小英,周冬仁,叶雪平,余旭平,罗毅志,施伟达. 2012. 牛蛙无乳链球菌病病原的分离鉴定[J]. 水生生物学报,36(2):361-364. [Hang X Y,Zhou D R,Ye X P,Yu X P,Luo Y Z,Shi W D. 2012. Isolation and identification on the pathogen of bullfrog Streptoccus disease[J]. Acta Hydrobiologica Sinica,36(2):361-364.]
胡秀彩,吕爱军,孙敬锋,YEONG Yiksung,石洪玥,宋亚娇. 2019. 草鱼肠道约氏不动杆菌的分离鉴定及药敏特性研究[J]. 水生态学杂志,40(5):99-103. [Hu X C,Lü A J,Sun J F,Yeong Y,Shi H Y,Song Y J. 2019. Isolation,identification and antibiotic susceptibility of Acinetobacter johnsonii from the intestine of grass carp[J]. Journal of Hydroecology,40(5):99-103.]
李娟,周浪,王研,曾邦权,段博芳,李维芬,段纲,常华,李国雄,代飞燕. 2018. 梅花鹿源不动杆菌的分离鉴定及生物学特性研究[J]. 野生动物学报,39(4):769-774. [Li J,Zhou L,Wang Y,Zeng B Q,Duan B F,Li W F,Duan G,Chang H,Li G X,Dai F Y. 2018. Isolation,identification and biological characteristics of Acinetobacter from sika deer[J]. Chinese Journal of Wildlife,39(4):769-774.]
李巧玲,吴新仪,姜维,邓静静,吕耀平. 2018. 蛙类病害与防治研究进展[J]. 丽水学院学报,40(5):7-11. [Li Q L,Wu X Y,Jiang W,Deng J J,Lü Y P. 2018. Research progress of frog diseases and their control[J]. Journal of Lishui University,40(5):7-11.]
刘晓东,杨金先,龚晖,朱春华,林天龙. 2012. 一株牛蛙源虹彩病毒的分离及鉴定[J]. 中国动物传染病学报,20(1):16-21. [Liu X D,Yang J X,Gong H,Zhu C H,Lin T L. 2012. Characterization of an iridovirus isolate from Rana catesbiana[J]. Chinese Journal of Animal Infectious Di-seases,20(1):16-21.]
卢仲春. 1997. 牛蛙两种腐皮病的鉴别与防治[J]. 科学养鱼,(3):26. [Lu Z C. 1997. Identification and control of two kinds of the bullfrog rotten skin disease[J]. Scientific Fish Farming,(3):26.]
孟思妤,孟长明,陈昌福. 2012. “菌毒消”与盐酸土霉素结合使用对牛蛙烂皮病的治疗效果(上)[J]. 渔业致富指南,(5):70-71. [Meng S Y,Meng C M,Chen C F. 2012. Therapeutic effect of “Junduxiao” combined with oxytetracycline hydrochloride on bullfrog rotten skin disease (I)[J]. Fishery Guide to be Rich,(5):70-71.]
乔志刚,李用芳,张会永. 2000. 美国青蛙腐皮病病原菌的分离鉴定和致病因素研究[J]. 水产科技情报,27(2):70-72. [Qiao Z G,Li Y F,Zhang H Y. 2000. Isolation,identification and pathogenic factors of the necrotic skin di-sease of Rana grylio[J]. Fisheries Science & Technology Information,27(2):70-72.]
舒新华,金燮理,肖克宇,陈可毅. 1997a. 牛蛙腐皮-红腿病并发症致病菌研究I.嗜水气单胞菌的致病力和生物学特性[J]. 湖南师范大学自然科学学报,20(3):67-71. [Shu X H,Jin X L,Xiao K Y,Chen K Y. 1997a. Studies on the pathogenic bacteria of the rotten-skin and red-leg disease of the bullfrog I. Virulence and biological features of Aeromonas hydrophila[J]. Journal of Natural Science of Hunan Normal University,20(3):67-71.]
舒新华,肖克宇,金燮理,陈可毅,黄志坚. 1997b. 牛蛙腐皮病致病细菌的初步研究[J]. 水产学报,21(S1):71-76. [Shu X H,Xiao K Y,Jin X L,Chen K Y,Huang Z J. 1997b. Studies on the pathogenic bacteria of the rotten-skin disease of bullfrog[J]. Journal of Fisheries of China,21(S1):71-76.]
王孝武,王旭荣,李建喜,王学智,林杰,杨志强. 2015. 牛源鲍曼不动杆菌的鉴定及体外药敏试验[J]. 西北农业学报,24(5):13-17. [Wang X W,Wang X R,Li J X,Wang X Z,Lin J,Yang Z Q. 2015. Identification and susceptibility test in vitro of Acinetobacter baumannii from dairy cows[J]. Acta Agriculturae Boreali-Occidentalis Sinica,24(5):13-17.]
王源,赵文文,刁新平. 2018. 枯草芽孢杆菌的研究进展[J]. 黑龙江畜牧兽医,(19):62-64. [Wang Y,Zhao W W,Diao X P. 2018. Research progress of Bacillus subtilis[J]. Heilongjiang Animal Science and Veterinary Medicine,(19):62-64.]
吴兴镇. 2016. 黑斑蛙白内障病原菌的分离鉴定及体外抑菌作用研究[D]. 重庆:西南大学. [Wu X Z. 2016. Isolation and identification of the pathogeny from the cataract diseased Rana nigromaculata and the research of prophylaxis and treatment[D]. Chongqing:Southwest University.]
谢凤,张凤君,黄文芳. 2002. 美国青蛙腐皮病病原的研究[J]. 华南师范大学学报(自然科学版),(2):102-105. [Xie F,Zhang F J,Huang W F. 2002. Study on the pathogen of the necrotic skin disease of Rana grylio[J]. Journal of South China Normal University(Natural Science Edition),(2):102-105.]
謝宜涛,候晓敏. 2018. 益生菌在水产养殖生产中的运用[J]. 江西农业,(20):119. [Xie Y T,Hou X M. 2018. Application of probiotics in aquaculture production[J]. Jiangxi Agriculture,(20):119.]
杨春浩. 2010. 牛蛙歪头病病原、病理及敏感药物研究[D]. 长沙:湖南农业大学. [Yang C H. 2010. Wry head disease of bullfrog pathogen,pathology and sensitive drug research[D]. Changsha:Hunan Agricultural University.]
叶雪平. 1999. 蛙病的診断与防治技术[J]. 水产科技情报,26(2):82-83. [Ye X P. 1999. Diagnosis and control technology of frog disease[J]. Fisheries Science & Technology Information,26(2):82-83.]
尹伦甫,陈公立. 2010. 牛蛙常见疾病的诊断与防治[J]. 科学养鱼,(10):80. [Yin L F,Chen G L. 2010. Diagnosis and prevention of common diseases of Rana catesbiana[J]. Scientific Fish Farming,(10):80.]
于喆,肖克宇,钟蕾,刘巧林,谭情,江辉. 2013. 牛蛙腹水病病原鉴定和药敏试验[J]. 淡水渔业,43(1):50-54. [Yu Z,Xiao K Y,Zhong L,Liu Q L,Tan Q,Jiang H. 2013. Pathogen identification and drug sensitivity of ascites disease in Rana catesbeiana[J]. Freshwater Fisheries,43(1):50-54.]
张浩,郭虹彩,马文奎,曹金元. 2018. 兽用药敏纸片的制备及其抑菌效果分析[J]. 畜牧与饲料科学,39(9):110-112. [Zhang H,Guo H C,Ma W K,Cao J Y. 2018. Preparation and antimicrobial effect evaluation of antimicrobial susceptibility disk for veterinary use[J]. Animal Husbandry and Feed Science,39(9):110-112.]
钟世勋,李兵,王迪,张永兵,朱福杰,杨亚,杨世发,迟珊珊,朱瑞良. 2014. 山羊鲍曼不动杆菌分离鉴定和病原性研究[J]. 中国预防兽医学报,36(8):632-635. [Zhong S X,Li B,Wang D,Zhang Y B,Zhu F J,Yang Y,Yang S F,Chi S S,Zhu R L. 2014. Isolation and identification of Acinetobacter baumannii isolated from Capra hircus[J]. Chinese Journal of Preventive Veterinary Medicine,36(8):632-635.]
Abdelhamid A G,Esaam A,Hazaa M M. 2018. Cell free pre-parations of probiotics exerted antibacterial and antibiofilm activities against multidrug resistant E. coli[J]. Saudi Pharmaceutical Journal,26(5):603-607.
Singh N,Sharma C,Gulhane R D,Rokana N,Singh B P,Puniya A K,Attri S,Goel G,Panwar H. 2018. Inhibitory effects of lactobacilli of goats milk origin against growth and biofilm formation by pathogens:An in vitro study[J]. Food Bioscience, 22:129-138.
Taheur F B,Kouidhi B,Fdhila K,Elabed H,Slama R B,Mahdouani K,Bakhrouf A,Chaieb K. 2016. Anti-bacterial and anti-biofilm activity of probiotic bacteria against oral pathogens[J]. Microbial Pathogenesis,97:213-220.
Zhang C X,Huang K K,Wang L,Song K,Zhang L,Li P. 2015. Apparent digestibility coefficients and amino acid availability of common protein ingredients in the diets of bullfrog,Rana(Lithobates) catesbeiana[J]. Aquaculture,437(1):38-45.

