K-RAS蛋白表达及基因状态在胃癌组织中的临床意义
宗桂娟,尹海兵,李春笋,陈旭东,蔡南南,杨磊,赵斌,何松
胃癌是最常见的消化道恶性肿瘤之一,其发病率和病死率逐年上升,严重危害人类健康[1]。多数胃癌病人即使采用围手术期化疗及辅助化疗,生存率仍较低。因此寻找新的治疗途径如分子靶向治疗成为胃癌研究的热点[2-3]。K-RAS基因编码的p21-ras蛋白位于细胞质膜上转导细胞生长与分化的信号[4]。K-RAS突变主要发生在12、13和61编码子上,这些突变可造成K-RAS基因激活[5-7]。结直肠癌病人存在40%~45%K-RAS基因突变,可导致细胞持续生长,抑制细胞凋亡[6]。目前K-RAS基因在结直肠癌方面的研究较多,但在胃癌中的研究却鲜有报道[7]。本研究采用免疫组化法、PCR法检测胃癌中K-RAS蛋白表达和基因状态,将胃癌组织中KRAS蛋白表达、基因状态与病人临床参数进行分析。并探讨K-RAS基因突变与蛋白表达水平是否存在一致性,旨在为胃癌靶向治疗提供帮助。
1 材料与方法
1.1 材料 314例胃癌组织样本来自南通市肿瘤医院。选取自2016年1月至2017年12月胃癌病人手术切除的标本。纳入标准:无合并其他恶性肿瘤或者胃癌复发后再次手术者,临床病理资料完整,术前未行放化疗及其他抗肿瘤治疗,手术病理诊断明确为胃癌。男233例,女81例。年龄范围为32~88岁,中位年龄65岁。病人或近亲属对研究方案签署知情同意书,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 实验试剂 免疫组织化学法(免疫组化)所用抗体即用型试剂盒和一抗均购自Proteintech公司;人组织基因组核酸提取试剂盒(货号为DE02003)及核酸提取仪均来自上海科亦生物科技有限公司。
1.3 免疫组化 免疫组化染色采用EnVision(二步法)完成。K-RAS一抗工作浓度为1∶500,抗原修复方式为热修复(Trish EDTA pH9.0)97℃,30 min。具体操作步骤严格按试剂盒说明书进行。结果判定:PBS代替一抗作为阴性对照,已知阳性的肝癌组织切片为阳性对照。Fromowitz综合计分法将细胞着色强度与阳性细胞所占百分比二者综合判定,阳性细胞百分数为10个视野阳性细胞平均数占其细胞总数的百分比:<5%计0分;5%~25%计1分;26%~50%计2分;51%~75%计3分;>75%计4分。细胞着色强度:不着色计0分;淡黄色计1分;棕黄色计2分;棕褐色计3分。二者积分相加:0~1分为阴性,≥2分为阳性[8]。
1.4 荧光定量PCR 基因组DNA的提取按照试剂盒说明书进行;本实验所用引物为,正向5′-ATT TTT ATT ATA AGG CCT GCT G-3′和反向5′-CAA AGA ATGGTCCTGCACCAG-3′;20μLPCR反应体系包括10 μL的2×Expfu Mix、15 pmol的正向引物、15 pmol的反向引物和3μL的样品,加入PCR水体系补足至20μL;PCR程序如下:95℃预变性5 min,接着进行35个扩增循环:95℃10 s,58℃35 s,72℃15 s,随后72℃5 min延伸。PCR产物测序由上海科亦生物有限公司完成。
1.5 统计学方法 应用SPSS15.0软件进行数据处理及统计学分析,计数资料以例(%)表示,结果比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 K-RAS蛋白表达与胃癌临床病理特征的关系 根据病人的性别、年龄、肿瘤大小、分化程度、有无淋巴结转移、有无脉管侵犯等病理参数,将314例病人标本进行分组。通过统计学分析,结果显示K-RAS蛋白表达阳性率为13.05%,其表达与病人性别(P=0.585 8)、年龄(P=0.648 5)、肿瘤大小(P=0.761 1)、脉管侵犯(P=0.552 4)、有淋巴结转移差异无统计学意义(P=0.506 4);与组织学分化程度差异有统计学意义(P=0.019 5)。各组K-RAS蛋白表达情况见表1。
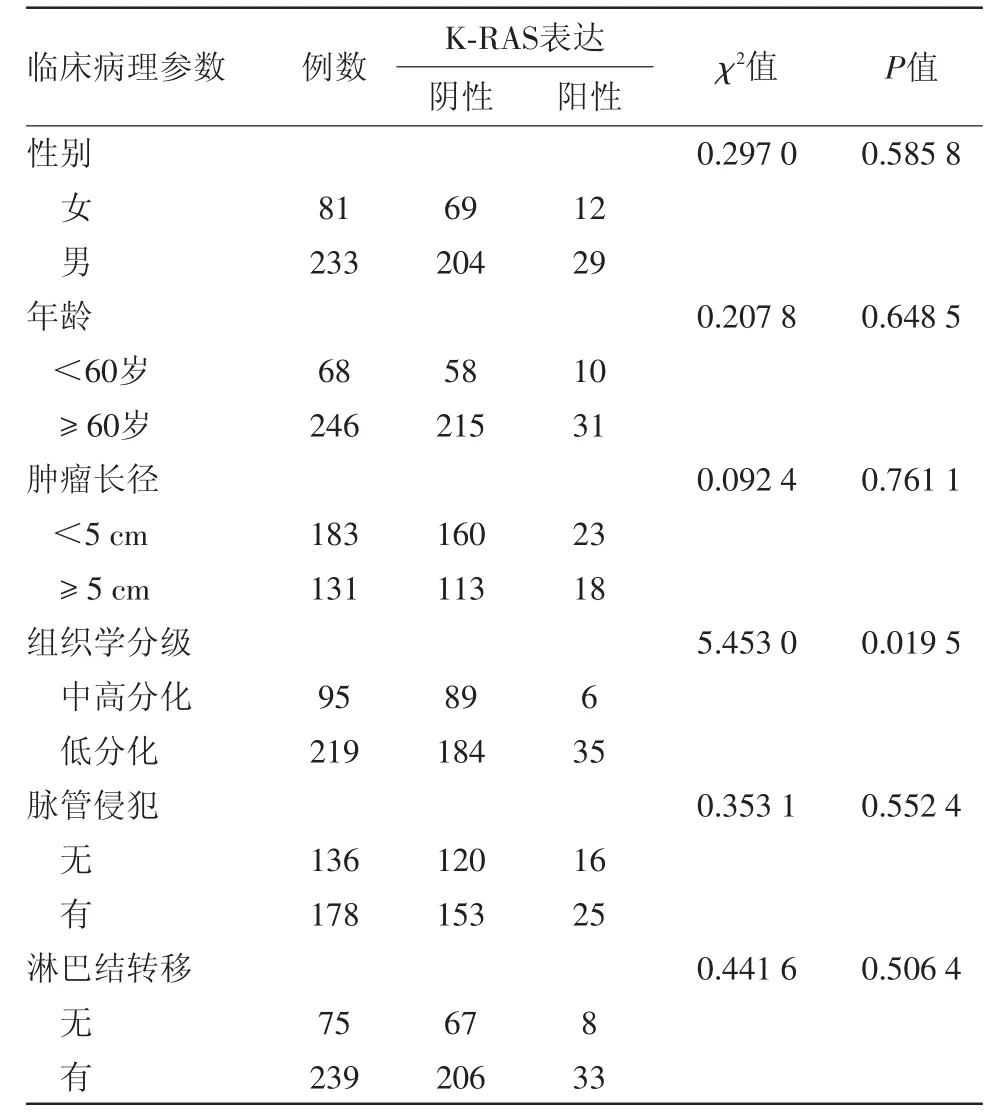
表1 K-RAS蛋白表达与胃癌临床特征的关系/例
2.2 分析不同年龄、性别、组织学分级胃癌病人基因K-RAS突变情况 通过分析发现314例胃癌组织K-RAS基因状态,其中K-RAS基因突变8例,突变率为2.54%,且K-RAS基因突变频率在不同性别(P=0.456 6)、年龄(P=0.524 2)及组织学分级(P=0.747 4)胃癌病人中差异无统计学意义。各组K-RAS基因突变频率见表2。

表2 胃癌病人中不同年龄、性别、组织学分级群体中K-RAS基因的突变频率/例(%)
2.3 K-RAS基因突变与蛋白表达的关系 PCR法检测胃癌组织中K-RAS基因状态,结果显示K-RAS突变8例(突变率为2.54%),突变类型包括G12D(3例)、G13D(2例)、G12A(1例)、G12S(1例)、G13S(1例);此外,基因突变病人中3例免疫组化检测结果为阳性,即免疫组化结果与基因突变率结果相同者3例。K-RAS基因突变率与蛋白表达的检出率不同(P=0.037 7),故两者关联性低。见表3。
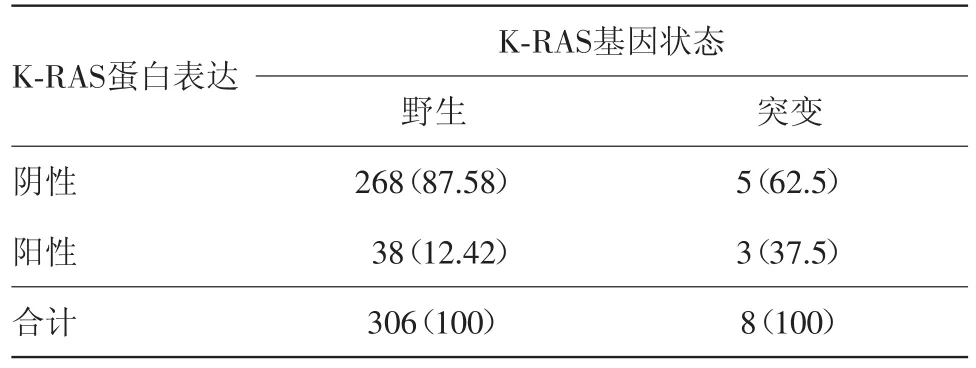
表3 K-RAS基因突变及K-RAS蛋白表达分布/例(%)
3 讨论
RAS基因家族包括H-RAS、K-RAS、N-RAS基因,分别编码H-RAS、K-RAS、N-RAS蛋白,它们具有相似的结构和功能[9]。RAS蛋白位于细胞膜内侧,将EGFR的信号转导给MAPKs,进而调控细胞的生长、增殖及血管生成[10-11]。一般情况下K-RAS基因处于相对静止状态,当受到持续刺激作用与政策细胞激活K-RAS,导致细胞恶性生长,促进肿瘤发生发展[12-13]。因此研究K-RAS在胃癌发生发展中的作用具有重要的临床意义。
本研究结果显示胃癌K-RAS蛋白表达与病人性别、年龄、肿瘤大小、脉管侵犯、有无淋巴结转移无明显关系(P>0.05);但K-RAS蛋白表达与分化程度密切相关(P<0.05),提示K-RAS可能参与了胃癌的发展进程。Kikuchi等应用免疫组化法研究K-RAS在80例胃癌表达情况,结果发现随着胃癌分化程度的增加则表达升高,与本研究结果一致[14]。
K-RAS基因突变率在不同肿瘤中明显不同。文献报道胰外分泌腺癌基因突变率高达90%,结肠癌为40%~50%,肺癌和膀胱癌为40%,而胃癌在10%以下[15]。本实验检测314例胃癌组织K-RAS基因状态,其中K-RAS基因突变8例,突变率为2.54%。K-RAS基因突变结果与国外研究一致。KRAS基因在不同性别、年龄、组织分化之间的突变率无显著差异。K-RAS突变与病人缺乏对EGFR单抗的反应有关,突变者不适用西妥昔单抗治疗[16]。2010年NCCN临床指南中推荐:结直肠癌病人在接受西妥昔单抗治疗前,进行K-RAS基因突变检测,确定是否接受该靶向治疗[17-18]。另外本研究中KRAS蛋白的阳性率为13.05%,其蛋白阳性率远高于基因突变率。因此K-RAS的免疫组化结果不能替代基因突变检测结果,对于考虑选用西妥昔单抗治疗的病人,可以采用荧光定量PCR法检测EGFR及K-RAS基因状态。
综上,K-RAS在胃癌中的蛋白表达可能作为判断胃癌恶性程度的分子生物学标志物。K-RAS基因的突变状态和靶向EGFR单克隆抗体的治疗效果相关,因此胃癌病人可通过K-RAS基因检测结果采用个体化治疗。

