TBX2对人胶质瘤细胞U251生物行为学的影响
刘中平 刘小江 吴德模
脑胶质瘤(glioma)是位于神经外胚层的肿瘤,约占颅内肿瘤的46%,在颅内呈浸润性生长,主要表现为浸润性侵犯血管周围间隙、神经纤维束间及软脑膜,具有侵袭性强及易复发的特点,是严重威胁人类健康的恶性肿瘤之一[1]。胶质瘤的发病机制目前尚未完全清楚,通常认为胶质瘤的发生是由促癌基因或抑癌基因共同参与的多因素、多步骤的复杂过程[2]。T-BOX转录因子2(T-box transcription factor 2,TBX2)是T-BOX基因家族成员之一,其编码的TBX2蛋白可以作为转录因子调控胚胎发育过程[3]。研究发现,TBX2可通过多种机制促进肿瘤的发生与发展[4]。张雁等[5]研究表明,TBX2在卵巢癌等多种肿瘤中表达上调,是一种新型肿瘤分子标志物。但目前关于TBX2对脑胶质瘤细胞生物学行为的影响研究笔者尚鲜见报道。本研究通过体外培养脑胶质瘤细胞,探讨TBX2对脑胶质瘤细胞生物学行为的影响,以期为脑胶质瘤的临床治疗提供参考依据。
1 材料与方法
1.1 材料 人脑胶质瘤细胞U251及正常人星形胶质细胞SVG P12均购自上海酶联生物科技有限公司,DMEM培养基、胎牛血清购自赛默飞世尔科技有限公司,慢病毒载体由南京科佰生物科技有限公司设计并构建。
1.2 细胞培养及分组 人脑胶质瘤细胞U251接种在含10%的新生牛血清的DMEM培养液中,置于37℃饱和湿度、5% CO2培养箱中进行培养,每隔2 d更换一次培养基,取增殖期的细胞,胰蛋白酶消化后接种于6孔板中继续培养,培养至细胞融合度70%左右时,将细胞随机分为3组,TBX2 inhibitor组:转染含TBX2 inhibitor的慢病毒载体;阴性对照组(NC组):转染携带无义序列的慢病毒载体;空白对照组(CK组):不进行转染。37℃培养箱中继续培养48 h,收集3组细胞。
1.3 qRT-PCR检测脑胶质瘤细胞中TBX2表达水平 取胶质瘤细胞500 μl,采用Trizol法提取样品总RNA,测定RNA纯度及浓度后,采用反转录试剂盒反转录得cDNA,再以cDNA为模板进行扩增,以GAPDH作为内参,反应体系25 μl,qRT-PCR反应条件:95℃:5 min;94℃:30 s;58℃:45 s;72℃:30 s,共35个循环。采用2-CT法测量TBX2表达水平。见表1。

表1 qRT-PCR引物序列
1.4 细胞增殖检测 采用CCK-8 法进行检测,分别将转染48 h的3组细胞分别接种于96孔板,每组细胞设6个复孔,每孔接种5×103个细胞,在培养0 h、12 h、24 h、48 h、72 h时加入10 μl CCK8溶液,置于37℃、5% CO2培养箱孵育2 h后,在450 nm波长处读取吸光度值(OD值),并求取平均值。
1.5 细胞迁移情况 采用Transwell细胞迁移实验进行检测,收集转染后48 h细胞制备2×103/μl单细胞悬液,取100 μl接种于上室(每组设3个复孔),下腔室中加入含有10% FBS条件培养基,置于37℃、5% CO2培养箱中孵育24 h,取出Transwell小室,吸弃上室液体,用PBS洗2次,95 %乙醇固定10 min,加入0.1%结晶紫染色30 min,PBS洗2遍,显微镜下随机选取10个视野,观察并拍照,利用Image J软件计数穿膜细胞数,求取平均值。
1.6 细胞侵袭情况 采用Transwell法进行检测,检测过程除加入基质胶外,其他步骤与细胞迁移检测方法相同。

2 结果
2.1 TBX2在脑胶质瘤细胞中的表达情况 脑胶质瘤U251细胞TBX2相对表达量显著高于SVG P12正常细胞(P<0.05)。见表2。

表2 脑胶质瘤细胞与正常细胞中TBX2表达比较
注:与SVG P12细胞比较,*P<0.05
2.2 转染后3组脑胶质瘤细胞中TBX2表达比较 TBX2 inhibitor组脑胶质瘤细胞TBX2相对表达量显著低于CK组、NC组(P<0.05)。见表3。

表3 转染后各组脑胶质瘤细胞中TBX2水平比较
注:与NC组比较,*P<0.05;与CK组比较,#P<0.05
2.3 转染后3组脑胶质瘤细胞增殖情况比较 TBX2 inhibitor组脑胶质瘤细胞培养24 h、48 h、72 h的OD值均显著低于CK组、NC组(P<0.05)。见表4。

表4 3组脑胶质瘤细胞增殖情况比较
注:与NC组比较,*P<0.05;与CK组比较,#P<0.05
2.4 转染后各组脑胶质瘤细胞迁移情况比较TBX2 inhibitor组脑胶质瘤细胞迁移数目显著低于CK组、NC组(P<0.05)。见表5,图1。
2.5 3组脑胶质瘤细胞侵袭情况比较 TBX2 inhibitor组细胞侵袭数目显著低于CK组、NC组(P<0.05)。见表6,图2。
3 讨论
脑胶质瘤又称神脑胶质细胞瘤,来源于神经胶质细胞和神经元,由间质细胞如神经胶质及脉络丛上皮等形成,是颅内常见的一种恶性肿瘤[6]。按病理分级可将脑胶质瘤可分为4级,其中Ⅰ级脑胶质瘤繁殖能力低,手术治愈可能性高;Ⅱ级脑胶质瘤为浸润性肿瘤,易复发,有向高级别肿瘤进展的倾向;Ⅲ级脑胶质瘤具有恶性肿瘤的组织学特点,多数患者需要接受术后辅助性放、化疗;Ⅳ级脑胶质瘤具有恶性细胞学表现,生长迅速,术前、术后进展快,复发率高,患者术后需接受辅助性放、化疗及生物治疗等综合疗法,但目前临床上仍无法治愈该疾病[7-9]。脑胶质瘤发病机制是涉及多个基因共同参与的复杂过程。其发病机制至今尚未完全明确,因此,进一步探索影响脑胶质瘤细胞生物学行为的因素十分重要。
表5 3组脑胶质瘤细胞迁移情况比较 个,
注:与NC组比较,*P<0.05;与CK组比较,#P<0.05
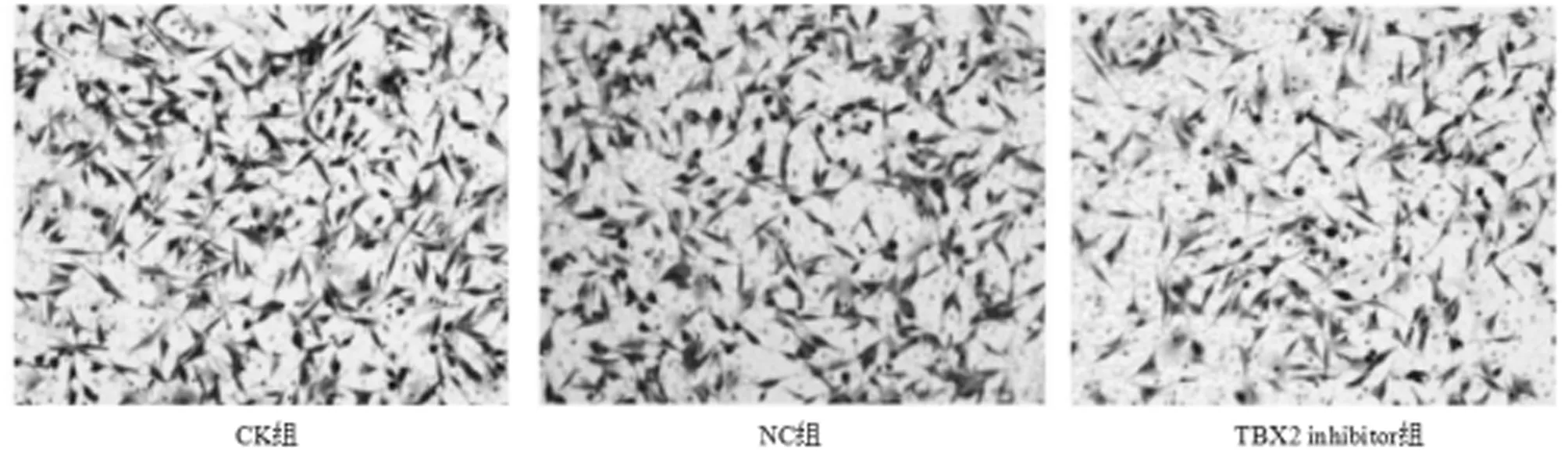
图1 3组脑胶质瘤细胞迁移情况比较(结晶紫染色×200)

图2 3组脑胶质瘤细胞侵袭情况比较(结晶紫染色×200)

表6 3组脑胶质瘤细胞侵袭情况比较
注:与NC组比较,*P<0.05;与CK组比较,#P<0.05
TBX2是T-BOX基因编码转录因子家族成员之一,在心、肾、肺、乳腺间质中均有表达,在早期胚胎形成和晚期组织器官的发育成熟中起着重要的调控作用[10]。研究发现,TBX2在肿瘤的发生过程中具有关键的作用,在黑素瘤等多种恶性肿瘤组织中表达上调[11]。常方圆等[12]研究表明,TBX2在恶性外周神经鞘膜瘤中表达上调,可能在恶性外周神经鞘膜瘤发生、发展中具有重要作用。本研究结果显示脑胶质瘤U251细胞中TBX2相对表达量显著高于SVG P12正常人星形胶质细胞,提示TBX2在胶质瘤细胞中表达上调,在胶质瘤疾病的发生中可能扮演促癌角色,TBX2表达上调可能与脑胶质瘤疾病的发生有关。
随着分子生物学的发展,人们对脑胶质瘤发病机制的研究已经深入到基因水平,研究表明,IGF-2、YEGF、HIF-1、MDM2等原癌基因在脑胶质瘤组织中表达上调,而RB、p14、P53、PTEN等抑癌基因在脑胶质瘤中由于基因突变或缺失等原因表达受到抑制[13]。研究表明,TBX2能够参与脑胶质瘤的形成与发展,主要通过表达p14ARF基因或抑制p21基因,导致MDM2过度表达,进而促进细胞增殖[14,15]。本研究结果显示TBX2 inhibitor组细胞TBX2相对表达量显著低于CK组、NC组,提示转染TBX2 inhibitor后,脑胶质瘤细胞中TBX2显著降低,转染效率较高。
TBX2是肿瘤发生和发育过程中的重要细胞周期调节因子,Nandana等[16]研究表明,TBX2在前列腺癌标本和人类前列腺的异种移植小鼠模型的骨转移中表达上调,使用显性失活构建体抑制TBX2的表达,可导致肿瘤细胞增殖减少。Wang等[17]研究表明,在视网膜色素上皮细胞中特异性敲低TBX2的表达,可使大部分细胞在G1期积累,从而抑制视网膜色素上皮细胞增殖。本研究结果显示TBX2 inhibitor组细胞培养24 h、48 h、72 h的OD值均显著低于CK组、NC组,提示下调TBX2表达能够抑制脑胶质瘤细胞增殖。肿瘤细胞的侵袭与迁移是脑胶质瘤疾病进展的关键,肿瘤的侵袭与迁移是一个涉及多个因子参与、多个步骤的复杂过程,包括肿瘤细胞的分离、运动、侵入其他组织及胞外基质的降解[18]。E-cadherin是促进细胞移动、癌细胞浸润的一种蛋白。房前等[19]研究表明TBX2通过直接调控靶基因E-cadherin,提高癌细胞的侵袭与迁移能力。本研究结果显示TBX2 inhibitor组细胞迁移数目显著低于CK组、NC组,TBX2 inhibitor组细胞侵袭数目显著低于CK组、NC组,提示下调TBX2表达可显著抑制胶质瘤细胞的侵袭与迁移。
综上所述,TBX2在脑胶质瘤细胞中表达上调,下调TBX2表达可抑制胶质瘤细胞的增殖、迁移与侵袭,有望作为潜在靶标应用于靶向治疗。然而本研究仅初步探究了TBX2在胶质瘤中的表达及其对胶质瘤细胞U251生物行为学的影响,其中涉及的具体分子机制将进一步深入研究。

