谈“复分解反应发生的条件”教学中化学教师易 出现的三个问题
田长明


摘要:“复分解反应发生的条件”是沪教版九年级化学“拓展视野”的内容。文中对部分初中教师在教学中存在的化学概念不清晰、问题设计不严谨、知识小结不完善三个问題进行了阐述,表明了教师只有准确把握教材和吃透教材,才能提升课堂教学的品质。
关键词:复分解反应;化学概念;问题设计;知识小结
中图分类号:G633.8 文献标识码:A文章编号:1992-7711(2020)23-079
“复分解反应发生的条件”是沪教版九年级化学下册“几种重要的盐”一节中“拓展视野”的内容,虽然是拓展的内容,但教师在平时的教学中一直把它作为重点内容来讲的,因为学生掌握了复分解发生反应的条件,就能判断酸碱盐之间能否发生复分解反应,并能判断溶液中哪些离子不能大量共存。
但笔者在平时的听课中发现,对于这部分内容,有些老师或多或少地存在着这样或那样的问题,其中下列三个问题比较典型。
问题一:化学概念不清晰
化学概念包括定义、定理、反应规律等,都是用最精练的语言高度概括出来的。准确地理解化学概念对于学生学好化学非常重要。但在教学过程中,笔者发现有些教师对一些化学概念理解还不够深刻,把一些概念的关键词省略或把两个概念混为一谈。
案例1:“离子能否大量共存”等同于“离子能否共存”
“离子能否大量共存”是初中化学常考查的内容之一,一般以选择题的形式出现,如:
下列各组离子在水溶液中能大量共存的是
在平时的教学中,很多教师常把“大量”两个字省略,把离子在水溶液中“能否大量共存”说成“能否共存”,少了“大量”两个字,意义完全不同了。
我们知道,很多反应都是可逆反应,溶液中存在电离平衡和沉淀溶解平衡。电离平衡如水的电离,2H2OH3O++OH-,又如一水合氨的电离2NH3·H2ONH+4+OH-。沉淀溶解平衡如氢氧化镁的溶解平衡Mg(OH)2Mg2++2OH-,又如碳酸钙的溶解平衡,CaCO3Ca2++CO2-3。既然在溶液中存在这两种平衡,因此H3O+和OH-、NH+4和OH-、Mg2+和OH-、Ca2+和CO2-3等离子在溶液中是可以共存的,又因为水和一水合氨的电离平衡常数比较小,所以H3O+和OH-、NH+4和OH-在溶液中不能大量共存,同理,氢氧化镁和碳酸钙的溶度积常数比较小,Mg2+和OH-、Ca2+和CO2-3在溶液中也不能大量共存。
通过上述分析,可见有些离子在溶液中能共存,但不能大量共存。
案例2:“难溶解”与“难电离”混为一谈
沪教版教材中对复分解反应的条件有如下描述:“酸、碱、盐在溶液中发生复分解反应的条件是有沉淀生成,或有气体放出,或有水生成。”[1]
笔者在听课过程中发现有一位教师对复分解反应的条件作了如下归纳:“酸、碱、盐在溶液中发生复分解反应的条件是有气体或难电离的物质生成。”这个归纳科学吗?水是弱电解质是没问题的,但难道沉淀一定是弱电解质?这位老师把“难溶解”与“难电离”混为一谈。不可否认,一些物质即难溶解又难电离,如Mg(OH)2、Fe(OH)3、Al(OH)3等,但有些物质虽然难溶解,但却是强电解质,如BaSO4、CaCO3、AgCl等。从另外一个角度来看,“电离”这一词在沪教版教材中只是在“拓展视野”中出现,教材也没有“电离”的相关定义(高中必修1中才有比较明确的定义),因此这样的归纳不仅不科学,而且不符合学生认知的顺序。
问题二:问题设计不严谨
问题是课堂教学的重要抓手,在教学中我们教师一定要提高问题的质量,不能粗枝大叶,更不能漏洞百出。
案例3:现有四种物质:①H2SO4 ②NH4NO3 ③NaOH ④CuSO4,有一种物质能与其他物质都发生反应,这种物质是 写出反应的化学方程式 。
答案:这种物质是NaOH,发生反应的化学方程式为:
这种题在初中化学中是屡见不鲜的,教师在教学过程中也没觉得有啥不妥。而这种题仔细品味一下,又觉得不对劲,突出的问题就是问题设计不严谨。
首先是这四种物质的状态不明确,H2SO4是浓硫酸还是稀硫酸?NaOH是固体还是溶液?如果是溶液是浓溶液还是稀溶液?物质没有状态,怎么确定它的性质?
其次物质之间的反应是有条件的,条件不同产物就有可能不同。笔者就以这道题为例,谈谈物质的量、温度和浓度对反应产物的影响。
(1)物质的量对反应产物的影响
稀H2SO4和NaOH稀溶液之间的反应。
(2)温度对反应产物的影响
NH4NO3溶液和NaOH稀溶液之间的反应。
(3)浓度对反应产物的影响
CuSO4溶液分别与NaOH浓溶液和稀溶液之间的反应
NaOH如果是浓溶液,往NaOH浓溶液中滴加少量硫酸铜溶液,发生反应的化学方程式为:4NaOH+CuSO4Na2SO4+Na2[Cu(OH)4]
NaOH如果是稀溶液,往NaOH稀溶液中滴加少量硫酸铜溶液,发生反应的化学方程式为:2NaOH+CuSO4Na2SO4+Cu(OH)2↓
因此教师在设计问题时一定要深思熟虑,否则问题就可能不严谨。
问题三:知识小结不完善
知识小结是教学中常用的教学方法,通过对知识与方法的归纳总结,使知识整体化、有序化、条理化、系统化、结构化、网络化、形象化。使之便于理解,便于记忆,便于应用。但小结不能太随意,必须是科学的。
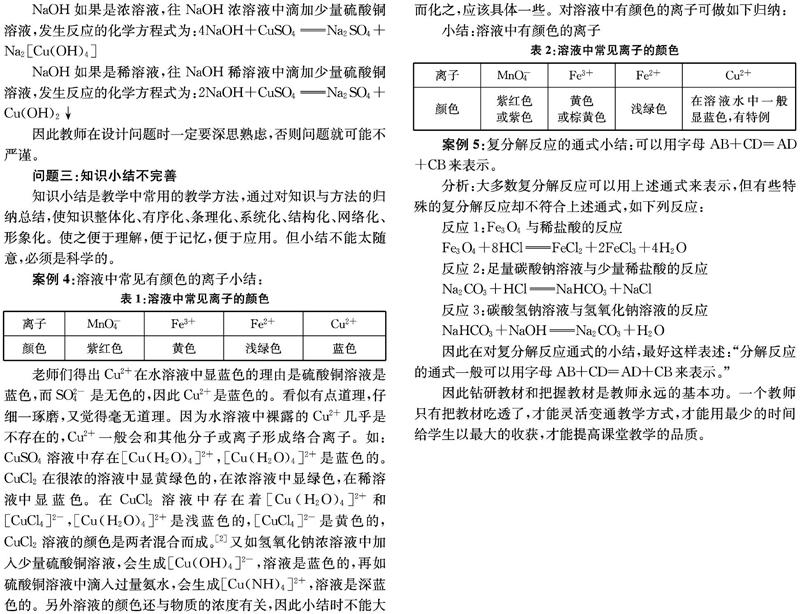
案例4:溶液中常见有颜色的离子小结:
老师们得出Cu2+在水溶液中显蓝色的理由是硫酸铜溶液是蓝色,而SO2-4是无色的,因此Cu2+是蓝色的。看似有点道理,仔细一琢磨,又觉得毫无道理。因为水溶液中裸露的Cu2+几乎是不存在的,Cu2+一般会和其他分子或离子形成络合离子。如:CuSO4溶液中存在[Cu(H2O)4]2+,[Cu(H2O)4]2+是蓝色的。CuCl2在很浓的溶液中显黄绿色的,在浓溶液中显绿色,在稀溶液中显蓝色。在CuCl2溶液中存在着[Cu(H2O)4]2+和[CuCl4]2-,[Cu(H2O)4]2+是浅蓝色的,[CuCl4]2-是黄色的,CuCl2溶液的颜色是两者混合而成。[2]又如氢氧化钠浓溶液中加入少量硫酸铜溶液,会生成[Cu(OH)4]2-,溶液是蓝色的,再如硫酸铜溶液中滴入过量氨水,会生成[Cu(NH)4]2+,溶液是深蓝色的。另外溶液的颜色还与物质的浓度有关,因此小结时不能大而化之,应该具体一些。对溶液中有颜色的离子可做如下归纳:
小结:溶液中有颜色的离子
案例5:复分解反应的通式小结:可以用字母AB+CD=AD+CB来表示。
分析:大多数复分解反应可以用上述通式来表示,但有些特殊的复分解反应却不符合上述通式,如下列反应:
反应1:Fe3O4与稀盐酸的反应
反应2:足量碳酸钠溶液与少量稀盐酸的反应
反应3:碳酸氢钠溶液与氢氧化钠溶液的反应
因此在对复分解反应通式的小结,最好这样表述:“分解反应的通式一般可以用字母AB+CD=AD+CB来表示。”
因此钻研教材和把握教材是教师永远的基本功。一个教师只有把教材吃透了,才能灵活变通教学方式,才能用最少的时间给学生以最大的收获,才能提高课堂教学的品质。
参考文献:
[1]中学化学国家课程标准研制组.义务教育教科书·化学(九年级下册)[M].上海教育出版社,2015.
[2]北京师范大学等.无机化学(下册第四版)[M].高等教育出版社,2003.
(作者单位:苏州市吴中区木渎南行中学,江苏 苏州215000)

