基于超快速液相色谱-质谱联用技术检测药食两用 薄荷中氨基酸和核苷类成分
孙慧娟,王瑞,宋芊芊,周慧银,方成武,2*
1(安徽中医药大学 药学院,安徽 合肥,230012)2(安徽省中医药科学院亳州中医药研究所,安徽 亳州,236800)
薄荷是唇形科薄荷属多年生草本植物,药食两用植物。具有利咽、透疹等功效,用于咽喉肿痛及小儿麻疹等症[1-3]。现代药理研究表明,薄荷能够抗肿瘤、抗菌、消炎、有效缓解镇痛[4-7]。薄荷的药用价值很高,其营养成分也十分丰富,富含氨基酸、有机元素、维生素等多种营养成分,具有重要的营养价值和保健价值[8-10]。
目前,对于薄荷研究多以挥发油类成分为主[11-13],而作为一种药食两用的植物,薄荷作为常见的茶饮,其实际运用中不仅仅局限于挥发油, 其氨基酸和核苷类成分同样重要。而对薄荷中氨基酸、核苷类成分的研究较少,其营养价值尚未得到充分认识。氨基酸主要以游离及水解的形式存在于植物体内,氨基酸检测方法主要包括高效液相色谱法[14]、毛细管电泳法[15]、离子交换色谱法等[16]。本试验通过超快速液相色谱-质谱联用技术(ultra-fast liquid chromatography-mass spectrometry,UFLC-MS/MS),建立同时测定薄荷中21种氨基酸和10种核苷类成分含量方法,对3个不同产地的薄荷中氨基酸和核苷类成分差异进行分析比较,并应用PCA[17]和TOPSIS[18]方法对样品进行综合评价,为药食两用薄荷的质量评价和综合利用提供理论依据。
1 材料与方法
1.1 仪器与设备
Trip Quad 4500串联四级杆质谱仪,美国 ABSciex公司;ExionLC AD 超快速液相色谱仪,日本Shimadzu公司;KQ-400KDE型高功率数控超声清洗器(100 kHz),昆山市超声仪器有限公司;离心机(HC-3018),安徽中科中佳科学仪器有限公司;SArtorius BT125D十万分之一电子天平,德国赛多利斯公司;ME36S 型百万分之一电子天平,德国赛多利斯公司;LGJ-10真空冷冻干燥机,北京松源华兴科技发展有限公司;Milli-Q超纯水系统,Millipore公司;0.22 μm 微孔滤膜,津腾,中国天津。
1.2 材料与试剂
异亮氨酸(Ile)、组氨酸(His)、苯丙氨酸(Phe)、亮氨酸(Leu)、谷氨酸(Glu)、络氨酸(Tyr)、丙氨酸(Ala)、胱氨酸(Cys)、苏氨酸(Thr)、甲硫氨酸(Met)、脯氨酸(Pro)11种氨基酸,均购于中国药品生物制品检定所,批号为140624-200805。天冬氨酸(Asp,批号B21934)、天冬酰胺(Asn,批号B21935)、丝氨酸(Ser,批号140688)、甘氨酸(Gly,批号B21915)、缬氨酸(Val,批号140681)、精氨酸(Arg,批号B21920)、羟基脯氨酸(Hpro,批号B21928)、色氨酸(Tryptophan,批号140677)、盐酸赖氨酸(Lysine,批号140693)、γ-氨基丁酸(GABA,批号B21979)、尿嘧啶(Uracil,批号B20908)、腺嘌呤(Adenine,批号B21357)、胞苷(Cytidine,批号B20073)、肌苷(Inosine,批号B20582)、胸苷(Thymidine,批号B21915)、鸟苷(Guanine,批号B20905)、腺苷(Adenosine,批号B21356)、尿苷(Uridine,批号B20907)、次黄嘌呤(Hypoxanthine,批号B20211)、鸟嘌呤(Guanine,批号B20906),均购于上海源叶生物科技有限公司,质量分数均大于98%。水为超纯水;乙腈、甲酸为质谱纯,德国Merck公司;其余试剂为分析纯。
试验所研究的样品,采集于3个不同产地的薄荷植物新鲜叶片,经安徽中医药大学方成武教授鉴定为唇形科植物薄荷MenthahaplocalyxBriq.的干燥地上部分。样品信息如表1所示。

表1 薄荷主辅料样品来源及基本信息Table 1 Source and basic information of main products of mint steamed vegetables
1.3 实验方法
1.3.1 色谱条件
Waters XBridge Amide专用柱(100 mm×2.1 mm,3.5 μm);流动相∶水(含0.2%甲酸)(A)-乙腈(含0.2%甲酸)(B),梯度洗脱(0~2.5 min,15% A;2.5~5 min,15%~50% A;5~7 min,50% A;7~8 min,50%~15% A;8~11 min,15% A);柱温 30 ℃,流速0.2 mL/min,进样量1 μL。其正离子多反映监测色谱图见图1。
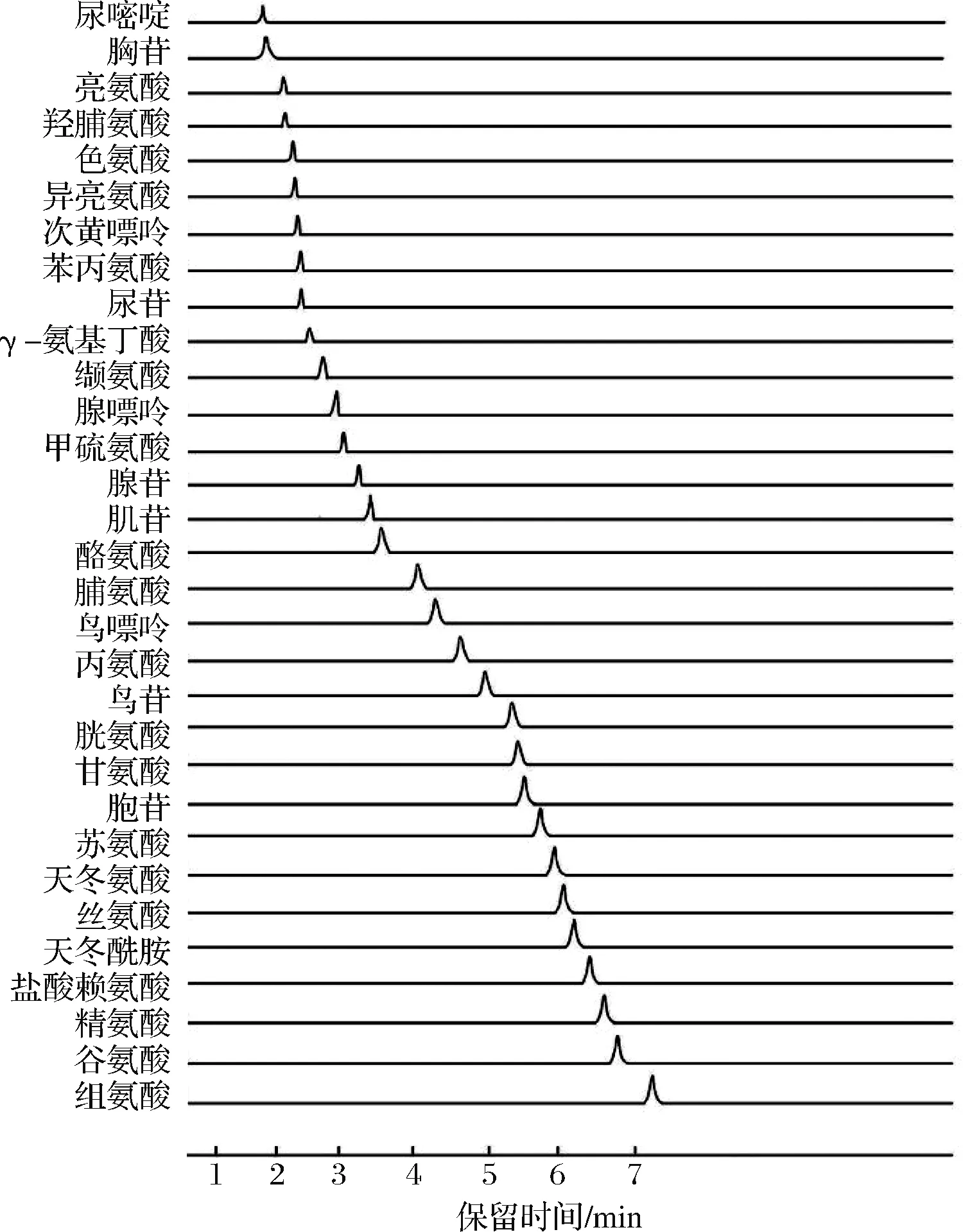
图1 21种氨基酸和10种核苷的MRM图Fig.1 UFLC-MS/MS multiple-reaction monitoring(MRM) chromatograms of 21 amino acids and 10 nucleosides
1.3.2 质谱条件
离子化模式ESI+下,采取多反应监测(MRM)检测;喷雾电压5.5 kV;离子化温度550 ℃;气帘气为241.3 kPa(35 psi),Gas1为379.2 kPa(55 psi),Gas2 为379.2 kPa(55 psi);同时对碰撞电压、去簇电压和检测离子对进行优化。31种目标成分的优化质谱检测条件参数见表2。

表2 31种目标成分的优化质谱检测条件参数Table 2 Optimized MS/MS spectrometry detection condition parameters of 31 target components
1.3.3 溶液制备
1.3.3.1 对照品溶液制备
精密称取天冬氨酸、天冬酰胺、丝氨酸、丙氨酸、甘氨酸、缬氨酸、谷氨酸、甲硫氨酸、异亮氨酸、精氨酸、组氨酸、胱氨酸、苯丙氨酸、亮氨酸、苏氨酸、酪氨酸、羟脯氨酸、脯氨酸、色氨酸、γ-氨基丁酸、盐酸赖氨酸、尿嘧啶、腺嘌呤、胞苷、肌苷、鸟苷、胸苷、腺苷、尿苷、鸟嘌呤、次黄嘌呤对照品适量,分别置25 mL容量瓶中,加超纯水配制成0.16、0.18、0.12、0.12、0.14、0.13、0.11、0.14、0.18、0.12、0.13、0.13、0.13、0.12、0.11、0.15、0.13、0.11、0.17、0.17、0.15、0.17、0.13、0.11、0.15、0.12、0.15、0.16、0.11、0.13、0.13 mg/mL的对照品储备液。取各对照品储备液适量,加水配制成混合对照品溶液,逐级稀释,得到一系列不同质量浓度的混合对照品溶液,于4 ℃保存备用。
1.3.3.2 供试品溶液的配制
称取鲜品薄荷叶500 g,用水清洗干净,均匀铺散在托盘上,覆盖上已扎孔的薄膜,置于-20℃冰箱预冻,随后将其置于真空冷冻干燥机[19-21],直至水分含量达到8%以下,即干燥完成。取薄荷粉末(过40目筛)1.000 g,置于100 mL容量瓶中,加入20 mL超纯水,室温超声处理(100 kHz)提取30 min,吸取上清液于4 500 r/min转速下离心10 min,过0.22 μm 微孔滤膜,供分析。
1.3.4 线性关系考察、检测限和定量限
精密吸取“1.3.3”项下不同浓度系列对照品溶液及混合对照品储备液各1 μL,按照“1.3.1”和“1.3.2”项下色谱-质谱条件进样测定,以对照品的峰面积积分值(Y)为纵坐标,对照品的质量浓度(X)为横坐标,得出回归方程、相关系数(r)、线性范围。以信噪比(S/N)约为3 计算各成分的检测限(LOD),以信噪比(S/N)约为10,计算各成分的定量限(LOQ),结果见表3。
1.3.5 方法学考察
1.3.5.1 精密度试验
精密吸取一定浓度的混合对照品溶液,按照“1.3.1”和“1.3.2”项下色谱-质谱条件连续进样6次,得出21种氨基酸和10种核苷对照品峰面积的RSD在0.20%~3.36%。具体数据见表4。
1.3.5.2 重复性试验
精密称取S5—薄荷样品6份,每份1.000 g,按照“1.3.3.2”项下方法制备供试品溶液,按照“1.3.1”和“1.3.2”项下色谱-质谱条件进样测定,计算21种氨基酸和10种核苷的质量分数的RSD在0.21%~3.60%。具体数据见表4。

表3 21种氨基酸和10种核苷的线性关系考察Table 3 Investigation of liner relationship of 20 amino acids and 10 nucleosides
1.3.5.3 稳定性试验
取S5—薄荷样品的供试品溶液,分别在 0、2、4、8、12、24 h时按照“1.3.1”和“1.3.2”项下色谱-质谱条件下进样分析,测定21种氨基酸和10种核苷成分峰面积的RSD值,RSD在0.65%~3.84%。具体数据见表4。
1.3.5.4 加样回收率试验
精密称取S5—薄荷样品6份,每份1.000 g,分别加入与1.000 g样品中各待测成分含量相当的对照品,按照“1.3.3.2”项下方法制备加样回收供试品溶液,按照“1.3.1”和“1.3.2”项下色谱-质谱条件下进样测定,计算加样回收率和相对标准偏差,结果见表4。31种成分的平均加样回收率在94.18%~98.76%,相对标准偏差在1.17%~3.56%。

表4 21种氨基酸和10种核苷方法学考察 单位:%Table 4 Methodological study of 21 amino acids and 10 nucleosides
2 结果与分析
2.1 样品测定结果
按照“1.3.3.2”项下方法制备供试品溶液,按照“1.3.1”和“1.3.2”项下色谱-质谱条件进样得相应的峰面积,根据对应的标准曲线计算出供试样品中21种氨基酸和10种核苷类成分的含量,结果见表5。

表5 薄荷中21种氨基酸和10种核苷的含量测定结果 单位:μg/gTable 5 Determination results of 21 amino acids and 10 nucleosides in peppermint
2.2 主成分(PCA)分析
由于薄荷样品中各成分在量纲和数量级上存在较大差异,为更好地分析结果,将原始数据进行标准化处理后,对21种氨基酸和10种核苷含量分别应用SPSS 23.0软件进行主成分(PCA)分析。以特征值大于1,累积贡献率大于70%为提取标准。
提取了PCA初始因子载荷矩阵,因子载荷矩阵主要说明主成分在各变量上的载荷,载荷越高,越相关。在氨基酸中,甘氨酸、谷氨酸、苏氨酸、胱氨酸、γ-氨基丁酸在PC1上有较高的载荷,说明PC1能反映这5种氨基酸的信息;同理,PC2能反映脯氨酸、丙氨酸的信息。在核苷中,尿嘧啶、腺嘌呤、胞苷、尿苷、鸟嘌呤在PC1上有较高的载荷,说明PC1能反映这5种核苷成分的信息;同理,PC2能反映胸苷的信息。综上,不同产地薄荷的氨基酸类成分中,甘氨酸、谷氨酸、苏氨酸、胱氨酸、γ-氨基丁酸、脯氨酸、丙氨酸为主要成分;同理,在核苷类成分中,尿嘧啶、腺嘌呤、胞苷、尿苷、鸟嘌呤、胸苷为主要成分。
2.3 TOPSIS分析
分别以氨基酸和核苷类成分以及总成分含量为分析指标,采样TOPSIS分析方法对6份样品进行综合分析,得出排序结果。
2.3.1 归一化处理
将6份样品中 21种氨基酸和 10种核苷成分的含量数据矩阵分别进行归一化处理,并建立相应矩阵,计算α值,如公式(1)所示:
(1)
式中:αij表示第i个评价对象在第j个指标上归一化处理后的取值,Xij表示第i个评价对象在第j个指标上的取值。
2.3.2 最优与最劣方案
根据归一化处理后的样本情况,得到最优(Z+)和最劣(Z-)值向量。
2.3.3 相对贴近度(Ci)的计算
相对贴近度根据公式(2)计算:
(2)
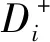
2.3.4 TOPSIS分析结果
按照Ci大小将各评价对象排序,Ci值越大,表示综合品质越好。6份样品中 21种氨基酸和 10种核苷类成分 TOPSIS 分析结果见表6。
结果表明,以氨基酸为分析指标,S4样品最佳;以核苷为分析指标,S2样品最高;以总成分为分析指标,S1样品最高。

表6 6份样品中21种氨基酸和10种核苷类成分TOPSIS分析结果Table 6 Results of TOPSIS analysis of 21 amino acids and 10 nucleosides in 11 samples
3 讨论
各产地样品在氨基酸和核苷酸样品的组成和比例均存在一定差异。从总氨基酸含量来看,亳州产样品总氨基酸含量高达48 337.11 μg/g,阜阳次之,商丘最低。氨基酸成分以谷氨酸平均含量最高(22 710.19 μg/g),天冬酰胺、组氨酸、羟脯氨酸、天冬氨酸等含量次之,脯氨酸平均含量最低(5.28 μg/g)。从核苷酸总量来看,阜阳产样品总核苷含量为2 309.02 μg/g,亳州次之,商丘最低。核苷类成分以鸟嘌呤平均含量最高(12 677.08 μg/g),尿嘧啶、胞苷等次之,腺苷平均含量最低(0.83 μg/g)。由此说明产区环境生态因子对薄荷中氨基酸和核苷类成分的合成积累影响较大。TOPSIS综合分析结果显示, 就总成分而言, S1(安徽阜阳) 样品薄荷相对较优。
本试验建立了UFLC-MS/MS同时测定3个不同产地薄荷中21种氨基酸和10种核苷含量的方法,比较了不同产地对薄荷中氨基酸和核苷类成分的影响,综合评价显示,阜阳产薄荷的综合质量最优,亳州其次,商丘综合质量最差。通过PCA和TOPSIS对药食两用薄荷质量进行评价,为优选薄荷最优产地提供理论依据,同时为进一步探索评价药食两用薄荷的内在质量与控制提供依据及新的质量综合评价参考方法。

