CT 引导肝肿瘤热消融治疗穿刺路径规划方法研究
张 睿,周著黄,吴薇薇,高宏建,吴水才*
(1.北京工业大学生命科学与生物工程学院,智能化生理测量与临床转化北京市国际科研合作基地,北京100124;2.首都医科大学生物医学工程学院,北京100069)
0 引言
肝细胞癌(hepatocellular carcinoma,HCC)是严重威胁人们生存质量的恶性肝肿瘤,其致病原因多样,可能与病毒、酗酒、脂肪肝和肝免疫缺陷等相关[1]。因其致死率高,故早期诊断和治疗至关重要[2]。早期肝肿瘤患者可接受手术切除、肝移植和肝肿瘤消融等手术治疗,其中手术切除为首选治疗方案[3],但仅有不足20%的患者能够实施切除手术,而肝源的缺乏限制了肝移植的推广。因此,肝肿瘤局部消融治疗已成为肝肿瘤的根治性措施之一[4]。
肝肿瘤局部消融术的分类多样,以微波/射频消融术的应用最广[4-6]。它是基于患者的医学影像信息,由经验丰富的临床医师将消融天线/电极(消融针)经皮刺入病灶区域,对肝肿瘤细胞进行原位灭杀的微创治疗。按照手术阶段可将肝肿瘤局部消融分作术前、术中和术后3 个阶段。术前的穿刺路径规划是消融治疗成功的关键,需要遵循诸多临床的实际需求(临床约束条件)。路径规划的难点在于患者腹腔解剖结构并非直接可见,仅凭医师的主观决策难以兼顾择优多项临床约束条件。不合理的路径规划或使得肿瘤消融不完全,导致肝肿瘤局部复发,显著降低患者生存期;或过度消融健康组织,影响肝脏正常代谢,诱发与胆管、肝血管相关的后遗症,严重时甚至导致血胸、气胸、感染或肿瘤细胞扩散[7]。因此,研究人员致力研发消融术前的计算机辅助路径规划系统,引导临床医师进行安全、高效的路径规划。
针对肝肿瘤的计算机辅助路径规划算法的相关综述可以参考本课题组发表的文献[8]。2 个研究团队的成果推动了肝肿瘤路径规划算法的发展:Villard和Baegert 等人的团队[9-13]基于患者术前采集的医学影像,对患者腹腔结构进行多边形面绘制,将每个用于重构腹部皮肤的多边形视作备选的穿刺(进针)区域,借助Nelder-Mead 单纯形优化算法,筛选出可行进针区域,并将每个多边形顶点与肿瘤形心间的连线视作备选的穿刺路径,构建度量临床弱约束条件的评估函数,对不同约束的评估值加权求和从而优选出最优穿刺路径。这种路径规划算法的准确性与运行效率严重依赖于面绘制过程中多边形的分辨力与重构质量,一定程度上限制了算法的潜力[8]。Schumann 等[14-17]的团队为避免上述缺陷提出了针对肝肿瘤消融术的自动路径规划算法[14-15]与半自动路径规划算法[16-17],其算法的核心在于以肿瘤的形心为原点,向患者腹部表面进行圆柱投影,通过投影过程中的2 个方向偏转角将患者腹部表面离散采样,于患者体表得到若干备选穿刺点。这种规划算法的精度与效率取决于方向偏转角的离散采样程度;同时,理想的圆柱投影的承接面是标准的圆柱表面,投影中心位于圆柱的中轴线。而Schumann 等[14-17]的算法将投影中心置于肿瘤形心(通常不在人体腹腔的中轴线上),使得偏转角的离散采样在患者腹部表面的采样间距不均,故而备选穿刺路径的精度也会受到影响。因此,Schumann 认为“需在求得的可行进针区域边缘预留2 mm 以上的误差边界”[5],但这无疑增加了复杂病例的术前穿刺路径规划难度。上述路径规划算法是针对单一小肿瘤(直径≤3 cm)进行单次消融治疗设计的,大肿瘤(直径>3 cm)的消融路径规划更为复杂,但理论上是将大肿瘤尽可能少地分隔成若干无缝拼接的连通区域,再针对每一连通子区进行多针协同消融或单针多次消融。如此,在消融针的穿刺路径规划时,需要考虑的临床约束条件与单针单次消融是类似的。本文针对现有算法中精度不足的问题,提出了一种CT 引导肝肿瘤消融治疗穿刺路径的计算机辅助规划算法。
1 方法
1.1 临床多约束条件
随着医学影像处理和可视化技术的发展,研究者将消融治疗的临床需求和目标量化成了多项临床约束条件,这是计算机辅助路径规划算法的规划准则。Baegert 等[13]将多项临床约束归整并分为强约束(hard constraints)条件和弱约束(soft constraints)条件两类,强约束条件是路径规划必须满足的条件,否则将直接导致路径规划的失败,通过强约束条件可以在患者腹部体表筛选出可行进针区域;弱约束条件是路径规划过程中需尽可能满足的优选条件,能够在可行进针区域中优选出最佳的穿刺路径。这些临床约束条件包括:
(1)强约束条件:①规划路径应规避腹腔内的风险器官与组织,包括肺、脾、胃、骨骼、神经、主血管等(记为H1)。②规划路径的穿刺深度应严格小于消融针长度(记为H2)。③规划路径与肝包膜的夹角至少要大于临床常规阈值(20°),以免滑针(记为H3)。④规划路径应包含足够的经肝深度(>5 mm),用以止血和消融针固定(记为H4)。
(2)弱约束条件:①规划路径应距腹腔内的风险器官与组织尽量远(记为S1)。②规划路径的穿刺深度应尽量浅(记为S2)。③规划路径与肝包膜的夹角尽量大(记为S3)。④沿规划路径进行消融的凝固区应在肿瘤边界外包含一个5~10 mm 的安全边界(记为S4)。⑤规划路径与患者术前采集影像的横截面与冠状面的夹角尽量小(记为S5)。⑥沿规划路径进行消融时尽量减小对健康肝脏组织的破坏(记为S6)。
本文算法涉及全部的强约束条件(H1~H4)以及部分弱约束条件(S1~S4),这些是自动路径规划算法的核心。弱约束条件S5 的提出是为了满足临床医生路径规划的习惯和穿刺操作的便捷,并非直接影响穿刺路径规划成败的技术需求。弱约束条件S6 则偏向另一研究分支——消融凝固区仿真,建立一个随消融时间而扩张的仿真凝固区,以期在覆盖含安全边界病灶的前提下减少对健康肝脏组织的误消融。
1.2 满足强约束条件的可行进针区域规划
满足强约束条件的可行进针区域规划算法中,算法输入包括患者的腹部表层皮肤、腹腔内涉及路径规划的脏器(通常包括患者的胃、肺、脾、肾、肝等)、腹腔主要的脉管结构、骨骼和肝肿瘤病灶。部分相关结构的分割算法可参考本课题组其他研究[18-20]。算法输出是在患者CT 图像包围盒表面的二值分区(可行/不可行进针区域),患者腹腔CT 图像的包围盒即由患者CT 序列三维重构结果的6 个表层平面组成。本算法的核心在于将患者腹腔风险组织和不满足强约束条件的风险区域进行立方体映射,建立起风险组织和风险区域与CT 图像包围盒表面坐标间一一对应的关系。其中,风险组织和风险区域投影在包围盒表面的覆盖范围内不能实行穿刺。
1.2.1 规划路径应规避腹腔内的风险器官与组织(H1)
综合绘制精度与效率的考虑,对需要规避的腹腔风险器官和组织采用Marching Cubes 算法[21]提取等值面进行三维表面重构,得到患者腹腔解剖环境。规避即要求规划路径不可触碰或贯穿风险结构,为便于理解,风险结构仅以腹腔内的骨骼为例,如图1(a)所示。将蓝色肿瘤视作靶点,规避风险结构强约束条件H1 进针区域示意图如图1(b)所示。

图1 满足强约束条件H1 的进针区域规划示意图
为规避图1(a)所示腹腔场景的风险结构(骨骼),使用了基于透视投影的立方体映射(cube mapping)[5,22]算法。将风险结构通过透视投影映射在患者腹腔CT 图像的包围盒表面,如图2 所示。投影过程中,投影相机置于肿瘤形心,朝患者CT 图像的6 个正交表面分别进行透视投影,投影结果由对应的包围盒表面承接。
传统立方体映射算法具有2 个先决条件:其一,相机需固定在立方体环境中心;其二,相机的锥形视角固定为90°。基于先决条件,相机焦距方向分别固定为笛卡尔坐标系的平行方向(每一坐标轴正负方向各一次)进行透视投影。但在实际消融术的环境中,肿瘤并非位于患者腹腔中心,且固定相机的锥形视角会使投影平面产生错位。因此,为获得风险组织投影与CT 图像包围盒表面坐标之间正确的对应关系,需对传统的立方体映射进行校正。

图2 立方体映射算法原理示意图
理想的校正策略即自适应获得合适的相机焦距方向和恰好捕获单一包围盒平面的对应锥形视角。但这种策略的运算复杂,且运算精度难以满足实际需求。为此,本研究简化了所需的校正策略:首先,相机焦距方向依旧分别固定为笛卡尔坐标系的平行方向,并自适应地增大视角,使得包围盒单侧平面的完整信息能够由一次透视投影捕获,自适应的准则为允许视角大于捕获当前平面所需的最小视角(即>3°)。然后,对非当前平面的冗余信息裁剪,仅保留当前平面的有效渲染。最后,为建立裁剪所得的投影平面坐标与患者CT 图像包围盒表面坐标的一一对应关系,需要依据包围盒的尺寸进行线性插值运算,得到最终校正的透视投影结果。以图1(a)构建的腹腔场景为例,其校正后的立方体映射算法结果如图3 所示。为清晰区分患者CT 图像包围盒的不同表面,以不同的颜色进行渲染。对立方体映射算法结果进行二分类,被风险结构(骨骼)覆盖的白色区域视作不可行进针区域,其余彩色区域视作可行进针区域。

图3 校正后立方体映射效果的包围盒展开图
1.2.2 规划路径的穿刺深度应严格小于消融针长度(H2)
强约束条件H2 是穿刺深度约束,需计算患者体表距肿瘤形心的距离是否满足需求(<15 cm)。图4(a)示意了穿刺深度与消融针长度的限制关系,图像包围盒边框上红色区域示意了不满足强约束条件H2 的不可行进针区域,绿色区域则示意可行进针区域。图4(b)示意患者腹部皮肤的体素集,计算体素集内每一体素与肿瘤形心的距离后,去除符合强约束条件H2 的体素区域,剩余的体表体素集构成了不满足强约束条件H2 的风险区域[如图4(c)所示],将其进行立方体映射,在CT 图像包围盒表面标记不可行进针区域。

图4 满足强约束条件H2 的进针区域规划示意图
1.2.3 规划路径与肝包膜的夹角需大于临床阈值(H3)
强约束条件H3 的实现与强约束条件H2 的实现方式类似,分别计算患者腹部皮肤的体素集与肝肿瘤形心连线的方向向量与对应肝包膜表面的夹角,该夹角需满足临床阈值要求(>20°),如图5(a)所示。从患者腹腔皮肤[如图5(b)所示]体素集中删去满足强约束条件H3 的体素,剩余的体表体素集被视作不满足强约束条件H3 的风险区域[如图5(c)所示],对其进行立方体映射,于包围盒表面上获得不满足强约束条件H3 的不可进针区域。

图5 满足强约束条件H3 的进针区域规划示意图
1.2.4 规划路径应包含足够的经肝深度(H4)
进针路径包含足够的经肝深度(>5 mm),如图6(a)所示,图像包围盒边框上红色区域对应经肝深度较浅的区域,即不满足强约束条件H4 的不可行进针区域。实施时,将预期消融区(含安全边界)膨胀5 mm,若膨胀后的体素集超出肝脏表面,则对应区域标记为不满足强约束条件H4 的风险区域,如图6(b)所示。蓝色区域即预期消融区,绿色区域为预期消融区膨胀5 mm 后未超出肝脏轮廓的区域,而红色区域则为超出肝脏轮廓的风险区域。将红色风险区域进行立方体映射,于包围盒表面获得不满足强约束条件H4 的不可行进针区域。
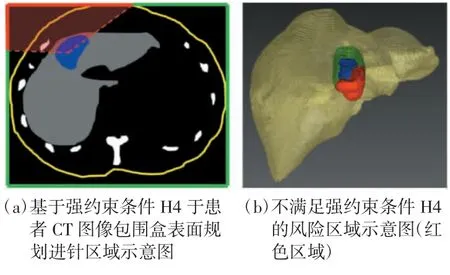
图6 满足强约束条件H4 的进针区域规划示意图
将完整的风险结构(H1)/区域(H2~H4)进行改进的立方体映射,并对映射结果进行二值化分类(被风险结构、区域阻挡的区域灰度赋值为0,未被阻挡的区域灰度赋值为1),即可在患者CT 图像包围盒表面得到最终的可行进针区域,如图7 所示。其中,风险结构包含了肺、胃、脾、肾、血管和骨骼,白色区域即划分出的可行进针区域。在本算法自动规划的可行进针区域内随机选择一点(见红色箭头)与肝肿瘤的形心进行连接,即可得到一条可行穿刺路径。将该路径显性绘制在该患者的腹腔三维重构结果中(如图8 所示),旋转绘制场景,可以看出规划的穿刺路径由患者右侧肋骨间隙穿过,指向肿瘤形心,其间未触碰任何风险结构或区域。

图7 基于强约束条件H1~H4 于患者CT 图像包围盒表面获得的可行进针区域示意图

图8 基于强约束条件H1~H4 于患者腹腔结构三维体绘制环境中验证穿刺路径规划算法示意图
1.3 满足弱约束条件的穿刺路径优选
在患者体外筛选出可行进针区域是完整的路径规划的前提,此时可行进针区域内每一坐标与肿瘤靶区形心的连线皆可视作备选的穿刺路径,但还需在备选穿刺路径中优选出一条或几条最优的穿刺轨迹推荐给临床医生参考,这属于多约束目标决策与数值优化[8]。为从可行进针区域内获取最优规划路径,本研究为涉及的每项弱约束条件建立对应的评分标准,并将评分以加权乘积的形式整合,以此对可行进针区域内的所有备选规划路径进行评分,将评分最优的备选路径视作最终所需的规划路径。
1.3.1 规划路径应距腹腔内风险器官与组织尽量远(S1)
为了满足弱约束条件S1,需求取备选规划路径与风险结构的实际距离。首先,参照文献[14]选用欧氏距离变换算法(distance transform,DTF),计算空间内每一点与风险结构的实际距离,并以灰度值的强弱示意距离的远近,图9(a)为图1 场景的欧氏距离变换结果(某一横截面切片),其中灰度值越高示意该点与风险结构(骨骼)越远。
随后对欧氏距离映射结果进行最小密度投影(minimum intensity projection,MinIP)体绘制,获得每一条备选路径与风险组织结构的最小距离。该过程相当于遍历备选穿刺路径上每一点与风险结构的距离,并将这些距离当中的最小值返回作为该备选路径与风险结构的实际距离,图9(a)中MinIP 体绘制结果如图9(b)所示。
最后,使用本文提出的校正立方体映射算法将MinIP 体绘制结果透视投影在患者CT 图像的包围盒表面[如图9(c)、(d)所示],并按公式(1)将投影图像的灰度值归一化,得到Ri。其结果的灰度强度能够评估备选规划路径相对弱约束条件S1 的满足程度(灰度强度越高,备选穿刺路径对弱约束条件S1 的满足程度越高)。图9(c)、(d)中灰度值越强则示意该点对应的穿刺路径与风险结构距离越远,获得对应弱约束条件S1 的评估值越高。这种借灰度值强弱反映对应规划路径对约束条件满足程度的图像被称作灰度约束图,图9(c)、(d)即为弱约束条件S1 对应的灰度约束图。

其中,di为弱约束条件S1 对应的灰度约束图中第i条备选穿刺路径距风险结构的距离灰度值;dmin与dmax为弱约束条件S1 的灰度约束图中的灰度极小值和极大值。
1.3.2 规划路径的穿刺深度应尽量浅(S2)
弱约束条件S2 的实现同样与距离有关,因此获取弱约束条件S2 对应的灰度约束图流程与S1 相似,但不能直接使用患者CT 图像包围盒表面的每个坐标与肿瘤形心的距离,而应该计算患者腹腔皮肤表面与肿瘤形心的距离。因此,本研究仅对患者皮肤表面内包含的空间位置进行DTF 运算,并对运算结果进行最大密度投影(maximum intensity projection,MIP)体绘制,最后将体绘制结果进行校正立方图映射,得到弱约束条件S2 对应的灰度约束图。有别于弱约束条件S1 的处理,使用MIP 体绘制的原因在于:备选路径每一点与风险结构的最小距离被定义为该路径与风险结构的实际距离,而备选路径每一点与对应体表点的最大距离才是该路径的进针深度。

图9 弱约束条件S1 对应的灰度约束图及中间步骤示意图
弱约束条件S2 的欧氏距离变换和MIP 体绘制结果如图10(a)、(b)所示。将弱约束条件S2 的灰度约束图以公式(2)归一化,得到Li作为备选路径对弱约束条件S2 的满足程度评分,结果如图10(c)、(d)所示。
其中,li为弱约束条件S2 对应的灰度约束图中第i条备选穿刺路径穿刺深度灰度值,灰度值越强示意该点对应的穿刺路径穿刺深度越深,获得对应弱约束条件S2 的评估值也就越低;lmin与lmax为弱约束条件S2 的灰度约束图中的灰度极小值和极大值。
1.3.3 规划路径与肝包膜的夹角尽量大(S3)
弱约束条件S3 可直接于患者CT 图像的包围盒表面进行,将包围盒表面每一点与肿瘤形心的连线视作备选规划路径,计算该路径与肝脏表面的夹角,并以灰度值示意。最后将灰度约束图的灰度值按公式(3)归一化,得到Ai作为针对弱约束条件S3 的灰度约束图,如图11(a)、(b)所示。

其中,αi为弱约束条件S3 对应的灰度约束图中第i条备选穿刺路径与肝包膜夹角的灰度值,灰度值越强示意该点对应的穿刺路径与肝包膜的夹角越大,获得对应弱约束条件S3 的评估值也就越高;αmin与αmax为弱约束条件S3 的灰度约束图中的灰度极小值和较大值。

图10 弱约束条件S2 对应的灰度约束图及中间步骤示意图

图11 弱约束条件S3 对应的灰度约束图
弱约束条件S4 仅需在处理前将肿瘤结构膨胀5~10 mm 视作安全边界即可,不用构建单独的灰度约束图。至此,将3 个弱约束条件S1~S3 的灰度约束图依照公式(4)加权,得到Gi作为备选规划路径的最终评分。据此,可选择2~3 个灰度局部极值优选出2~3 条最优穿刺路径。同时可以在灰度约束图上设定合适的阈值,在最优穿刺路径的邻域内进行穿刺路径的微调,并实时获得邻域内每条穿刺路径灰度约束评分。加权后的灰度约束图如图12(a)、(b)所示,规划路径效果如图13 中红色线段。
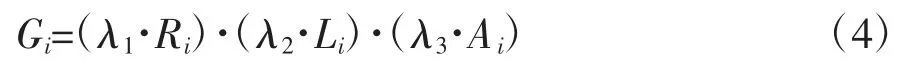
其中,λ1、λ2、λ3是权重因子,本方法优选为λ1=λ2=λ3=1/3。同时可以根据临床医师经验对权重进行相应的修改。

图12 弱约束条件S1~S3 的加权灰度约束图
1.4 穿刺路径自动规划算法的实现
本文提出的算法均在VS2010 下以C++语言实现,主要包括:基于VTK(Visualization Toolkit)工具包的等值面表面重构算法(Marching cubes)绘制患者腹腔解剖结构场景;基于VTK 的Z-Buffer 投影算法修改完成本研究对风险结构和风险区域进行改进的立方体映射;基于VTK 的vtkFixed PointVolumeRay CastMapper 类实现MinIP/MIP 体绘制;基于ITK(Insight segmentation and Registration Toolkit)工具包实现欧氏距离变换以及投影平面的裁剪与插值。

图13 基于弱约束条件S1~S4 于患者腹腔结构三维体绘制环境中验证穿刺路径规划算法示意图
2 结果
对提出的基于CT 图像引导的肝肿瘤热消融术穿刺路径规划算法进行了回顾性研究。实验数据选用法国消化系统癌症治疗研究所公开的增强CT图像数据集3Dircadb,CT 图像的像素尺寸为0.56~0.86 mm,层厚1~4 mm,切片数64~502 层,层分辨力为512×512 像素。数据集内含放射学专家逐层手工勾勒的腹腔关键器官与组织,包括肺、脾、肾、肝、胃、骨骼与腹腔主要的脉管系统,以此构建患者的腹腔解剖环境。从中选择10 例数据并对其中18 个小肝肿瘤(<3 cm)进行穿刺路径规划。
由于热消融穿刺路径规划并不存在绝对的金标准,因此本研究参考其他相关研究[14-17],请2 位经验丰富的介入放射科医生对穿刺路径自动规划算法的合理性进行评估,评估分作4 个级别:优异、尚可、不确定和不合理,评估结果见表1。此外,所提出的穿刺路径自动规划算法生成的穿刺路径与2 位医生手工规划的穿刺路径进行定性比较,比较结果分作4个级别:优于手工规划、与手工规划相当、不确定与次于手工规划,比较结果见表2。

表1 路径规划算法结果合理性评估条

表2 自动/手动路径规划算法结果比较条
从结果来看,2 名专家认为超过78%的路径规划是合理的,超过39%的路径规划结果优于医师手工规划的效果。本文算法生成弱约束条件S1、S2、S3的灰度约束图平均需要50、40、40 s,整体路径规划的时间显著低于医师手工路径规划时间。同时,自动穿刺路径规划算法能够为医师提供2~3 条备选穿刺路径,医师能够依据灰度约束图的阈值信息对穿刺路径在一定区域内进行微调,补偿由患者呼吸运动和消融针弹性形变引起的穿刺路径偏差问题。
3 讨论
本文提出了一种基于CT 引导的肝肿瘤热消融术前路径规划算法,基于临床强约束条件筛选可行进针区域,基于临床弱约束条件生成对应的灰度约束图,于灰度约束图的加权图中择优规划穿刺路径。在与2 名经验丰富的介入放射科医生的讨论与验证下,证明了本文提出的路径规划算法的合理性与可行性。本算法具有如下优势:
(1)本算法有别于现有研究,将风险结构和风险区域用立方体映射算法完整地投影在患者CT 图像的包围盒表面,不存在离散采样备选路径的过程,提高了路径规划算法的精度;
(2)本算法规划的穿刺路径终点位于肿瘤的形心,起点位于患者CT 图像包围盒表面,有别于现有肝肿瘤路径规划于患者体表筛选进针起点,可以避免患者体表褶皱影响规划路径的起点精度,也可以一定程度上避免患者术中呼吸时体表进针点随患者呼吸产生的不规则位移。
(3)本算法对每个考虑的约束条件构建对应的灰度约束图,临床医师可以在算法规划的穿刺路径附近对路径进行微调,微调路径相对各约束条件的满足程度能够从对应约束条件的灰度约束图上获取。同时,临床医师还可以根据经验调节不用灰度约束图的加权权重,得到更符合自身经验的规划路径。
(4)本算法具有良好的可扩展性,如果抽象出新的临床约束条件,仅需要将其量化成新的约束条件灰度图,调整约束图的加权参数即可将新的约束条件加入已有的规划算法中。
但本算法还存在以下不足:
(1)缺乏与凝固区仿真这一约束条件的结合。凝固区仿真是一个凝固区随时间变化的动态过程,且凝固区边界的数学模型难以建立。有限元仿真是常用的凝固区模型建立方法,但模型建立的效率非常低,难以满足实际的临床需求;采用简化的凝固区模型(椭球/球体)进行简单的仿真又与实际的消融情况不符。
(2)本算法属于“直线型”路径规划,没有考虑患者的呼吸作用以及消融针刺入患者体内时产生的交互形变(组织形变和消融针形变)。不单单因为这些形变因素难以进行切合实际的建模,还因为这些形变因素对路径规划的影响难以合理地整合在“直线型”路径规划之上。这也是面向该领域所有研究者的挑战。
4 结语
本文提出了一种CT 引导肝肿瘤热消融治疗穿刺路径规划算法,考虑临床强约束条件规避腹腔风险器官和组织、消融针进针深度、进针角度和经肝距离,于患者CT 图像包围盒表面获取可行进针区域;再通过临床弱约束条件构建对应约束条件的灰度约束图,最终由加权灰度约束图择优规划出穿刺路径。在实验验证下,本文提出的路径规划算法有望指导临床医师进行肝肿瘤热消融术前的路径规划。

