RCAN1促进沙门菌诱导的NLRC4炎性体活化
秦 迪,张 杰,马 轲,高 宇,蔺小奇,胡桂秋,杨勇军
(吉林大学 动物医学学院,吉林 长春130062)
沙门菌是引起细菌性食物中毒的主要原因之一。世界范围内每年均有该菌引起的疾病的报道,其中有伤寒症状约1 600万例,有肠胃炎症状约13亿例,约300万人因沙门菌感染而死亡。沙门菌属有2 500个不同的血清型,鼠伤寒沙门菌(SalmonellaentericaserovarTyphimurium)是其中之一,具有广泛的宿主谱,能导致各种动物和人感染,表现为胃肠炎、呕吐、败血症等症状,其在环境、牲畜和野生动物中分布广泛[1-2]。由于沙门菌的流行范围广,发病率高,尤其是耐药谱的不断增宽为沙门菌的防控带来了困难,导致沙门菌病成为公共卫生中重要的人畜共患病[3]。天然免疫是抵抗病原菌感染的第一道防线,因此研究宿主天然免疫反应对病原菌及相关毒力因子的识别,从而对致病机制进行适当干预,成为寻找防治沙门菌病的新策略。
炎性体是存在于细胞中的多蛋白复合物。由NOD样受体(nucleotide binding oligomerization domain like receptors,NLR)或Toll样受体(Toll like receptors,TLR)家族的个别成员识别入侵的病原微生物病原相关分子模式以及受损或死亡细胞释放损伤相关分子模式后,组装并募集caspase-1前体。随后,活化的caspase-1对IL-1β和IL-18前体进行酶切处理,使其水解为具有生物活性的成熟形式。研究发现,沙门菌能够激活NLRP3和NLRC4炎性体。NLRC4受体在结合沙门菌鞭毛蛋白特定的表位后,在激活天然免疫应答反应的同时也会促进获得性免疫应答反应。此外,有研究表明细菌鞭毛蛋白如嗜肺军团菌[4]、类鼻疽伯克菌[5]等诱导NLRC4活化后,一些免疫细胞如巨噬细胞将病原菌吞噬到溶酶体,一方面有利于限制其增殖,另一方面,创造一个炎性环境以便于募集免疫细胞到病原菌侵染部位并清除病原菌[6]。因此,炎性体的活化在限制病原感染过程中发挥着重要作用。
钙调磷酸酶调节因子1(regulator of calcineurin1,RCAN1)主要表达在心脏、大脑、骨骼肌。钙调磷酸酶是由催化亚基A和调节亚基B形成的异源二聚体,其在细胞信号转导和机体各种生理活动中起着重要作用,如参与调控免疫反应、细胞增殖与凋亡[7]。据报道,功能失调的钙调磷酸酶与阿兹海默症[8]、唐氏综合征[9]的发生有关。然而,RCAN1在病原菌感染中的作用的研究知之甚少。因此,本试验以野生型小鼠(WT)和RCAN1基因缺失小鼠(RCAN1-/-)的骨髓来源巨噬细胞为研究对象,探究RCAN1对沙门菌诱导炎性体活化的影响。
1 材料与方法
1.1 试验动物RCAN1-/-小鼠来自Jeffery D.Molkentin (University of Cincinnati,Cincinnati,USA),遗传背景为C57BL/6J,RCAN1-/-和C57BL/6J小鼠饲养于独立通风换气笼中,昼夜各12 h循环,恒温恒湿。用于骨髓来源巨噬细胞分离的小鼠为6~8周龄,性别相同。
1.2 菌株鼠伤寒沙门菌SL1344菌株由河南科技大学程相朝教授惠赠。
1.3 主要试剂Trizol 购自Sigma公司;三氯甲烷、乙醇、异丙醇购自北京化工厂;SYBR Green 购自Roche公司;RPMI1640、FBS 购自Gibico公司;LPS 购自Invivogen 公司;沙门菌重组鞭毛蛋白购自Sigma公司;Lipofectamine2000 购自 Life Technology 公司;caspase -1、IL-1β、ASC、HRP 标记的羊抗兔、HRP 标记的羊抗鼠抗体购自Santa Cruz 公司;β-tubulin 抗体购自天津三箭生物技术有限公司;mouse IL -1β、mouse TNF-α ELISA 试剂盒购自R&D 公司。
1.4 总RNA提取和RT-PCR使用Trizol提取细胞总RNA,反转录成cDNA,检测细胞中RCAN1基因的表达情况,内参是GAPDH。引物序列见表1。
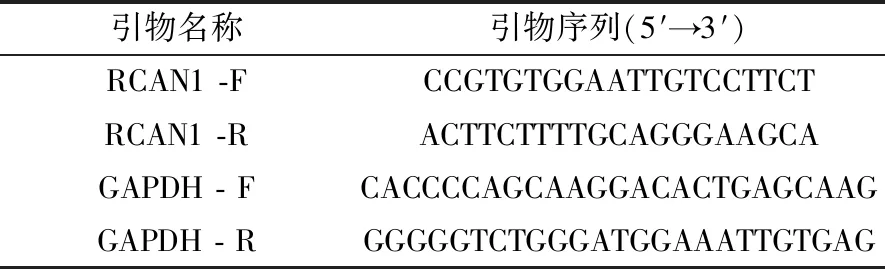
表1 引物序列
1.5 小鼠骨髓来源巨噬细胞分离培养性别相同6周龄RCAN1-/-和C57BL/6J小鼠各1只,无菌条件下分离小鼠后肢骨,RPMI1640培养基冲洗其内腔,将冲洗液4℃、1 000 r/min离心10 min,沉淀重悬于含25% 巨噬细胞集落刺激因子(LCCM)+10% FBS+1‰双抗的 RPMI1640培养基,并接种于90 mm皿中,第4天换液,第6天用胰酶进行消化,细胞计数后接种于细胞培养板中,贴壁过夜。
体外感染:首先,用500 μg/L LPS预处理小鼠BMDM 4 h,弃上清,用RPMI1640 培养基清洗细胞;随后,以MOI=20加入沙门菌感染细胞1 h,弃上清,并用RPMI1640洗去胞外沙门菌,添加含双抗和庆大培养基继续培养3 h,收集培养上清用于ELISA和Western blot检测;用细胞裂解液裂解细胞,收集细胞裂解用于Western blot检测。
1.6 鞭毛蛋白转染试验将BMDM细胞接种于96孔板,过夜,加入500 μg/L LPS预处理4 h;弃去培养基,换为无血清,无抗生素的Opti-MEM;根据脂质体2000(Lip2000)转染试剂说明书,将20 mg/L鞭毛蛋白和Lip2000混合均匀,静置20 min;将蛋白复合物添加到培养基中,轻晃混匀,6~8 h 后,收集细胞培养上清用于 ELISA 检测。
1.7 ELISA检测收集不同处理组细胞培养上清,按照R&D公司ELISA试剂盒指示说明检测IL-1β、TNF-α的分泌情况。
1.8 Western blot检测收集细胞上清后,向细胞培养皿中加入1 mL预冷的PBS,用细胞刮刀将细胞全部收集,2 000 r/min离心10 min收集细胞,加入50 μL细胞裂解液,反复吹打30 s,震荡30 s,冰上20 min,震荡30 s,使细胞充分裂解;13 000 r/min离心10 min,收集上清;随后,用BCA法测蛋白浓度并做变性处理;通过湿转法将蛋白转移到PVDF膜上,室温下5%脱脂奶粉低速震荡封闭 2 h,一抗孵育4℃过夜,TBST缓冲液中速震荡洗涤4次,每次15 min,二抗室温孵育1 h,TBST缓冲液震荡洗涤4次,每次15 min,显影。
1.9 统计学分析用SPSS软件进行统计学分析,计量资料以均数±标准差表示,组内比较采用t检验。*示P<0.05,**示P<0.01,***示P<0.001。
2 结果
2.1RCAN1基因在小鼠骨髓来源巨噬细胞的表达为了检测小鼠骨髓来源巨噬细胞中RCAN1基因在沙门菌感染过程中能否发挥作用,本试验对RCAN1基因的表达情况进行检测。通过半定量PCR的方法对BMDM细胞中RCAN1基因mRNA转录情况进行检测发现,在未感染沙门菌时,骨髓来源巨噬细胞有RCAN1基因转录;在沙门菌感染4 h后,RCAN1基因转录显著增强(图1)。由此可说明,沙门菌感染能够激活RCAN1信号,该细胞模型适用于分析RCAN1在沙门菌感染中的作用。
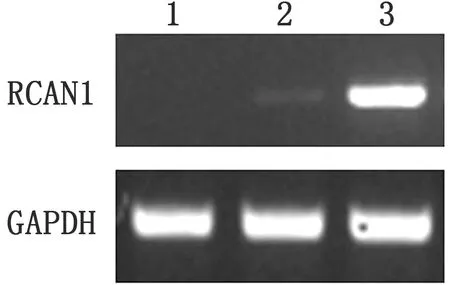
图1 RCAN1基因在小鼠骨髓来源巨噬细胞的表达情况 1.RCAN1-/-小鼠骨髓来源巨噬细胞; 2.WT小鼠骨髓来源巨噬细胞;3.沙门菌感染WT小鼠骨髓来源巨噬细胞4 h
2.2 RCAN1促进沙门菌诱导的炎性体活化为了说明RCAN1在沙门菌诱导的炎性体活化中的作用,本试验分离培养WT和RCAN1-/-骨髓来源巨噬细胞,LPS预刺激BMDM细胞后,加入鼠伤寒沙门菌SL1344(MOI=20)诱导炎性体活化。随后对细胞裂解液及细胞上清中caspase-1和IL-1β前体及活化片段,ASC寡聚化情况进行检测。结果显示,在细胞培养上清及细胞裂解液中,RCAN1基因缺失对caspase-1和IL-1β前体的表达并无影响;然而,RCAN1基因缺失后,细胞培养上清中caspase-1的裂解片段p10和IL-1β裂解片段p17的分泌显著降低(图2A,B)。此外,本试验发现RCAN1基因缺失后,ASC多聚体的形成减少,但ASC单体的表达不受影响(图2C)。综合以上结果可知RCAN1 能够促进沙门菌诱导的炎性体活化。
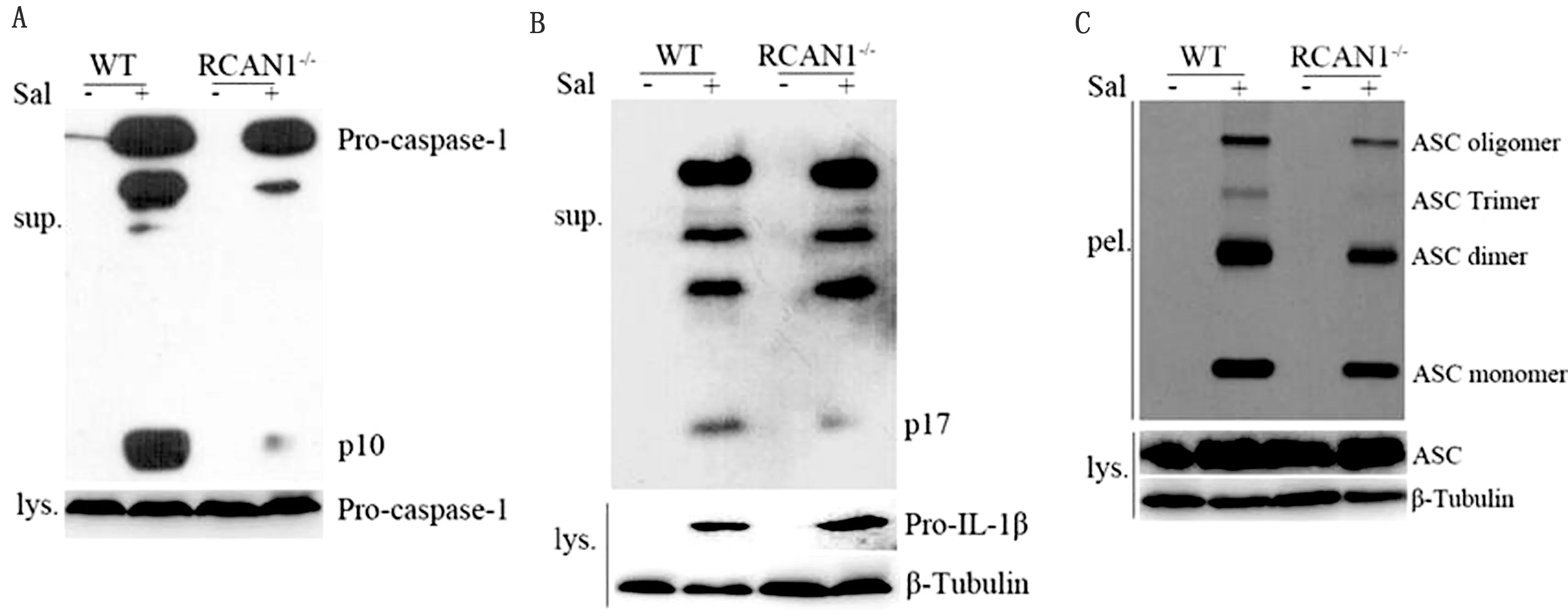
图2 Western blot 检测细胞培养上清和细胞裂解液中caspase-1(A)、IL-1β(B)、ASC(C)活化情况
2.3 RCAN1促进沙门菌诱导BMDM细胞IL-1β 的分泌为了进一步说明RCAN1促进沙门菌诱导的炎性体活化,本试验通过ELISA的方法对细胞培养上清中IL-1β分泌情况进行检测,结果发现沙门菌感染BMDM细胞后,WT小鼠来源巨噬细胞培养上清中IL -1β分泌量显著增加,而RCAN1-/-小鼠来源巨噬细胞上清仅有少量IL -1β分泌,且显著低于WT小鼠(图3A)。由此说明RCAN1促进沙门菌诱导BMDM细胞IL-1β 的分泌,促进炎性体活化。此外,本试验对非炎性体信号介导的促炎细胞因子TNF-α的分泌进行检测,RCAN1对TNF-α的分泌无影响(图3B)。以上结果说明RCAN1能够促进沙门菌诱导炎性体活化。
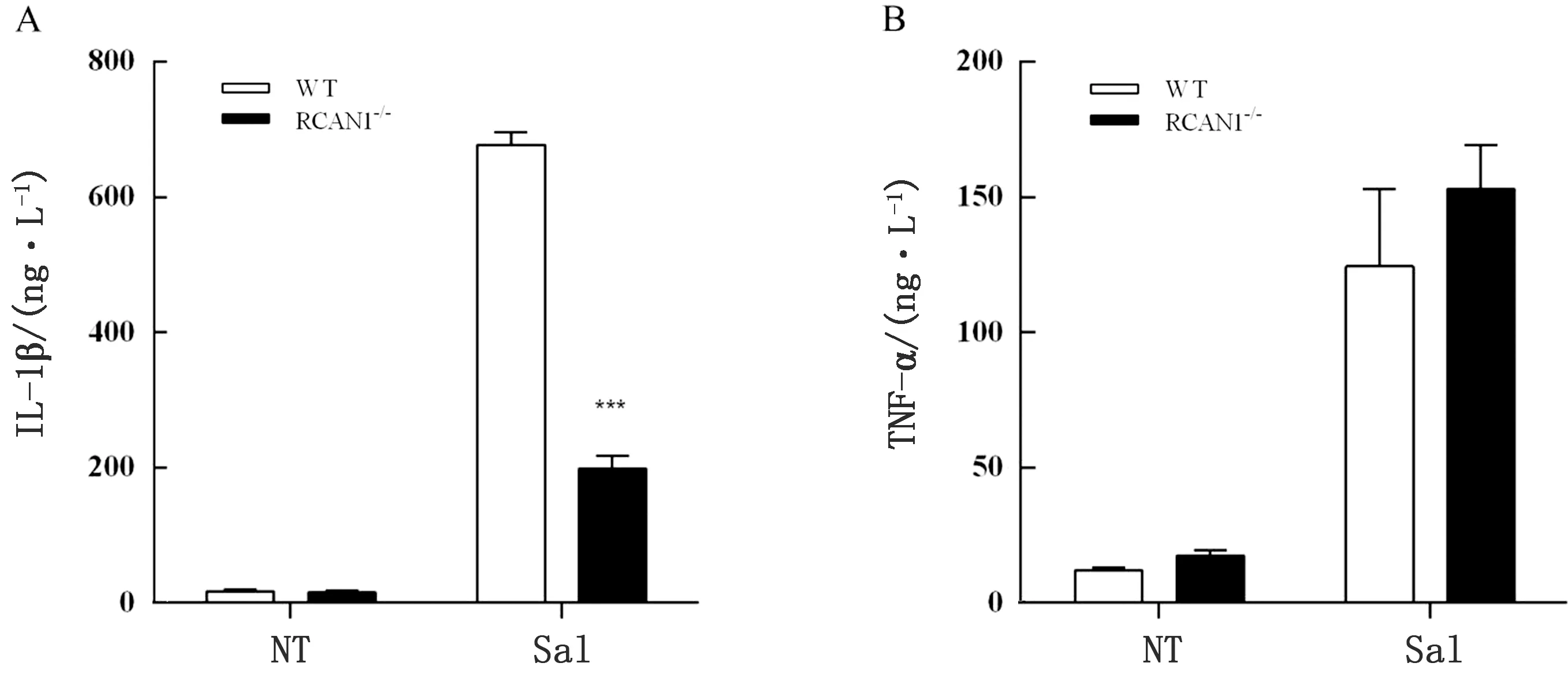
图3 RCAN1对沙门菌诱导的炎性细胞因子分泌的影响 1.Y轴表示每毫升培养上清中所含有的细胞因子的分泌量;2.X轴表示不同的分组;3.A为IL -1β ,B.为TNF-α。下同
2.4 RCAN1促进沙门菌鞭毛蛋白诱导的IL -1β分泌基于RCAN1能够调节沙门菌诱导的炎性体活化,本试验进一步分析了RCAN1对NLRC4炎性体活化的影响。本试验将沙门菌鞭毛蛋白转染到LPS预刺激的BMDM中,通过ELISA检测发现鞭毛蛋白能够显著促进IL -1β的分泌,然而,RCAN1基因缺失后,鞭毛蛋白诱导的IL -1β的分泌显著降低(图4A)。随后,对非炎性体信号介导的促炎细胞因子TNF-α的分泌进行检测,发现并且RCAN1对TNF-α的分泌并无影响(图4B)。以上结果表明RCAN1能够促进沙门菌鞭毛蛋白所诱导的IL -1β分泌,促进NLRC4炎性体活化。

图4 RCAN1对沙门菌鞭毛蛋白诱导的炎性细胞因子分泌的影响
3 讨论
钙调磷酸酶作为目前唯一一种被发现的、依赖钙调素和钙离子的丝氨酸/苏氨酸磷酸酶,在多种疾病中发挥着重要作用[10]。ERMAK等[11]发现,阿尔兹海默症患者脑组织中RCAN1的mRNA水平是正常人的2倍。MINAMI等[12]研究发现, 在 LPS诱导的小鼠败血症模型中,RCAN1基因缺失小鼠表现更高的死亡率。随着研究的深入,研究关注于RCAN1和宿主防御病原菌入侵、炎性反应的关系引起了人们对RCAN1功能的重新认识[13-14]。沙门菌能够激活炎性体。炎性体活化需要LPS所提供的第一信号,LPS能够促进参与炎性体活化的分子的转录,如pro-caspase-1和pro-IL-1β的转录;随后,由沙门菌提供第二信号激活炎性,接头蛋白ASC发生寡聚化,招募caspase-1前体并进行剪切;活化后的caspase-1将IL-1β和IL-18前体剪切成活化片段,通过细胞膜上形成的孔洞释放到细胞外。本试验结果表明,RCAN1能显著促进SL1344介导的ASC寡聚化、促进caspase -1前体的剪切成熟和 IL-1β的分泌。由此可以推断,RCAN1能够促进沙门菌诱导的炎性体活化。但是,RCAN1是如何调控沙门菌诱导炎性体活化,具体促进哪种炎性体活化也不清楚。
鼠伤寒沙门菌能够引起人和许多动物的急性肠炎,造成很高的发病率和死亡率[15-16]。当沙门菌等病原菌在感染肠上皮细胞时,其鞭毛蛋白作为主要的促炎因子,能够被TLR5识别,调节促炎因子的表达。 沙门菌进入细胞后,可被胞内模式识别受体所识别,如NLRC4。NLRC4炎性体可以通过经典途径和非经典途径限制鼠伤寒沙门菌生长。其经典途径的主要机制是免疫细胞将病原菌吞噬后,含沙门菌的囊泡与溶酶体融合,将细菌的病原相关分子模式(PAMP)的主要成分之一鞭毛蛋白释放到胞浆,被模式识别受体(PRRs)识别后,促使NLRC4炎性体形成和活化,直接清除或限制病原菌增殖,实现宿主防御。以鞭毛蛋白为主要毒力因子的病原菌除了鼠伤寒沙门菌,还有嗜肺军团菌、绿脓假单胞杆菌等。因此,研究NLRC4炎性体的活化对病原菌的防御有重要意义。本试验用LPS联合鞭毛蛋白处理WT小鼠和 RCAN1-/-小鼠BMDM细胞诱导NLRC4炎性体活化,发现RCAN1能够促进IL-1β的分泌,但对TNF-α的分泌无影响,表明RCAN1 能够正向调控NLRC4炎性体活化信号。
综上所述,本试验以RCAN1对沙门菌诱导炎性体活化的影响为研究主线,阐明RCAN1在沙门菌感染中的作用及调控机制,进一步丰富了RCAN1的理论研究,为沙门菌病的防治提供了理论基础。

