钴/铜催化构筑从2-苯基吡啶和2-溴代苯乙酮出发合成吡啶并[2,1-a]异吲哚
司 颖,李 亭
(南阳师范学院 化学与制药工程学院,河南 南阳 473061)
吡啶并[2,1-a]异吲哚是一类重要的含氮芳香杂环,广泛存在于各类天然产物[1],药物活性分子[2]以及分子传感器中[3](图1)。吡啶并[2,1-a]异吲哚在各类天然产物中的广泛应用促进了有机合成研究人员对其合成方法学的研究。在文献报道的诸多合成方法中,Bradsher课题组在上个世纪60年代报道了通过2-溴-N-苄基吡啶盐光催化分子内环化合成吡啶并[2,1-a]异吲哚的方法 (图2a)[4]。黄宪课题组报道了通过吡啶,溴代苯乙酮与硅芳基三氟甲基多组分一瓶反应合成吡啶并[2,1-a]异吲哚的一种新方法 (图2b)[5]。在 2015年, Lee 课题组发展了一种合成吡啶并[2,1-a]异吲哚的新方法学,该反应经历了一种铜催化的分子内环化以及芳构化的过程(图2c)[6]。最近,从2-苯基吡啶出发选择合适的偶合骨架合成吡啶并[2,1-a]异吲哚也取得了极大的进展(图2d)[7-9]。尽管如此,文献报道[10]的合成吡啶并[2,1-a]异吲哚的方法都具有诸多的局限,因此发展合适的方法合成这一新颖的含氮杂环对有机合成研究人员具有很大的吸引力[11]。
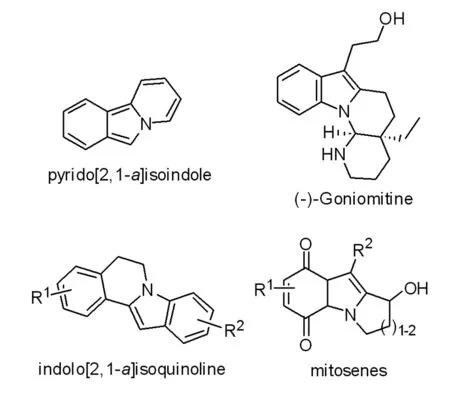
图1 含有吡啶并[2,1-a]异吲哚核心骨架的天然产物

图2 吡啶并[2,1-a]异吲哚的合成
近些年,基于2-苯基吡啶官能团化的催化化学转换在有机合成领域获得了极大的关注, 实现了一系列复杂天然产物的构建[12]。在我们研究钴催化[13-14]2-苯基吡啶与溴代苯乙酮的选择性官能团化时,我们意外在体系中分离得到了吡啶并[2,1-a]异吲哚这一复杂的含氮杂环 (图2d)。在这篇文章里,我们报道一种钴/铜催化构筑从2-苯基吡啶和2-溴代苯乙酮出发合成吡啶并[2,1-a]异吲哚的新方法。
1 吡啶并[2,1-a]异吲哚合成反应条件的优化
表 1 反应条件的优化a
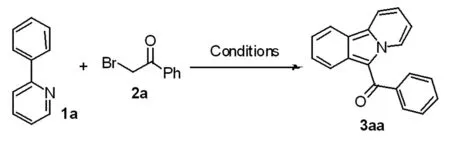

Entry反应条件产率b1CoCp∗(CO)I2 (5 mol%), CuI(10 mol%), Cs2CO3 (3.0 equiv.), 130℃, PhMe02CO2(CO)8 (5 mol%), CuI(10 mol%), Cs2CO3 (3.0 equiv.), 130℃, PhMe153Co(acac)3 (5 mol%), CuI(10 mol%), Cs2CO3 (3.0 equiv.), 130℃, PhMe274CoCl2 (5 mol%), CuI(10 mol%), Cs2CO3 (3.0 equiv.), 130℃, PhMe815CoCl2 (5 mol%), CuI(10 mol%), Cs2CO3 (3.0 equiv.), 130℃, DCE656CoCl2 (5 mol%), CuI(10 mol%), Cs2CO3 (3.0 equiv.), 130℃, DMF367entry 4 but with no CoCl208entry 4 but with no CuI09entry 4 but with no Cs2CO3010entry 4 but with Na2CO3 instead of Cs2CO33111entry 4 but with K2CO3 instead of Cs2CO3012cCoCl2 (5 mol%), CuI(10 mol%), Cs2CO3 (3.0 equiv.), 130℃, PhMe513dCoCl2 (5 mol%), CuI(10 mol%), Cs2CO3 (3.0 equiv.), 110℃, PhMe0
注:a:Conditions: 1a (0.20 mmol), 2a (0.60 mmol, 3 equiv.), catalyst, solvent (2 mL), air, 24 h. b:Yield of isolated products based on 1a. c:The reaction was performed under N2.d:The reaction was performed for 48 h.
我们选择2-苯基吡啶1a和2-溴苯乙酮2a作为模板底物来筛选反应的条件。经过一系列的初始实验诸如催化剂筛选,反应溶剂筛选,我们发现最优的反应条件为。出发5 mol% CoCl2,10 mol% CuI和3.0 当量Cs2CO3作为添加剂, 反应在130℃进行24 h,可以以81%的收率分离得到目标产物吡啶并[2,1-a]异吲哚化合物。当用氯代苯乙酮或碘代苯乙酮作为底物代替溴代苯乙酮时,溴代苯乙酮被发现具有最好的反应活性。深入的研究发现,当反应在没有CoCl2或 CuI时反应几乎不能进行。我们也发现,碳酸铯作为有机碱对反应的最有产率具有重要影响,当反应在没有碳酸铯或者用碳酸钠或碳酸钾代替碳酸铯时,反应效果均极差。此外,我们发现空气氛围对反应的发生具有决定性影响,当反应在氮气氛围下进行时,反应几乎不能发生。当反应在 110℃进行时,几乎没有目标产物分离得到。
2 吡啶并[2,1-a]异吲哚合成的底物拓展
在最优反应条件下,我们尝试探索该转换的底物以及限制。如图3所示,当甲氧基基团在苯环的碳-2或碳-4时,反应能够分别以83%或76%的收率分离得到目标产物3ba和3ca。深入研究发现,当底物的苯环上中含有吸电子或给电子基团诸如甲基,酯基,硝基,苯基,乙酰基或氟等时,反应均能顺利发生,可以以较高收率分离得到对应的吡啶并[2,1-a]异吲哚化合物。此外,我们也对底物的吡啶环开展了研究,我们发现该转换可以耐受碳-6位的氟基团,碳-3或碳-4位的甲基等。最后,我们也对底物溴代苯乙酮的普适性开展了研究。我们发现溴代苯乙酮在芳环的对位含有三氟甲基,甲基或甲氧基基团时,反应均能以较好收率得到相应的吡啶并[2,1-a]异吲哚产物。后续的研究发现,当溴代苯乙酮苯环的间位含有取代基时,反应也可顺利发生;而当溴代苯乙酮苯环的邻位含有取代基时,反应则被抑制,反应只能以极低的收率分离到痕量的目标产物。
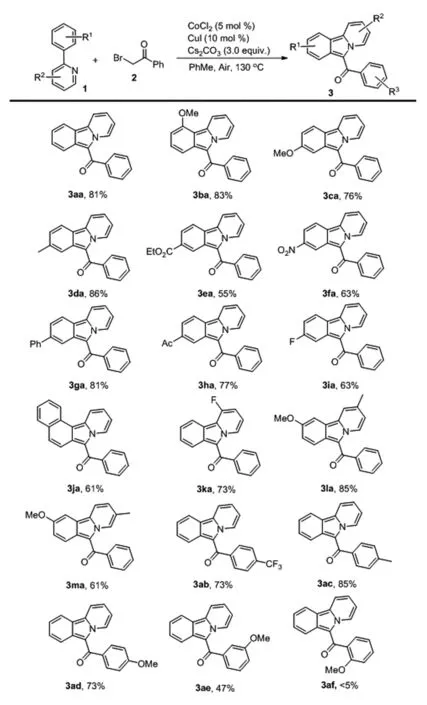
图3 吡啶并[2,1-a]异吲哚合成的底物拓展a
注:a标准反应条件: A mixture of derivative 1 (0.20 mmol), 2-bromoacetophenone 2 (0.60 mmol), CoCl2(5 mol %), CuI (10 mol %), Cs2CO3(3.0 equiv.), and toluene (2 mL) was added to a Schlenk tube under air. Then the mixture was stirred at 130℃ (bath temperature) under air for 24 h. Isolated products based on 1.
3 吡啶并[2,1-a]异吲哚合成的可能机理
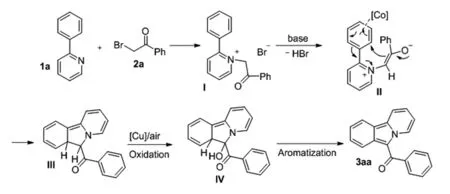
图4 吡啶并[2,1-a]异吲哚合成的可能机理
在上述实验结果以及前期报道的基础上,我们推测了化合物吡啶并[2,1-a]异吲哚合成的可能机理。如图4所示,首先,化合物1a的吡啶基团会与溴代苯乙酮反应形成中间体I,中间体I在外加碱试剂帮助下,通过CoCl2作为路易斯酸活化苯环,发生分子内环化经过你中间体II得到中间体III。中间体III在Cu/O2自由基催化体系经过中间体IV得到最终目标产物吡啶并[2,1-a]异吲哚3aa。
总结,在本文中,我们报道了一种钴/铜催化构筑从2-苯基吡啶和2-溴代苯乙酮出发合成吡啶并[2,1-a]异吲哚的方法。该方法底物简单,操作简捷,提供了一种有机化学中合成
吡啶并[2,1-a]异吲哚的好方法。考虑到该方法的简洁性以及吡啶并[2,1-a]异吲哚这一含氮杂环在有机化学中的重要性,我们认为该转化在有机化学中具有很好的应用前景。关于该方法的机理研究以及合成应用的研究尚在进行中。

