糖尿病大鼠心肌缺血再灌注损伤与线粒体Lon蛋白酶水平的关系
王文杰,杨文曲,韩冲芳,贺建东,李浩甲,任鹏鹏(山西医科大学麻醉学院麻醉教研室,太原 03000;山西白求恩医院,山西医学科学院麻醉科;通讯作者,E-mail:hanchongfang003@foxmail.com)
糖尿病是心肌梗死的独立危险因素,糖尿病患者围术期心血管事件的发生率增加。研究表明,在心肌缺血再灌注过程中,糖尿病因素会加重心肌损伤[1]。而线粒体氧化应激在心肌缺血再灌注损伤与糖尿病并发症的发生发展过程中均起到了重要作用[2]。线粒体Lon蛋白酶(LonP1)作为线粒体基质内主要的氧化蛋白酶,在线粒体应对氧化应激的过程中具有重要作用[3]。糖尿病因素加重心肌缺血再灌注损伤是否与LonP1含量有关尚不清楚。本研究拟评价糖尿病大鼠心肌缺血再灌注时LonP1含量的变化,为临床研究提供参考。
1 材料与方法
1.1 动物及分组
清洁健康雄性SD大鼠40只,2-3月龄,体质量200-250 g,由山西医科大学实验动物中心提供。实验大鼠适应性饲养1周后,采用随机数字表法分为4组(n=10):假手术组(sham组)、心肌缺血再灌注组(I/R组)、糖尿病+假手术组(DM+sham组)、糖尿病+缺血再灌注组(DM+I/R组)。
1.2 糖尿病大鼠模型建立
参考文献[4]制备大鼠糖尿病模型。DM+sham组与DM+I/R组在普通饲料适应性喂养2周并禁食12 h后,腹腔注射1%链脲佐菌素60 mg/kg,24 h后尾静脉采血测定空腹血糖。继续喂养4周,以持续空腹血糖≥16.7 mmol/L,并出现明显多饮、多食、多尿以及体质量下降等表现为大鼠Ⅰ型糖尿病模型制备成功。sham组和I/R组腹腔注射等容量枸橼酸钠/枸橼酸缓冲液(0.1 mmol/L,pH值4.2),并同步适应性喂养。淘汰死亡及模型建立失败的大鼠并补充样本量,维持样本量为每组10只。
1.3 心肌缺血再灌注模型建立
参考文献[5]制备大鼠心肌缺血再灌注模型。大鼠术前禁食12 h,腹腔注射1%戊巴比妥75 mg/kg实施麻醉后,仰卧位固定于实验台上,针状电极连续监测标准肢体导联心电图。取颈部正中切口行气管切开气管插管术,连接ALC-V8型动物呼吸机(上海奥尔特生物科技有限公司)行机械通气,潮气量2.5 ml/100 g,通气频率60次/min,吸呼比1∶2。行右侧颈总动脉穿刺置管术,连接BL-410型生物机能实验系统(成都泰盟科技有限公司)监测心率和血压。于胸骨左缘3、4肋间开胸,打开心包暴露心脏,I/R组和DM+I/R组用6-0丝线于左心耳根部与肺动脉圆锥之间结扎左冠状动脉前降支(LAD),心电图示ST段抬高、T波高耸,表明心肌缺血成功。30 min后松开止血钳,复灌心肌,并持续120 min,心电图示ST段明显下降,表明心肌再灌注成功。sham组和DM+sham组仅穿线,不结扎LAD。
1.4 血清cTnI浓度检测
于再灌注120 min时,每组取5只大鼠,经颈动脉采血2 ml,静置2 min后以3 500 r/min离心5 min,离心半径10 cm,取上层血清,分装并存放于-80 ℃冰箱,后采用AU640全自动生化仪(美国MD公司)检测血清cTnI浓度。
1.5 TTC染色法测定心肌梗死范围
于再灌注120 min时,每组取5只大鼠,重新结扎LAD,经颈动脉逆行注射0.5%伊文氏蓝3 ml,立即处死大鼠剪下心脏,经生理盐水冲洗后,置于-20 ℃冰箱中20 min,垂直于心脏长轴连续切片,切片厚度2-3 mm,置入0.5%氯化三苯基四氮唑磷酸缓冲液中孵育。红色区域为缺血未梗死心肌,灰白色区域为缺血梗死心肌,蓝色区域为为缺血心肌。采用BI-2000医学图像分析系统(成都泰盟科技有限公司)分析梗死心肌占缺血心肌面积的百分比,即心肌梗死范围。
1.6 HE染色观察病理切片
于再灌注120 min时,取每组剩余5只大鼠,将结扎部位以下缺血区的心肌组织分成3份。取部分组织行HE染色,经甲醛固定、酒精脱水、石蜡包埋、切片、脱蜡后,于400倍光学显微镜下观察心肌组织病理学结果。
1.7 LonP1水平检测
取部分缺血区组织采用Western blot法测定心肌组织LonP1的表达水平。按照蛋白提取试剂盒(武汉博士德生物工程有限公司)说明,将大鼠心脏组织加入细胞裂解液中,匀浆后离心取上清液。BCA法测定蛋白浓度并进行蛋白定量,根据目的蛋白的分子量配制分离胶与浓缩胶,经过电泳、转膜、漂洗、封闭后,加入兔抗鼠单克隆LonP1抗体(1∶1 000,ABclonal公司),4 ℃孵育过夜。TBST漂洗5 min×3次后加入辣根过氧化物酶标记的山羊抗兔(1∶1 000,ABclonal公司)二抗,室温孵育2 h后TBST漂洗5 min×3次。在暗室中曝光,并用图像分析软件分析测定条带灰度值,以GAPDH为内参,以LonP1条带灰度值与GAPDH条带灰度值之比反映LonP1的表达水平。
1.8 线粒体顺乌头酸酶(mt-ACO2)活性检测
取部分缺血区组织采用分光光度法测定心肌组织mt-ACO2活性。按照顺乌头酸酶活性检测试剂盒(上海齐一生物科技有限公司)说明,将大鼠心肌组织加入细胞裂解液,匀浆后离心,取沉淀加入线粒体裂解液,超声波破碎后取样本液于石英比色皿中,加入测定液,使用分光光度计测定340 nm处20 s时的吸光值A1和200 s后的吸光值A2,按照说明书中的标准公式计算mt-ACO2活性,具体计算公式如下:
mt-ACO2[nmol/(min·g)]=[ΔA×V反总÷(ε×d)×109]÷(W×V样÷V样总)÷T=54×ΔA÷W
其中,V反总:反应体系总体积,2×10-4L;ε:NADH的摩尔消光系数,6.22×103L/(mol·cm);d:比色皿光径,1 cm;V样:加入样本体积,0.04 ml;V样总:加入提取液体积,0.202 ml;T:反应时间,3 min;W:样本质量。
1.9 统计学方法
2 结果
2.1 心肌梗死范围与血清cTnI含量
与sham组比较,DM+sham组心肌梗死范围和血清cTnI含量差异无统计学意义(P>0.05),而I/R组和DM+I/R组心肌梗死范围增大,血清cTnI含量升高(P<0.05);与I/R组比较,DM+I/R组心肌梗死范围增大,血清cTnI含量升高(P<0.05);与DM+sham组比较,DM+I/R组心肌梗死范围增大,血清cTnI含量升高(P<0.05,见表1)。
2.2 心肌LonP1水平
与sham组比较,I/R组、DM+sham组和DM+I/R组心肌LonP1水平升高(P<0.05);与I/R组比较,DM+I/R组心肌LonP1水平降低(P<0.05);与DM+sham组比较,DM+I/R组心肌LonP1水平差异无统计学意义(P>0.05,见表1,图1)。
2.3 心肌mt-ACO2活性
与sham组比较,DM+sham组心肌mt-ACO2活性差异无统计学意义(P>0.05),I/R组和DM+I/R组心肌mt-ACO2活性降低(P<0.05);与I/R组比较,DM+I/R组心肌mt-ACO2活性降低(P<0.05);与DM+sham组比较,DM+I/R组心肌mt-ACO2活性降低(P<0.05,见表1)。

表1 四组大鼠心肌梗死范围、cTnI含量、LonP1水平及顺乌头酸酶活性的比较 (n=5)Table 1 Comparison of myocardial infarction range, cTnI content, LonP1 level and ACO2 activity among four groups (n=5)
与sham组比较,*P<0.05;与I/R组比较,#P<0.05;与DM+sham组比较,&P<0.05

图1 四组大鼠心肌组织LonP1 Western blot检测条带Figure 1 LonP1 expression in cardiac tissues of rats in four groups by Western blot
2.4 心肌病理染色
光镜下可见,sham组心肌细胞形态正常,胞质染色均匀,纤维排列整齐,胞核居中,结构完整;DM+sham组细胞形态不规则,心肌纤维排列稍紊乱,胞浆有轻度的肿胀;I/R组心肌纤维排列紊乱,细胞形态不规则,胞浆有不同程度的肿胀甚至破裂,胞核排列不齐、碎裂;DM+I/R组损伤程度较I/R组增强,心肌纤维断裂,心肌细胞大量崩解,细胞核溶解,染色加深(见图2)。
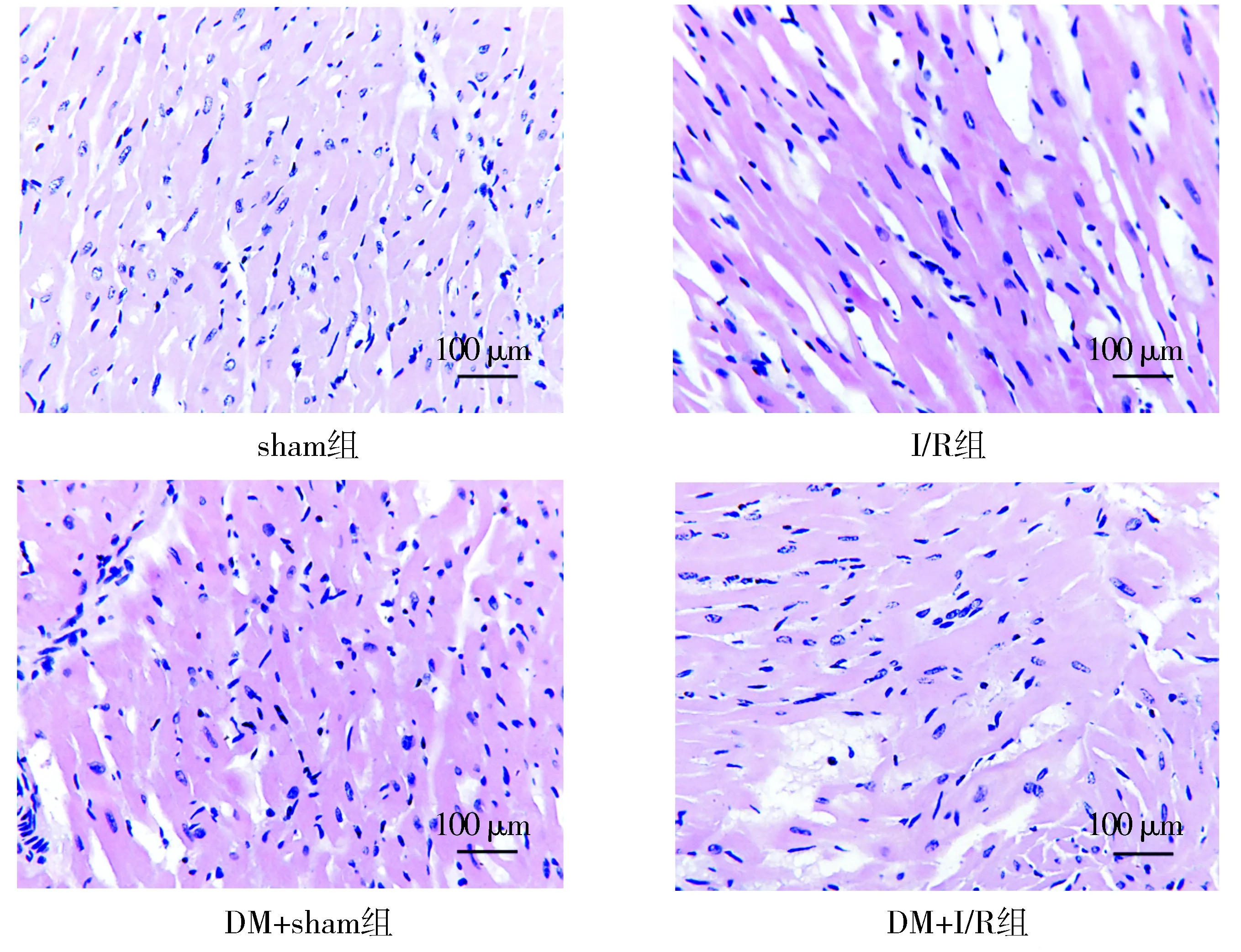
图2 四组大鼠心肌组织病理切片HE染色 (×400)Figure 2 HE staining of myocardial histopathological sections in four groups (×400)
3 讨论
本研究参考文献[4],采用禁食12 h后,腹腔注射1%链脲佐菌素60 mg/kg的方法制备大鼠糖尿病模型,给药24 h后尾静脉采血测定空腹血糖,并继续喂养4周,持续空腹血糖≥16.7 mmol/L,并出现明显多饮、多食、多尿以及体质量下降等表现,提示大鼠糖尿病模型制备成功。同时参考文献[5]制备大鼠心肌缺血再灌注模型。结扎左冠状动脉前降支(LAD),心电图示ST段抬高、T波高耸,结扎区域心肌颜色苍白,TTC染色提示心肌梗死面积增大,病理学显示损伤加重,提示心肌缺血模型制备成功。
线粒体是细胞代谢的重要组成部分,线粒体稳态对于细胞存活至关重要。在心肌缺血再灌注损伤过程中,由于线粒体电子传递链受损以及抗氧化能力下降,线粒体活性氧物质(mtROS)大量产生[6],导致蛋白质功能障碍、脂质过氧化以及DNA损伤,进而引起线粒体去极化、Ca2+超载、能量代谢障碍,甚至细胞死亡。mt-ACO2是一种铁硫蛋白酶,定位于线粒体的顺乌头酸酶参与三羧酸循环,催化细胞内柠檬酸经过中间产物顺乌头酸生成异柠檬酸。铁硫簇[4Fe-4S]2+是酶促反应的活性中心。铁硫簇中包含4个Fe2+,由于Fe2+较易氧化为Fe3+,当细胞中ROS产生增加时,会导致[4Fe-4S]2+氧化从而失去Fe2+变成[3Fe-4S]+,使mt-ACO2失去活性,所以mt-ACO2活性常被用于指示线粒体氧化应激水平[7]。本研究结果表明,与sham组相比,I/R组mt-ACO2活性降低,心肌梗死范围与cTnI含量上升,提示心肌缺血再灌注损伤与线粒体内氧化应激加重有关。与I/R组相比,DM+I/R组mt-ACO2活性降低,心肌梗死范围与cTnI含量上升,提示糖尿病加重大鼠缺血再灌注损伤,且与线粒体氧化应激相关。
LonP1是一种在进化过程中高度保守的ATP依赖性丝氨酸蛋白酶,定位于线粒体基质,它负责降解线粒体基质内被氧化修饰、功能失调或折叠错误的蛋白质,被氧化的mt-ACO2就是其主要底物之一。mt-ACO2的氧化过程不仅会使其活性下降,降低线粒体能量产出,同时还会释放游离铁[8],而细胞内游离铁含量的增加可通过铁死亡通路介导铁依赖性脂质过氧化,从而诱导细胞死亡[9]。除此之外,LonP1通过降解氧化呼吸链中复合体Ⅰ的ROS生成域,降低复合体Ⅰ的活性,减少去极化线粒体中ROS的生成,从而在一定程度上缓解线粒体所遭受的氧化应激[10]。已有研究证实,热休克[11]、血清饥饿和氧化应激[12,13]等均可以诱导细胞LonP1水平上调。本研究结果表明,与sham组相比,I/R组LonP1显著增多,提示缺血再灌注损伤可以诱导LonP1水平上调。DM+sham组LonP1水平高于sham组,但却低于I/R组,显示糖尿病也可以诱导LonP1水平上调,但其诱导能力明显低于缺血再灌注损伤。值得注意的是,与DM+sham组相比,DM+I/R组LonP1水平并未见明显升高,同时mt-ACO2活性降低,心肌损伤加重,显示在糖尿病背景下,虽然LonP1基础水平有所提高,但急性应激压力对LonP1的诱导能力却消失。由于LonP1在线粒体基质氧化蛋白质的降解途径中发挥重要作用,因此这种LonP1诱导能力的丧失可能使包括mt-ACO2在内的多种线粒体蛋白质在氧化修饰后降解受阻而大量积累,加重线粒体氧化应激压力,进而加重细胞损伤。
综上所述,糖尿病大鼠心肌缺血再灌注损伤加重可能与糖尿病背景下缺血再灌注损伤针对LonP1的急性诱导能力丧失有关。

