男科实验室计算机辅助精液分析系统的应用及质量控制
汪成 范舒舒 张思 黄文波 侯志伟

【摘要】 目的:探索一種可行的男科实验室计算机辅助精液分析系统(Computer-aided Semen Analysis System,CASA)的质控方法。方法:参考第5版《世界卫生组织人类精液分析实验室技术手册》推荐的分析方法和质控标准,分别使用高、低浓度的自制精液质控品和商品化质控珠对CASA的检测结果进行一致性分析。同时由两名实验员使用CASA对18份精液样本的浓度和活力进行双盲分析,并绘制Bland-Altman图对检测结果进行比较分析。结果:自制精液质控品高、低浓度批内变异系数分别为CV4.0%、CV5.8%,质控珠高、低浓度批内分变异系数分别为CV7.8%、CV7.6%,均符合Levey-Jennings质控规则。Youden分析显示两种质控品的检测结果均位于95%CI。Bland-Altman图分析显示,两名实验员对18份精液标本的浓度和活力检测结果差值的绝对值均位于95%CI内,检测结果一致性高。结论:CASA需要适当的质控方案保证其分析结果的准确性,本研究中无论是自制的精液质控品还是商品化质控珠,均能在CASA的精液浓度质控中起到良好的效果。在精子活力分析质控方面,CASA比传统的人工分析方法能够更加准确捕捉精子运动轨迹并提供更多精子运动信息。男科实验室的CASA质量控制不仅需要严格执行室内质控,还需要通过室间质评进一步保证仪器检测结果的准确性。
【关键词】 计算机辅助精液分析 质量保证 质量控制
Application and Quality Control of Computer-aided Semen Analysis System in the Andrology Laboratory/WANG Cheng, FAN Shushu, ZHANG Si, HUANG Wenbo, HOU Zhiwei. //Medical Innovation of China, 2020, 17(13): -148
[Abstract] Objective: To explore a feasible method for quality control of computer-aided semen analysis (CASA) in the andrology laboratory. Method: With reference to the analytical methods and standards recommended in the 5th edition of WHO Laboratory Manual for the Examination and Processing of Human Semen, the consistency analysis of CASA system was conducted by using high and low concentrations of self-made semen quality control samples and commercial quality control beads. At the same time, the concentration and motility of 18 different semen samples were double-blind analyzed by two experimenters using CASA system, then the bland-altman graphs was drawn to compare the test results. Result: The variation coefficients of high and low concentration self-made semen quality control samples were CV4.0% and CV5.8%, respectively. The intra-batch variation coefficients of high and low concentration control beads were CV7.8% and CV7.6%, respectively. All the statistical results were conformed with the quality control principle of Levey-Jennings. Youden analysis showed that the detection results of the two germplasm controls were at 95%CI. Bland-altman graphs showed that the absolute value of the difference between the concentration and activity of 18 semen samples tested by two experimenters was within the 95%CI, and the consistency was high. Conclusion: The CASA system needs an appropriate quality control method to ensure the accuracy of the analysis results. In this study, both self-made semen quality control samples and commercial quality control beads can take effect in the semen concentration quality control of CASA. In the quality control of sperm motility analysis, CASA is more accurate than the traditional manual analysis method in capturing sperm motility track and providing more sperm motility information. The quality control of CASA in andrology laboratory not only needs to strictly implement the indoor quality control, but also needs to further ensure the accuracy of the instrument test results through the indoor quality assessment.
[Key words] Computer-aided semen analysis Quality assurance Quality control
First-authors address: North Guangdong Peoples Hospital, Shaoguan 512025, China
doi:10.3969/j.issn.1674-4985.2020.13.036
在我国随着不孕不育症的发病率不断地增高,男科实验室已经作为生殖中心不可或缺的一部分,其担负的精液常规检验的结果不仅作为临床医生对男性生育力的判断依据,同时还被作为患者治疗效果检验和辅助生殖临床方案制定的主要依据[1]。因此,男科实验室检验结果的可重复性和稳定性直接关系到患者的治疗结局[2]。
现行我国男科实验室的精液分析和质量控制的标准主要是参照世界卫生组织编写的《世界卫生组织人类精液分析实验室技术手册》[3]。2010年最新出版的第5版WHO手册在前4版手册的基础上,第一次提出了精液分析的质量控制和质量保证的概念[3]。过去10年间,男科实验学高速发展,计算机辅助精液分析系统(CASA)作为WHO手册推荐精液常规分析手段已经被广泛应用于各个实验室。截至目前,我国男科实验室的精液分析仍然存在各种各样问题。尽管有WHO手册作为工作指南,但各个实验室从使用的CASA仪器品牌,配套的精子计数板型号等硬件层面到实验室精液分析方法和质量控制体系等软件层面均存在显著的差异[4]。这造成不同男科实验室的精液常规检测结果在广大生殖中心之间不被相互采纳的局面。这也导致患者到不同医院就诊时需要重复进行精液常规检验,无形中增加了患者的经济负担。因此,加强男科实验室精液常规分析的质量控制,摸索符合不同实验室自身实际情况的内部质量控制的方法成为男科实验室发展的关注热点[5]。本研究探讨自制精液质控品和商品化质控珠在计算机辅助精液分析系统室内质量控制中的应用,通过不同的统计学方法验证质控方案的可行性。同时,结合自身实验室对计算机辅助精液分析系统使用过程中的经验,探讨提高CASA室内质量控制水平的办法。男科实验室精液检测的质量保证与质量控制需要依靠实验室内部质量控制(IQC)结合由国家人类精子库技术培训基地组织的精液分析外部质量控制(EQC)并行方案来保障。现报道如下。
1 材料與方法
1.1 自制精液质控品 制备方法:收集2019年
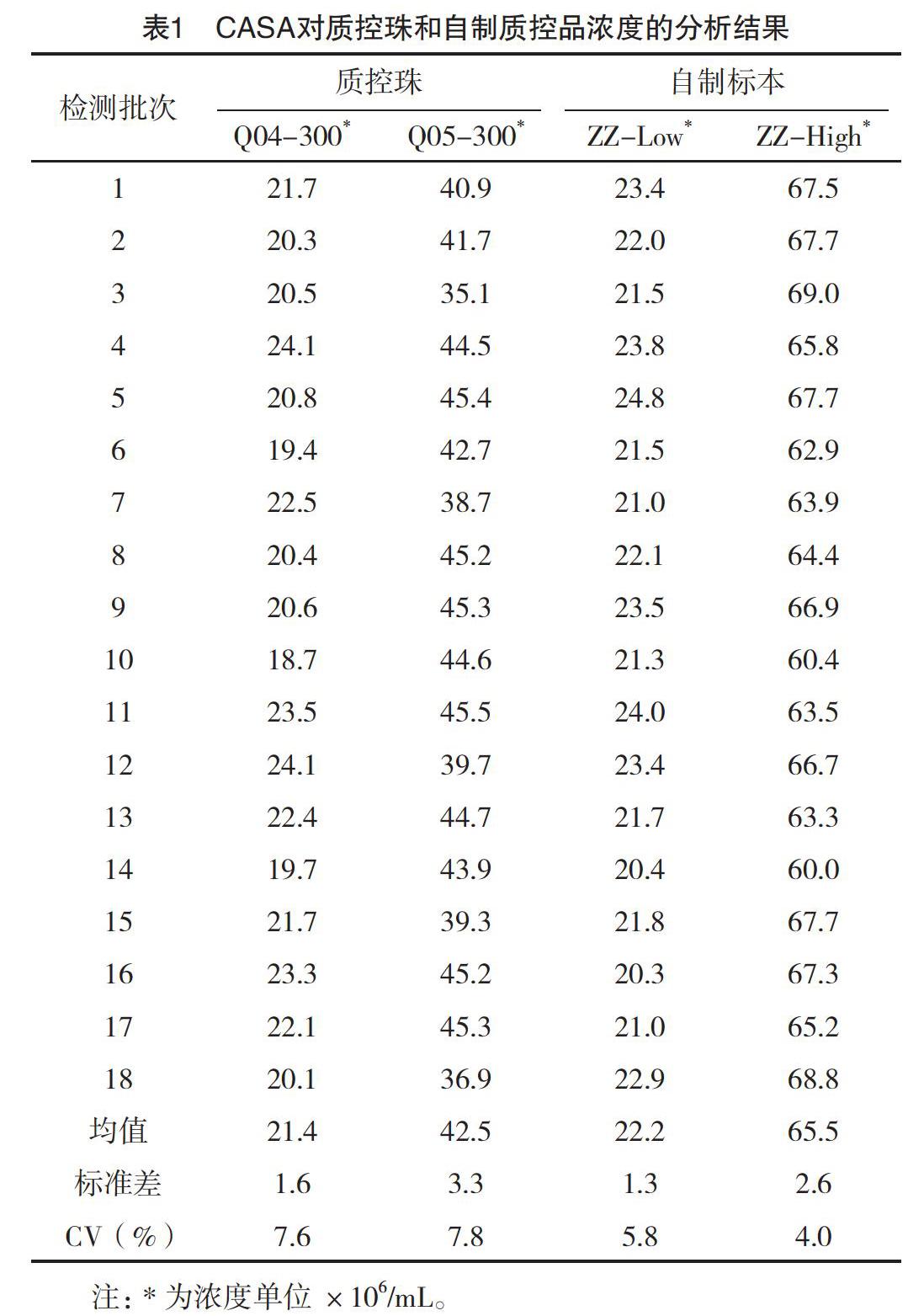
3月于本中心男科实验室进行精液常规检验,同时各项精液参数均正常的5~8份精液标本,充分混匀后制备成高、低浓度质控品[3]。ZZ-High靶值为65×106/mL,浓度范围(60~69)×106/mL。ZZ-Low靶值为22.0×106/mL,浓度范围(21.0~24.0)×106/mL。
1.2 精液浓度分析质控珠 使用Geoffrey微球悬浮液,高浓度Q05-300:浓度靶值40×106/mL,浓度范围(35~46)×106/mL。低浓度Q04-300:浓度靶值21×106/mL,浓度范围(18~24)×106/mL。
1.3 新鲜精液样本分析 为保证实验结果的稳定和准确,选择参与分析测试的人员为本中心男科实验室从事精液质量分析的专业技术人员,均具备临床检验技师资质,并在国家卫生部人类精子库技术培训基地接受男科实验室技术的岗位培训,参与男科室内质控(IQC)和室间质控(EQC)3次以上,质控的结果均合格。两名实验员使用双盲法同时对2019年3月在本中心男科实验进行精液常规检查的18份精液标本的精子浓度和活力进行评估。对每份精液样本均进行重复评估,按WHO第5版手册推荐的方法对两次结果的差异进行评估,如果差异可以接受,则将两次结果的平均值作为该份样本的结果,如果差异超过由随机误差造成差异的最大值,则放弃结果重新评估两份重复样本,直至两次结果的差异可以接受为止[3]。
1.4 精子评估方法 参照第五版《WHO人类精液检查与处理实验室手册》收集、处理和分析精液标本。精液常规检测采用江苏瑞祺CFT-9201型精子质量分析系统和其配套的Geoffrey改良精子计数板。精子活力划分如下,(1)前向运动精子(PR):精子运动活跃、线性运动或在较大范围内运动(不考虑运动速度);(2)非前向运动精子(NP):精子运动但不活跃,如精子在较小范围内运动,精子头部轻微移位或仅有尾部摆动;(3)完全不动精子(IM):精子完全不动。利用摄像系统捕获至少200条精子,精子浓度低的标本至少捕获6个视野。如果在高倍显微镜下观察到精液标本浓度过高(浓度>50×106/mL),则需对标本进行稀释,以确保检测的准确性[3]。
1.5 统计学处理 采用SPSS 19.0软件对各批次自制和商品化的质控品的CV值进行统计分析,计量资料用(x±s)表示,比较采用配对t检验及单因素方差分析;使用Medcalc软件对相关变量绘制Bland-Altman图和Youden图对检测结果进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 使用CASA对自制精液质控品和商品化质控珠的浓度分析 为保证分析结果的准确性,使用CASA对自制质控品和商品化质控品分别进行浓度连续18次检测(重复分析18次);对高、低浓度的自制质控品浓度分析结果的变异系数分别为4.0%和5.8%,对高、低浓度的商品化质控珠的浓度检测结果变异系数分别为7.8%和7.6%,所得的CV值均小于10%,均符合Levey-Jennings质控原则,见表1;其中商品化质控珠与自制的混合精液质控品相比较,在显微镜下观察分析时质控珠的背景更加干净,更容易区分,计数结果也更加准确,见图1。
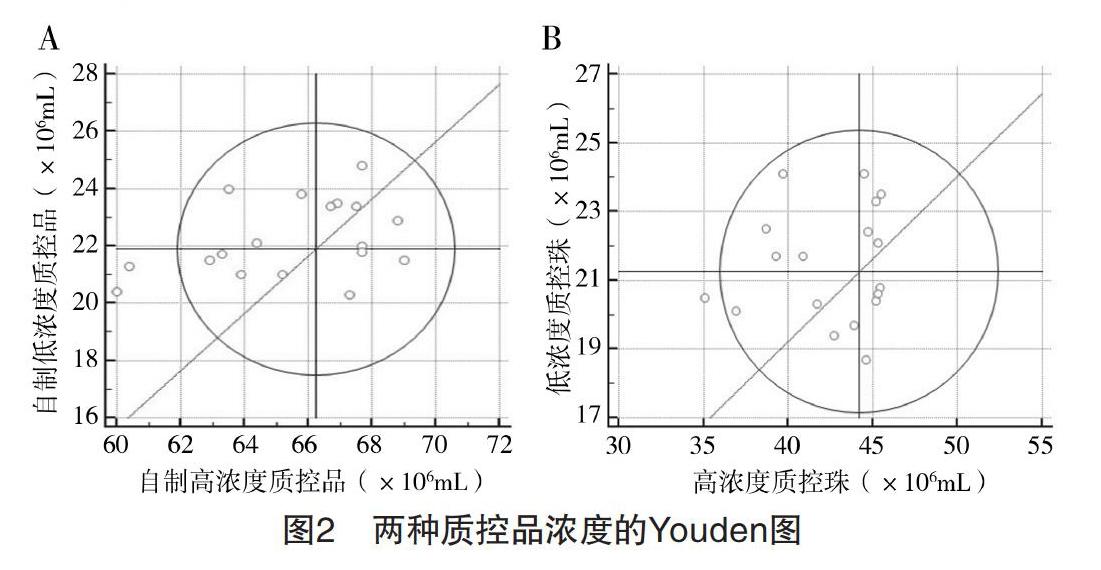
2.2 不同精液质控品浓度检测的Youden图分析结果 94.4%(17/18)的商品化质控珠的检测结果均位于95%CI内,88.9%(16/18)的自制质控品的检测均位于95%CI内,见图2。
2.3 Bland-Altman图分析两名实验员对18份精液标本的浓度和活力检测结果 精子浓度一致性界限为(7.7,-7.4),所有的数据点均处于95%CI内,在一致性界限范围内,两名实验员的检验结果差值的绝对值最大为7.5×106/mL,此种差异在精子浓度分析中是可以接受的,见图3。分析精子活动力时,由于百分率为非正太分布的特征,需先将其进行LN转换,并用此数据作图,得到一致性界限为(9.1,-8.3),同样观察到无数据点位于95%CI外,在一致性界限范围内,差值的绝对值最大为7.7,对应点的百分率差值为2.0%,这种差异在精子活动率分析中是可以接受的,见图4。对18份精液标本的分析结果进行配对t检验,实验员-1、实验员-2的精子浓度分别为(48.4±23.6)和(48.2±25.5)×106/mL,比较差异无统计学意义(t=0.02,P>0.05);实验员-1、实验员-2的精子活力分别为(62.6±10.2)%和(62.2±11.9)%,比较差异无统计学意义(t=0.11,P>0.05),验证了不同操作人员使用同一CASA得到检测结果的一致性良好,CASA分析18份精液样本浓度和活力的检测结果见表2。
3 讨论
男科实验室的精液分析结果是临床开展诊断和治疗的基础。目前,男科实验室已经成为生殖医学中心不可或缺的核心部门。20世纪80年代CASA问世之前,男科实验室一直采用人工分析进行精液常规分析[6]。作为男科实验室“红宝书”的WHO手册主要推荐使用血球计数池(牛鲍板计数板)作为精子的分析工具。由于人工精液分析过度依赖检验人员的经验和主观判断。同时,血球计数池因其开放式的结构容易引起精液分析过程容易受到外界环境的影响,最终导致血球计数池对精子浓度的分析结果不稳定,计数结果明显高于实际值[5]。2010年出版的第5版WHO手册推荐使用改良牛鲍板计数或是CASA完成精液常规分析[7-9]。CASA主要由电子计算机分析系统、相差显微镜、高分辨率摄像头、专用的精子计数板等组成,是将先进的计算机信息技术和现代化的图像识别技术相结合运用于男科实验室精液分析。通过对精液标本进行图像采集,信息化分析各项精子参数后得出检验报告。CASA的精液分析结果的客观性和可重复性均优于传统的人工精液分析方法。随着男科实验学的高速发展,CASA已经成为我国男科实验室精液分析的主要方法[10]。
尽管男科实验室的精液分析方法学逐步统一,但是不同实验室之间的精液分析结果仍然存在巨大的差异[11]。这导致各大生殖中心均不采纳第三方实验室的精液检测报告,患者往往需要重复多次的进行精液常规分析,无形中增加了患者的经济压力和过度检查的风险。究其原因,一方面是CASA分析系统的品牌和精子计数板的规格型号众多,并且各厂家的技术路线不一致。另一方面,不同男科实验室缺乏成熟可靠的精液分析质量控制的方案和完成相关质控所需的具有丰富统计学知识的实验人员。同时,精液分析质量控制过程中所需的商品化质控珠、精子活力分析视频和精子形态分析的预染片价格高昂且不易获得。男科实验室往往工作量巨大、难以再花费人力物力去完成复杂的精液质量控制流程。最后,缺乏权威机构提供标准化男科实验室管理和质量控制体系的指导方案,精液分析技能考核培训和继续教育[12]。第5版WHO手册第一次提出“质量控制”和“质量保证”的概念,并增加精液分析质量控制的相关章节,但是目前世界卫生组织及国家卫健委并未规定统一的质控标准品和质控结果的统计学分析方法[13]。因此,摸索符合自身实验室条件的内部质量控制方案是男科实验室持续改进的重要组成部分。
为了真实评估自制精液质控品和商品化质控珠在本中心男科实验室CASA质量控制中的使用效果。本研究中所有的实验步骤均遵照第5版手册的规范,为了减少人为误差对实验结果的影響,进行一致性分析时每个样本至少计数两次,每个浓度的质控品均进行了18次检测[3]。分析结果显示,CASA对不同浓度的自制精液质控品和商品化质控珠进行浓度分析结果的批内CV均小于10%。Youden图结果显示,94.4%(17/18)的商品化质控珠的检测结果均位于95%CI内,88.9%(16/18)的自制质控品的检测均位于95%CI内,说明无论是自制的精液质控品还是商品化质控珠均能在CASA的精液浓度质控中起到良好的效果,进一步验证了两种不同质控品在CASA精液浓度分析质控中的一致性。同时在商业化质控珠和自制质控品的低浓度检测中均出现1~2个结果位于95%CI外,属于系统误差,应从检测前样品是否充分混匀,检测时检测池的盖板是否放置平整等方面寻找影响检测结果准确性的原因。值得关注的是,商品化的质控珠虽然在精液分析时采集的图像背景更加清晰,能被CASA更精准的识别。但是质控珠缺乏真实精液中的非精子成分,质控珠的靶值范围较自制精液质控品的偏大。在精液分析过程中,质控珠主要是通过模拟精子头部的灰度从而被CASA识别,而自制精液质控品需要通过实验人员对图像进行修以正提高分析结果的准确性。考虑到目前商品化质控珠的价格,对于普通男科实验室依照WHO第5版手册制备精液质控品是更加经济和易于获得的选择。要注意的是,自制质控品需要添加防腐试剂以帮助精子抗凝集和长时间保存,在分装和使用时需要充分振荡混匀,避免反复冻融使用。
参与本实验的技术人员均在同一家国家卫生部人类精子库技术培训基地接受男科实验室技术的岗位培训,这有助减少因不同技术标准和规范带来的差异。本研究结果显示,两名实验员精子浓度、精子活力分析结果比较,差异均无统计学意义(P>0.05),验证了不同操作人员使用同一CASA得到检测结果的一致性良好。值得探讨的是,技术人员对CASA获得的初始结果进行人工校正后能够提高分析结果的准确性和一致性。在浓度分析方面主要是减少了非精子细胞对结果的干扰,让精子浓度结果更加接近实际值。在进行精子活力分析时,当精液标本的浓度超过50×106/mL,应对标本进行稀释。因为精子浓度过高通常会增加精子碰撞的频率,并可能由此产生错误的精子活力评估结果[14]。由于CASA配备了高分辨的摄像头和信息化图像处理系统,在精子活力分级和识别上具有明显的优势。同时,CASA增设了:VCL(曲线速度,单位:μm/s)、VSL(直线速度,单位:μm/s)、VAP(平均路径速度,单位:μm/s)、ALH(精子头侧摆幅度,单位:μm)、LIN(直线性,曲线轨迹的直线性,即VSL/VCL)、WOB(摆动性,精子头沿其实际轨迹的空间平均路径摆动的尺度,即VAP/VCL)、STR(前向性,空间平均路径的直线性,即VSL/VAP)、BCF(鞭打频率,单位:Hz)、MAD(平均移动角度,单位:度)等9项精子运动轨迹指标,能够提供更详细的精子运动的信息,为临床的不孕不育治疗提供依据[3]。
CASA系统是一个由多个部件组成的综合性分析平台,在日常男科精液分析中需要将质量保障应贯穿整个CASA使用过程中。分析前要调整好相差显微镜的光线强弱和载物台,确保精子呈现合适的对比度和优秀的图像质量,这有助于CASA对精子的准确识别。分析时确保待检的精液标本必须完全液化,按照精子计数板检测要求的样本体积使用微量移液器准确加住充分混匀的精液,避免产生气泡或吸入为液化的颗粒组织防止精子计数板因盖板不平造成的样本偏差[15]。CASA分析捕获至少200条精子,精子浓度低的标本至少捕获6个视野。精液标本分析过程中,显微镜应按“之”字形进行随机的图像采集,避免重叠和重复采集。有研究发现,精子计数板的计数池的深度直接影响CASA精液分析的结果准确性[15],男科实验室应请第三方检测机构对实验室中使用的分析天平、微量移液器、精子计数板和相差显微镜等设备进行年度校正。一旦仪器设备与相关配件耗材出现异常应及时进行维修与更换[3]。
精液常规检验是男科实验室的主要检查项目之一,其结果对患者治疗结果的重要性不言而喻。随着生殖医学的高速发展,日常男科工作中仅仅参照第5版WHO手册对各项精液参数进行常规的Xbar和S图的月均值分析,主要反映的是实验室技术人员自身和技术人员之间的差异[3,16]。仪器的损耗和异常、质控品的质量等问题并不能全面的体现,Bland-Altman法对男科实验室质量控制中使用的不同方法和测量结果的一致性有很好的应用价值。但不应忽视Bland-Altman法在实际应用中需要具备的条件:(1)数据点呈水平带状分布,即差值和均值之间不存在任何线性或非线性关系,使用前需要通过差值与均值的回归分析进行判定。(2)数据点分散在分布于等宽的水平区域内,即满足差值的方差齐同。(3)差值的分布呈正态分布,通过直方图和正态性检验判定[17]。合理选用适合的统计学方法才能对提高男科实验室的质量控制水平提供帮助。
标准化的男科实验室精液分析技术与稳定的质量控制体系是我国男科实验室持续改进的重点内容和方向。需要广大的男科实验室积极投入力量摸索适合自身实验室条件的合理方案。本中心男科实验室日常严格执行WHO第5版的质量控制指南,完成各项检验项目的仪器和人员质量控制[18-19]。同时,参加了由广东省人类精子库牵头举办的辅助生殖男科实验室外部质量控制项目[20]。通过内外结合的方法不断提高本中心男科实验室的技术能力和水平,为人民群众的生殖健康提供技术服务和保障。
综上所述,CASA需要适当的质控方案保证其分析结果的准确性,本研究中无论是自制的精液质控品还是商品化质控珠,均能在CASA的精液浓度质控中起到良好的效果。在精子活力分析质控方面,CASA比传统的人工分析方法能够更加准确捕捉精子运动轨迹并提供更多精子运动信息。最后,男科实验室的CASA质量控制不仅需要严格执行室内质控,还需要通过室间质评进一步保证仪器检测结果的准确性。
参考文献
[1] Joffe M,甄威,郑芹珠,等.精液质量分析与正常生育力的概念[J].国际生殖健康/计划生育杂志,2010,29(3):195-198.
[2] Jequier A M.Is quality assurance in semen analysis still really necessary? A clinicians viewpoint[J].Hum Reprod,2005,20(8):2039-2042.
[3]国家人口和计划生育委员会科学技术研究所译.世界卫生组织人类精液检查与处理实验室手册[M].5版.北京:人民卫生出版社,2011:2-192.
[4]陈振文,谷龙杰.精液分析标准化和精液质量评估-WHO《人类精液检查与处理实验室手册》(第5版)出版[J].中国计划生育学杂志,2012,20(1):58-62.
[5]陆金春,黄宇烽,吕年青.《世界卫生组织人类精液分析实验室技术手册》与我国男科实验室现状[J].中华男科学杂志,2010,16(10):867-871.
[6]蒋召志,郭路生.计算机辅助精子分析的质量控制措施[J].吉林醫药学院学报,2014,35(3):211-213.
[7]高选,刘晓丹,赵丽娟,等.精液分析中精子浓度室内质量控制方法的研究[J].中华男科学杂志,2012,18(3):235-238.
[8]陆金春.精液分析标准化与质量控制所面临的问题和解决措施[J].临床检验杂志,2016,34(9):641-645.
[9]黄宇烽,陆金春.精子质量参数分析的标准化与质量控制的研究进展[J].中华男科学杂志,2007,13(11):963-968.
[10]刘永杰,刘丽丽,金锐,等.计算机辅助精液分析的内部质量控制[J].宁夏医学杂志,2008,30(7):609-610.
[11]刘竟,刘睿智.男科实验室检查技术的质量控制[J].中国男科学杂志,2009,23(7):67-69,72.
[12] Lu J C,Zhang H Y,Hu Y A,et al.A survey on the status of semen analysis in 118 laboratories in China[J].Asian J Androl,2010,12(1):104-110.
[13] Pacey A A.Quality assurance and quality control in the laboratory andrology[J].Asian J Androl,2010,12(1):21-25.
[14] Keel B A.How reliable are results from the semen analysis?[J].Fertil Steril,2004,82(1):41-44.
[15]范久波,孙莉,刘海菊,等.不同计数板对计算机辅助精子分析系统检测影响探讨[J].现代检验医学杂志,2014,29(4):116-118.
[16]舒金辉,冯贵雪,甘贤优,等.Xbar质控规则在每月精液分析室内质量保证中的应用[J].中国男科学杂志,2014,28(8):35-38,42.
[17]萨建,刘桂芬.定量测量结果的一致性评价及Bland-Altman法的应用[J].中国卫生统计,2011,28(4):409-411,413.
[18] Mallidis C,Cooper T G,Hellenkemper B,et al.Ten years experience with an external quality control program for semen analysis[J].Fertil Steril,2012,98(3):611-616.e4.
[19]王奇玲,唐运革,邓顺美,等.精液分析区域性外部质量控制研究[J].生殖与避孕,2015,35(12):888-892.
[20]张欣宗,王奇玲,罗璐璐,等.广东地区男科实验室的现状分析[J].广东医学,2018,39(S2):213-216.
(收稿日期:2020-02-03) (本文编辑:董悦)

