芍药苷-6-O′-苯磺酸酯对Caco-2细胞中P-gp表达和功能的调控
王 斌,王 剑,汤 浩,孙 伟,王 勇,肖 峰,王 春,姜 玲,2,魏 伟
芍药苷-6-O′-苯磺酸酯(benzene sulfonyl paeoniflorin,CP-25)是芍药苷(paeoniflorin,Pae)的结构修饰产物,具有较强的抗炎免疫调节活性。研究[1]显示CP-25的生物利用度和吸收能力优于Pae。单次肠灌流大鼠模型的研究表明CP-25的肠吸收优于Pae。结果表明,Pae的吸收弱是由于渗透性差,P-糖蛋白(P-glycoprotein,P-gp)外流和肠道降解[2]引起的。P-gp是 ATP结合盒(ATP-binding cassette,ABC)转运体家族中重要的外排转运蛋白[3]。P-gp在人和其他哺乳动物的肠上皮细胞的基顶侧表面、胆小管和肾近端小管表达量很高,其生理功能是转运内源性代谢产物或外源性异物。很多临床上常用的免疫抑制药物都是P-gp的底物包括甲氨蝶呤、柳氮磺胺吡啶、糖皮质激素等,患者长期使用而引起P-gp的表达增加,因此降低药物疗效,产生耐药性。CP-25是抗炎免疫调节药物,能够降低关节炎大鼠滑膜组织中P-gp的表达,对Caco-2细胞是否具有调控作用尚不清楚。因此,该研究旨在探讨CP-25对Caco-2细胞中P-gp的调控作用。
1 材料与方法
1.1 材料
1.1.1药物与试剂 CP-25(白色粉末、纯度>98%)购自安徽医科大学临床药理研究所;胎牛血清(fetal bovine serum,FBS)和DMEM培养基购自美国Hyclone公司;青霉素和链霉素溶液以及Hank′s平衡盐溶液(HBSS)购自北京Solarbio公司;十二孔细胞培养板购自美国Costar公司;罗丹明123(RHO 123)购自美国Sigma公司;P-gp单克隆抗体(克隆UIC2)购自英国Abcam公司;流式细胞术试剂购自美国Becton Dickinson公司;P-gp抗体购自美国Santa公司;Phospho-NF-kB p65抗体购自美国CST公司。CoraLite594-缀合的山羊抗兔IgG(H+L)购自武汉ptgcn公司。牛血清白蛋白(BSA)和Triton X-100购自上海Beyotime公司。
1.1.2实验细胞株 Caco-2细胞购自American Type Cell Culture储存库(Manassas,VA)。
1.2 实验方法
1.2.1细胞极性研究 将细胞接种在75 cm2的培养瓶中并在DMEM培养基中培养。 15 d后,在光学显微镜下观察细胞并拍照。将Caco-2细胞在12孔Transwell室中培养9、15、21 d,并用平衡的盐溶性HBSS溶液(pH=7.4)在37 ℃条件下洗涤单层细胞2~3次。孵育20 min后,将孔中的溶液吸干,并根据试剂盒的方法测定单层细胞肠腔(AP)和基底侧(BL)的碱性层磷酸酶的活性。
1.2.2转运实验 为了检测pH对CP-25和Pae转运的影响,用HBSS培养基稀释CP-25和Pae并用HCl调节以得到一系列pH值(pH 5.0、pH 6.0和pH 7.4)。处理所有样品并计算CP-25和Pae的Papp。
1.2.3P-gp表达和活性分析 将细胞以6.0×104个细胞/cm2的密度接种到24孔板上。在实验当天,用PBS缓冲液(pH 7.4)洗涤细胞2次,并用不同浓度CP-25和Pae(0、5.0、10.0、20.0 μg/ml)及空白对照组、维拉帕米阴性对照组处理48 h后,用PBS洗涤细胞两次,用胰酶消化,得到细胞悬浮液。然后将细胞分成2个约2.5×105个细胞的等分试样,分别用于检测P-gp活性和表达。
研究CP-25对P-gp表达的影响:将细胞离心并悬浮在含有10% FBS与FITC缀合的P-gp抗体(UIC2)的PBS缓冲液(pH 7.4)中,通过与对照组比较,考察CP-25对Caco-2细胞中P-gp表达的影响。
研究CP-25对P-gp活性的影响:胰蛋白酶消化后,使用含有FBS的DMEM将处于对数生长期的Caco-2细胞分散为单细胞悬浮液,将细胞分别以1.0×106个细胞/cm2的密度接种到磷酸盐缓冲盐水(PBS)中的2.0 ml EP管(300 μl/管)中,后将细胞在37 ℃下与不含或含有各种浓度的药物(维拉帕米、CP-25和Pae)的1.0×10-3mol/L RHO 123一起孵育40 min。孵育后用PBS洗涤细胞3次,然后离心5 min。之后,将细胞用含有10% FBS的PBS洗涤2次,悬浮于冰冷的PBS中,立即检测P-gp的表达。通过(530±15)nm带通滤波器(FL1)检测RHO 123的绿色细胞内荧光。通过与空白对照比较,考察CP-25对Caco-2细胞中RHO 123积累的影响。
1.2.4Phospho-NF-кBp65和P-gp表达分析 将Caco-2细胞以6.0×104个细胞/cm2的密度接种到六孔板上。然后加入不同浓度的CP-25和Pae(0、5.0、10.0、20.0 μg/ ml)及空白对照组处理48 h后,用PBS洗涤细胞2次,加入含有磷酸酶抑制剂和PMSF的裂解缓冲液,冰上裂解30 min。将细胞刮下,12 000 r/min离心15 min,取上清液,采用BCA法对蛋白进行定量。SDS-聚丙烯酰胺凝胶电泳法将蛋白转移至PVDF上,用5%的脱脂牛奶封闭2 h,一抗孵育4 ℃过夜,与二抗结合2 h后,显影。
1.2.5Phospho-NF-кBp65的表达 将圆形盖玻片用75%乙醇浸泡过夜,夹入24孔板,加入无菌PBS冲洗2次。待细胞贴壁后,更换成不含血清的培养基,并用不同浓度CP-25(0、5.0、10.0、20.0 μg/ml)及空白对照组处理48 h后,吸弃培养基,加入4%固定液(用PBS制备4%多聚甲醛和4%蔗糖),室温固定15 min后,用PBS洗涤3次。加入0.2% Triton-X 100,室温放置10 min。再加入5%的BSA封闭30 min后加入PBS洗涤3次。孵一抗并4 ℃过夜后,加入PBS洗涤3次。然后加入荧光标记二抗避光孵育1.5 h,PBS洗涤玻片3次。最后加入DAPI工作液染色,避光孵育5 min,PBS洗涤玻片3次。滴上1小滴防淬灭封片剂于载玻片上,取出盖玻片,用吸水纸吸干盖玻片上残余的液体,细胞朝下,轻轻叩于封片剂上,4 ℃避光保存。
1.2.6数据分析 表观渗透系数Papp按以下方程进行计算:Papp=(ΔQ/Δt)*[1/(A*C0)][4],其中ΔQ/Δt是接收侧化合物的累积传输速率,A是细胞单层的表面积(cm2),C0是供体室中的初始浓度。
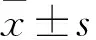
2 结果
2.1 细胞形态学检查和极性研究在光学倒置显微镜下,Caco-2细胞在第6 天和第7天缓慢融合生长,第15天逐渐变得均匀,致密和透明,如图1所示。

图1 Caco-2细胞显微镜照片(第15 天) ×200
不同生长阶段的细胞单层碱性磷酸酶活性的结果如图2所示。从图中可以看出,碱性磷酸酶活性比(AP / BL)随时间迅速增加(0.2±0.1、0.7±0.1、1.1±0.2)(F=6.283、14.93、38.77;P<0.05,P<0.01),第21天的活性比第9天高约5倍,表明碱性磷酸酶的分布非常不对称。其中大部分都局限于刷状缘一侧,细胞生长是具有极性的。

图2 Caco-2细胞的碱性磷酸酶活性
2.2 pH对CP-25和Pae转运的影响pH对CP-25和Pae转运的影响如图3A和图3B所示。与pH 7.4相比,CP-25和Pae的膜渗透在pH 4.0和pH 6.0下升高(FA=26.88、FB=33.43,P<0.01)。 这些数据表明CP-25和Pae在pH 4.0和pH 6.0环境中具有很强的渗透性。当 Papp<1×10-6cm/s时,药物的吸收率较低。因此CP-25吸收高于pH 7.4时的Pae。
2.3 CP-25对Caco-2细胞中P-gp表达的影响结果如图4所示,与空白对照组相比较,CP-25组和维拉帕米组的P-gp表达较低,差异具有统计学意义(F=47.54、15.14;P<0.05)。结果提示CP-25对P-gp表达有下调作用。
2.4 CP-25对Caco-2细胞中P-gp转运活性的影响如图5中所示,CP-25和维拉帕米在浓度为10.0 μg/ ml和20.0 μg/ ml时可以增加Caco-2细胞对RHO123的摄取,提高细胞内荧光强度,差异具有统计学意义(F=29.65、14.11P<0.05)。此外,Pae在浓度为10.0 μg/ ml和20.0 μg/ ml时也能够增加Caco-2细胞对RHO123的摄取。结果提示,Pae的RHO123的细胞内积累低于CP-25,说明CP-25对P-gp的抑制作用强于Pae。

图3 pH对Caco-2细胞单层CP-25和Pae转运的影响

图4 Caco-2细胞中P-gp表达水平的流式细胞术分析

图5 CP-25对Caco-2细胞中P-gp转运活性的影响

图6 CP-25对Caco-2细胞中Phospho-NF-κBp65和P-gp表达的影响
2.5 CP-25对Caco-2细胞中Phospho-NF-κBp65和P-gp表达的影响如图6所示,不同浓度的CP-25(5、10、20 μg/ ml)处理48 h后,Caco-2细胞中Phospho-NF-κBp65和P-gp表达水平随着药物浓度的增加而减少(FA=5.041、FB=152.6;P<0.05、P<0.01、P<0.001)。提示CP-25可以降低Phospho-NF-κBp65和P-gp的表达。
2.6 CP-25对Caco-2细胞中Phospho-NF-кBp65表达的影响如图7所示,不同浓度的CP-25(5、10、20 μg/ml)处理Caco-2细胞48 h后,通过共聚焦显微镜观察CP-25对Caco-2细胞中Phospho-NF-кBp65表达的影响。与Control组比较,5、10、20 μg/ml组荧光表达降低(0.6±0.1,0.6±0.1,0.5±0.1)(F=9.573,P<0.01),提示CP-25可降低Caco-2细胞中Phospho-NF-κBp65表达。
3 讨论
Caco-2细胞来源于人类结肠直肠癌并且与小肠的肠细胞非常相似[5],在培养的过程中融合,之后表现出自发的形态和生化的肠细胞分化[6]。在Caco-2细胞中所表达的P-gp[7-9]水平与正常人空肠[10]相同。此外,P-gp存在于Caco-2细胞的顶膜中也证实了其在该肠细胞系中的极化表达[11]。在实验性Caco-2细胞模型中,随着时间的延长,碱性磷酸酶活性比(AP / BL)迅速增加。碱性磷酸酶活性高于培养后第9~21天,增加约5倍,表明此时碱性磷酸酶的分布非常不对称,其中大部分集中在刷状缘一侧,细胞生长极性且完全分化,符合转运实验要求。

图7 CP-25对Caco-2细胞中Phospho-NF-кBp65表达的影响
在Caco-2细胞模型中,通常表观渗透系数Papp被用来评估药物摄取的生物利用度。通过研究各种化合物的转运机制,Artursson et al[12]发现Papp大于1.0×10-6cm/s时,认为该化合物能够被很好地吸收,而Papp小于1.0×10-6cm/s时,该化合物被认为吸收一般。据报道,在pH为7.4[13]的环境中,Pae在结肠中被吸收较低。实际上,本研究证实在pH为7.4的环境中,Pae转运渗透率最低,原因可能是Pae中的单酯基团会水解,从而降低其吸收率。另外,在pH值为7.4时,CP-25的转运渗透率低于4.0的pH值和6.0的pH值。但根据Papp值,当Papp小于1×10-6cm/s时,药物吸收性差。因此CP-25吸收大于pH为7.4时的Pae。
在该实验中,选择RHO123作为P-gp底物。RHO123是P-gp的经典底物,其经常作为工具药物用于研究P-gp在肠细胞膜中的功能。细胞中RHO123累积量的变化可以准确地代表P-gp[14]的功能。维拉帕米是P-gp的抑制剂,可以增加Caco-2细胞中RHO123的积累[15],用作阳性对照药。与对照组相比,维拉帕米可显着增加RHO123细胞内积累量。这一结果证明,通过测定RHO123积累量的变化来研究被测药物对P-gp活性的影响,实验方法是可行的,其结果表明CP-25可显著增加RHO123的细胞积累。Western blot和共聚焦显微镜观察结果显示,CP-25可显著下调P-gp和Phospho-NF-кBp65的表达。核转录因子-кB( nuclear factor κB,NF-кB)是由p65和p50组成的二聚体转录因子。当受到外界刺激时,IkB蛋白被磷酸化,释放出的NF-кB转移至细胞核并激活下游目的基因。以上说明CP-25是影响P-gp活性和表达的有效成分,可能是P-gp的抑制剂。
综上所述,CP-25能够下调Caco-2细胞中P-gp的表达,其分子机制可能与阻断NF-кB 信号通路激活有关。

