过表达NDRG1通过调控VEGF/sFlt-1轴增强缺氧条件下滋养细胞的促血管形成能力
何宜静,欧 琼,李 婷,刘 珏
子痫前期(preeclampsia,PE)是一种妊娠期特发性疾病,也是导致孕产妇及围产儿病死率攀升的主要原因之一[1]。研究[2]证实,妊娠中晚期胎盘组织缺氧是PE的重要病理特征。N-myc下游调节基因1(N-myc downstream-regulated gene 1,NDRG1)是一种进化上相对保守的应激反应蛋白,可参与细胞增殖、分化、肿瘤侵袭转移、新血管形成以及各种应激反应[3]。有研究[4]显示,缺氧可诱导滋养细胞中NDRG1高表达,同时PE患者胎盘组织中NDRG1也呈现高表达[5],但具体功能和作用机制不详。但有报道称[6],PE患者血清和胎盘组织中可溶性血管内皮生长因子受体1(soluble fms-like tyrosine kinase-1,sFlt-1)含量升高,而血管内皮细胞生长因子(vascular epithelial growth factor,VEGF)含量降低,表明PE患者胎盘血管发育异常,推测NDRG1可能通过调节滋养细胞促血管形成能力参与PE病理缺氧损伤的应答调控。因此,现拟探讨NDRG1过表达对缺氧条件下滋养细胞的促血管形成能力的影响,以明确NDRG1在PE发病的作用,为PE的治疗提供理论依据。
1 材料与方法
1.1 材料人脐静脉血管内皮细胞(human umbilical vein endothelial cell,HUVEC)、人胎盘滋养层细胞系HTR-8/SVneo(美国ATCC公司);RPMI-1640培养基(美国Thermo Fisher Scientific公司);胎牛血清(fetal bovine serum,FBS)(美国HyClone公司);NDRG1过表达(pCMV6-AC-NDRG1-GFP)及空载(pCMV6-AC-vector-GFP)慢病毒(2.0×108TU/ml)(上海HANBIO公司);人源VEGF ELISA检测试剂盒、人源sFlt-1 ELISA 检测试剂盒均购自上海卡努生物科技有限公司;Transwell chamber(美国Corning公司);Matrigel基质胶(美国BD公司);一步法qRT-PCR试剂盒(北京全式金);兔抗人NDRG1多克隆抗体购自美国Abcam公司;兔抗人基质金属蛋白酶-2(matrix metalloproteinase 2,MMP-2)单克隆抗体、兔抗人基质金属蛋白酶-9(matrix metalloproteinase 9,MMP-9)单克隆抗体、兔抗人GAPDH单克隆抗体(美国CST公司);辣根过氧化物标记的山羊抗小鼠或兔IgG二抗(武汉博士德生物工程有限公司)。
1.2 方法
1.2.1细胞培养及感染 采用含5% FBS的RPMI-1640培养基培养HTR-8/SVneo细胞,置于37 ℃、5% CO2的培养箱中培养、传代。取对数期HTR-8/SVneo细胞,调整细胞密度并接种于6孔板(1×105个/孔),培养至60%融合度时,分别取NDRG1过表达病毒(pCMV6-NDRG1)和阴性对照病毒(Vector)按照病毒感染比率值50 ∶1感染HTR-8/SVneo细胞,另选不做任何处理的HTR-8/SVneo细胞作为空白对照组,分别记为pCMV6-NDRG1组、Vector组和blank组。感染6~8 h后更换新鲜培养液继续培养,72 h后用嘌呤霉素筛选稳定表达株。
1.2.2缺氧处理及分组 缺氧处理条件参考杨晓涛 等[7]等探索的最佳模拟PE体外细胞模型条件即1% O2培养24 h。根据实验需要分为4组:① 空白对照组(blank):采用常氧条件(21% O2+5% CO2+74% N2)培养HTR-8/SVneo细胞24 h;② 缺氧组(Hpx):采用缺氧条件(1% O2+5% CO2+94% N2)培养HTR-8/SVneo细胞24 h;③Hpx+Vector组:采用缺氧条件培养感染阴性对照病毒的HTR-8/SVneo细胞24 h;④Hpx+pCMV6-NDRG1组:采用缺氧条件培养感染NDRG1过表达病毒的HTR-8/ SVneo细胞24 h。
1.2.3qRT-PCR检测细胞中各基因mRNA表达水平 分组处理后收集各组细胞,采用TRIzol法提取总RNA并测定浓度。取2 μg总RNA采用逆转录试剂盒合成cDNA,以cDNA为模板、GAPDH为内参进行qRT-PCR扩增。引物序列:NDRG1 Forward:5′-CCAACCTCCCACCCCTGATACA-3′,Reverse:5′-CCACCCCGACAAGAGCAAAGAG-3′;sFlt-1 Forward:5′-ACAATCAGAGGTGAGCACTGCAA-3′,Reverse:5′-TCCGAGCCTGAAAGTTAGCAA-3′;VEGF Forward:5′-TGCAGATTATGCGGATCAAACC-3′,Reverse:5′-TGCATTCACATTTGTTGTGCTGTAG-3′;GAPDH Forward:5′-AGCCACATCGCTCAGACAC-3′,Reverse:5′-GCCCAATACGACCAAATCC-3′。qRT-PCR反应程序为95 ℃预变性60 s、95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸45 s,共40个循环。采用2-△△Ct法计算NDRG1、sFlt-1和VEGF等mRNA相对表达量。
1.2.4ELISA法检测细胞培养上清中VEGF及sFlt-1蛋白表达 收集各组细胞培养上清液,5 000 r/min离心10 min,收集上清液,按照试剂盒说明书进行操作,采用酶标仪在450 nm波长处测定各孔的吸光度(optical density,OD)值,根据标准曲线计算细胞培养上清液中VEGF和sFlt-1蛋白分泌量。
1.2.5Western blot检测细胞中相关蛋白表达 收集各组细胞沉淀,加入适量RIPA裂解液,冰上充分裂解30 min,4 ℃条件下12 000 r/min 离心20 min,收集上清液,采用考马斯亮蓝法测定蛋白浓度。取25 μg蛋白采用沸水浴变性后上样,通过SDS-PAGE电泳分离蛋白,电泳后将蛋白转移至PVDF膜上,5%脱脂牛奶室温封闭30 min,分别加入NDRG1抗体(1 ∶1 000)、MMP-2抗体(1 ∶1 000)、MMP-9抗体(1 ∶1 000)和GAPDH抗体(1 ∶1 000),4 ℃孵育过夜。次日,加入二抗(1 ∶10 000)室温孵育30 min,加入超敏ECL化学发光底物,在全自动凝胶成像系统中曝光显影。采用Image-Pro Plus 6.0软件计算各孔条带灰度值,以目的蛋白与GAPDH蛋白灰度值比值表示相对蛋白表达量。
1.2.6小管形成实验检测细胞体外促血管形成能力 取各组细胞,缺氧处理24 h后分别收集各组细胞上清液,1 500 r/min离心5 min,除去杂质及死细胞,收集上清液备用。冰上溶解Matrigel基质胶,铺于96孔板中并置于培养箱中凝胶30 min。用上述各组上清液分别重悬HUVEC细胞,调整细胞浓度为2×105个/ml,向铺好基质胶的96孔板中每孔加入150 μl细胞悬液,置于37 ℃、5% CO2的培养箱中培养18 h,显微镜下观察细胞成管情况并拍照,并随机取5个视野统计小管形成数量取均值。
1.2.7Transwell实验检测细胞侵袭能力 平铺Matrigel基质胶于Transwell上室制成凝胶。取对数生长期的各组细胞,使用无血清培养基重悬细胞并调整细胞浓度至1×105个/ml,上室接种200 μl细胞悬液,下室加入500 μl含有20% FBS的RPMI-1640培养液,缺氧处理24 h后经4%多聚甲醛固定、0.1%结晶紫室温染色,倒置显微镜下观察并拍照,选取5个随机视野,统计视野中细胞数目,取平均值为侵袭的细胞数量。

2 结果
2.1 缺氧诱导HTR-8/SVneo细胞中NDRG1表达qRT-PCR实验结果显示,与blank组比较,Hpx组细胞中NDRG1 mRNA表达水平升高(t=9.736,P<0.05);与Hpx组与Hpx+Vector组比较,Hpx+pCMV6-NDRG1组细胞中NDRG1 mRNA表达水平也升高(F=391.323,P<0.001)。见图1A。Western blot结果显示,与blank组比较,Hpx组细胞中NDRG1 蛋白表达水平升高(t=10.183,P<0.05);与Hpx组与Hpx+Vector组比较,Hpx+pCMV6-NDRG1组细胞中NDRG1 蛋白表达水平也升高(F=76.333,P<0.05)。见图1B。
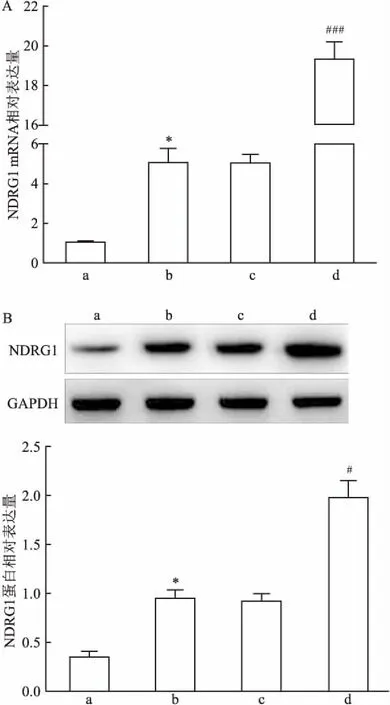
图1 各组细胞中NDRG1 mRNA和蛋白表达水平
A: qRT-PCR检测各组细胞中NDRG1 mRNA表达水平;B:Western blot检测各组细胞中NDRG1蛋白表达水平;a:blank组;b:Hpx组;c:Hpx+Vector组;d:Hpx+pCMV6-NDRG1组;与blank组比较:*P<0.05;与Hpx组或Hpx+Vector组比较:#P<0.05,###P<0.001
2.2 过表达NDRG1对缺氧条件下HTR-8/SVneo细胞中VEGF和sFlt-1表达的影响qRT-PCR实验结果显示,与blank组比较,缺氧处理后Hpx组细胞中VEGF和sFlt-1 mRNA水平均增加(t=39.792、33.130,P<0.05);与Hpx组与Hpx+Vector组比较,Hpx+pCMV6-NDRG1组细胞中VEGF mRNA水平再次增加(F=967.729,P<0.001),而sFlt-1 mRNA水平则降低(F=143.156,P<0.001)。见图2A。ELISA检测结果显示,与blank组比较,缺氧处理后Hpx组细胞分泌的VEGF和sFlt-1蛋白水平升高(t=16.572、33.322,P<0.05);与Hpx组与Hpx+Vector组比较,Hpx+pCMV6-NDRG1组细胞分泌的VEGF蛋白水平再次升高(F=290.098,P<0.001),而分泌的sFlt-1 蛋白水平则降低(F=270.398,P<0.001)。见图2B。

图2 NDRG1过表达对缺氧后各组细胞VEGF和sFlt-1表达的影响
A: qRT-PCR检测各组细胞中VEGF和sFlt-1 mRNA表达水平;B:ELISA检测各组细胞培养上清中VEGF和sFlt-1蛋白的表达水平;a:blank组;b:Hpx组;c:Hpx+Vector组;d:Hpx+ pCMV6-NDRG1组;与blank组比较:*P<0.05,**P<0.01,***P<0.001;与Hpx组或Hpx+Vector组比较:###P<0.001
2.3 过表达NDRG1增强缺氧条件下HTR-8/SVneo细胞的促血管形成能力小管形成实验结果显示,blank组、Hpx组、Hpx+Vector组和Hpx+pCMV6-NDRG1组HUVEC细胞血管成管数量依次为(21.67±3.24)、(6.67±2.08)、(6.33±2.08)和(69.67±6.02)个,与blank组比较,缺氧处理后Hpx组细胞培养上清液诱导的HUVEC细胞血管成管数量降低(t=6.784,P<0.05);与Hpx组和Hpx+Vector组比较,Hpx+pCMV6-NDRG1组细胞培养上清诱导HUVEC细胞血管成管数量增加(F=266.007,P<0.001)。见图3。

图3 NDRG1过表达对缺氧条件下HTR-8/SVneo细胞促血管形成能力的影响 ×100
A:blank组;b:Hpx组;c:Hpx+Vector组;d:Hpx+pCMV6-NDRG1组;与blank组比较:*P<0.05;与Hpx组或Hpx+Vector组比较:###P<0.001
2.4 过表达NDRG1促进缺氧条件下HTR-8/SVneo细胞的侵袭Transwell实验结果显示,blank组、Hpx组、Hpx+Vector组和Hpx+pCMV6-NDRG1组侵袭细胞数量依次为(154.34±8.50)、(55.69±9.61)、(57.67±6.11)和(447.33±22.01)个,与blank组比较,Hpx组侵袭细胞数目减少(t=13.183,P<0.05);与Hpx组和Hpx+Vector组比较,Hpx+pCMV6-NDRG1组侵袭细胞数目增加(F=743.799,P<0.001)。见图4。Western blot实验显示,与blank组比较,Hpx组细胞中MMP-2和MMP-9蛋白均显著下调(t=23.799、21.257,P<0.01);与Hpx组和Hpx+Vector组比较,Hpx+pCMV6-NDRG1组细胞中MMP-2和MMP-9蛋白均显著上调(F=314.440、197.271,P<0.001)。见图5。

图4 过表达NDRG1对缺氧条件下HTR-8/SVneo细胞侵袭的影响 ×200
A:blank组;b:Hpx组;c:Hpx+Vector组;d:Hpx+pCMV6-NDRG1组;与blank组比较:*P<0.05;与Hpx组或Hpx+Vector组比较:###P<0.001
3 讨论
妊娠早期,滋养层细胞还没完成对母体血管的侵入,胎盘的发育处于一个生理缺氧状态,而这种局部缺氧可促进滋养层细胞生长、分化、浸润及血管形成[8]。然而,待胎盘供血系统完全形成后滋养细胞持续缺氧将会导致多种妊娠并发症,例如妊娠期高血压疾病。长期以来胎盘缺氧被认为是导致PE的关键因素,持续长时间缺氧可导致滋养层细胞浸润能力下降[9],而滋养层细胞浸润能力下降导致子宫螺旋动脉重塑障碍可诱发胎盘组织缺血缺氧,形成恶性循坏。此外,胎盘血管生成异常也是PE的重要病理特征,有研究[10]显示,PE孕妇子宫螺旋动脉血管阻力大小与胎盘血管新生呈正相关性。因此,通过增强胎盘血管形成能力或许能够改善PE。本研究结果显示,NDRG1过表达可以增强缺氧条件下HTR-8/ SVneo促血管形成能力,提示NDRG1可能作为预防和治疗PE的关键靶点。
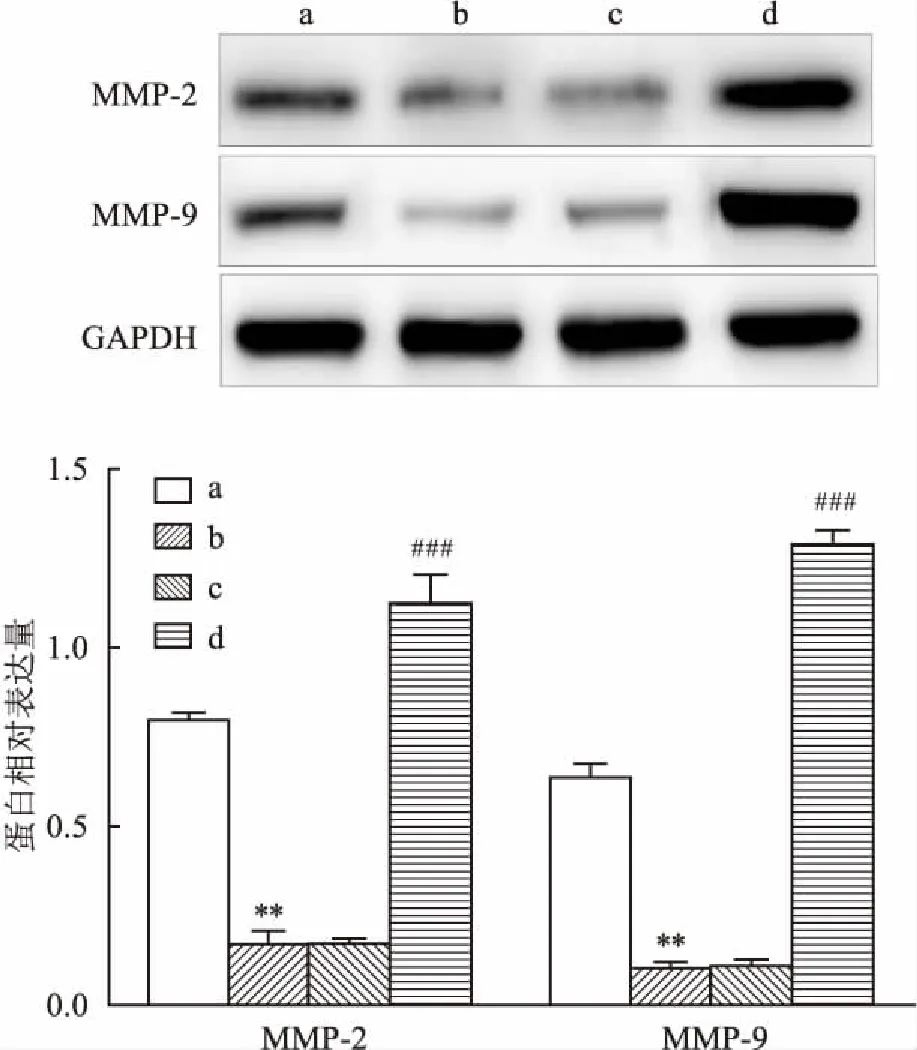
图5 过表达NDRG1对缺氧条件下HTR-8/SVneo细胞MMP-2和MMP-9蛋白的影响
A:blank组;b:Hpx组;c:Hpx+Vector组;d:Hpx+pCMV6-NDRG1组;与blank组比较:**P<0.01;与Hpx组或Hpx+Vector组比较:###P<0.001
NDRG1可表达于多种细胞,包括滋养层细胞,其功能复杂,且具有组织特异性。多项研究表明,NDRG1是一种应激反应蛋白,起到应激损伤修复的作用,在胎盘发育及胎盘滋养细胞应答应激反应中起重要调节作用。例如,Larkin et al[11]研究显示,NDRG1缺失不利于胎儿生长,并且会降低子宫对缺氧损伤的应答能力。Chen et al[12]报道称,缺氧能够诱导NDRG1表达,沉默NDRG1表达能促进缺氧应激诱导的滋养层细胞凋亡。本研究结果也证实,缺氧处理能够诱导HTR-8/SVneo细胞中NDRG1蛋白的表达。提示NDRG1在PE病理过程中可能扮演重要角色。
VEGF是重要的促血管生成因子,而其拮抗性受体sFlt-1则是主要的抗血管生成因子,二者的动态平衡共同维持正常的血管形成过程。有研究[13]显示,VEGF/ sFlt-1动态失衡引起的血管功能障碍是导致PE发生的病理基础。本研究结果显示,缺氧处理24 h后HTR-8/SVneo细胞中VEGF和sFlt-1表达量均显著升高,同时细胞的促血管形成能力和侵袭能力显著降低。周琼 等[14]研究也显示,CoCl2诱导的缺氧环境可以刺激滋养细胞TEV-1持续表达和分泌sFlt-1,而VEGF表达则随缺氧时间的延长呈现出先上升后下降的趋势,48 h达到峰值,与本研究结果相吻合。此外,缺氧处理后HTR-8/SVneo细胞中VEGF与sFlt-1表达量均显著增加,而细胞的促血管形成能力及侵袭能力则显著降低,可能是由于缺氧刺激条件下HTR-8/SVneo细胞中sFlt-1表达量急剧增加,导致sFlt-1瞬时表达量大于VEGF,打破了VEGF/ sFlt-1动态平衡,进而表现出抗血管形成的作用。
为了进一步探究NDRG1在滋养层细胞缺氧应激反应中发挥的作用,本研究通过感染NDRG1过表达慢病毒,建立NDRG1过表达的HTR-8/SVneo细胞系,再进行缺氧处理。结果显示,NDRG1过表达可显著降低缺氧条件下HTR-8/SVneo细胞中sFlt-1表达量,提高VEGF表达量,并提高HTR-8/SVneo细胞的促血管形成和侵袭能力。说明NDRG1过表达能够促进缺氧条件下HTR-8/SVneo细胞的促血管形成和侵袭能力。有研究[15]显示,缺氧诱导因子-1α(hypoxia-inducible transcription factor-1α,HIF-1α)能够靶向结合NDRG1启动子,调控NDRG1的转录,而HIF-1α是缺氧应激反应中的中枢调控因子,故缺氧可诱导NDRG1表达。此外,VEGF是HIF-1α下游的靶基因,因此NDRG1高表达可能通过介导VEGF表达,协调VEGF/ sFlt-1动态平衡,发挥促血管形成的作用。
综上所述,NDRG1过表达可以促进缺氧条件下人滋养层细胞HTR-8/SVneo的促血管形成能力,其机制可能与介导VEGF/ sFlt-1动态平衡有关,进而在胎盘血管生成中起重要调节作用。因此,NDRG1有可能成为预防和治疗PE的关键靶点。

