Mdivi-1对匹鲁卡品致痫大鼠海马神经元保护作用及其机制研究
甘 露,周弟弥,张 磊,陈 琳
癫痫是由多种原因引发的慢性脑部疾病,全球大约有5千万人患病,其中我国患病人数超过9百万,患病率约为5% ~ 7%[1]。长期、反复的癫痫发作会给患者与社会带来沉重的负担。近年来,尽管癫痫研究的许多方面已取得了很大进展,但发病机制并未得到彻底解决。故进一步研究癫痫的发病机制并寻找有效的防治措施是目前急需解决的问题。
线粒体分裂蛋白抑制剂(mitochondrial division inhibitor,Mdivi-1)是线粒体动力相关蛋白1(dynamin-related protein 1,DRP1)的选择性抑制剂,属于喹唑啉酮衍生物,可通过抑制GTP酶活性发挥作用[2]。文献[3-4]报道Mdivi-1可对脓毒症大鼠器官功能起保护作用,但在癫痫模型中Mdivi-1相关研究报道较少。现通过建立癫痫大鼠模型,观察各组大鼠行为学及Mdivi-1对海马神经元的保护作用,探讨其可能的作用机制。
1 材料与方法
1.1 实验动物20只雄性SD大鼠(清洁级,6~8周龄),体质量200~250 g,购于湖南斯莱克景达实验动物有限公司[许可证:SCXK(湘)2015-005],实验前适应性饲养1周,室温(22±2)℃,恒温、纯净饮水及标准饲料分笼饲养。所有的实验过程均经动物伦理委员会同意,实验过程符合3R原则。
1.2 试剂与仪器氯化锂、匹鲁卡品(美国sigma公司);Mdivi-1抑制剂(美国selleck公司);兔抗 DRP1、ENT1抗体(美国 Abcom 公司);BCA 蛋白试剂液(上海碧云天);透射电镜(日立 HITACHI 公司);激光共聚显微镜(德国 Leica 公司);全自动曝光仪(美国 BioRad 公司)。
1.3 实验方法
1.3.1分组与模型建立 将大鼠随机分为正常组、模型组、DMSO组、Mdivi-1组,保证造模成功后每组均有5只大鼠入组。癫痫造模参考文献[5]方法:氯化锂-匹鲁卡品模型。正常组:腹腔注射同等容量的生理盐水替代模型组中匹鲁卡品、氯化锂溶液;模型组:腹腔注射氯化锂(127 mg/kg,0.9% NaCl配制)用于增强匹鲁卡品敏感性,20 h后腹腔注射匹鲁卡品(30 mg/kg,0.9% NaCl配制),在注射匹鲁卡品前30 min注射1 mg/kg硫酸阿托品,拮抗外周胆碱能反应,直至出现 Racine分级标准[6]中的Ⅳ-V级癲痫持续状态(status epilepticus,SE);Mdivi-1组和DMSO组:在注射匹鲁卡品前30 min分别腹腔注射Mdivi-1抑制剂(1.2 mg/kg)或0.1%二甲基亚砜(DMSO)溶液,其余步骤同模型组。癫痫大鼠成功建模后,各组大鼠于24 h腹腔麻醉,取大脑海马组织,放入-80 ℃冰箱保存。
1.3.2大鼠行为学观察 达到Racine分级标准[6]中的Ⅳ-V级SE为癫痫模型制作成功。分别记录各组大鼠致痫成功率及潜伏期。
1.3.3透射电镜 取海马CA1组织,置于4% 戊二醛溶液中固定过夜,磷酸缓冲液冲洗后用1%锇酸固定1 h,按照脱水、浸透、包埋、切超薄、染色的顺序,每个电镜标本取10个视野观察,进行拍片后统计。
1.3.4免疫组化检测各组大鼠海马区DRP1表达 大鼠海马组织石蜡包埋后切成4 μm薄片,脱蜡、水化,PBS洗涤5 min×3次,3% H2O2孵育10 min,PBS洗涤5 min×3次。高压修复,山羊血清封闭,加入DRP1抗体(1 ∶500),4 ℃过夜,PBS 冲洗3次,辣根过氧化物酶标记的链霉卵白素(1 ∶300)孵育,漂洗,DAB显色,苏木精复染,分化、脱水、干燥、中性树脂封片。
1.3.5免疫荧光染色检测各组大鼠海马区DRP1表达 将海马组织冰冻切片,用4%多聚甲醛固定,用PBS(0.01 mol/L) 漂洗3次,每次10 min,微波修复,PBS清洗,加山羊血清封闭液1 h,弃去,滴加DRP1抗体(1 ∶50),4 ℃ 孵育过夜,37 ℃复温1 h,PBS溶液清洗,加Cy3标记山羊抗小鼠荧光二抗(1 ∶100)37 ℃避光孵育2 h,PBS清洗,滴加抗荧光淬灭封片,用激光共聚焦显微镜观察并拍照。
1.3.6Western blot检测各组大鼠海马区DRP1、平衡型核苷转运载体1(equilibrative nucleoside transporter -1,ENT1)变化 将冰冻的海马组织取出,加入RIPA裂解液,离心,取上清液采用 BCA 法测定蛋白浓度,于-80 ℃冰箱中保存备用。每孔加20 μl蛋白样本,进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)电泳,电泳结束后将蛋白条带转印至PVDF膜上,用5%脱脂奶粉封闭2 h后,分别加入一抗DRP1(1 ∶1 000)、ENT1(1 ∶500)4 ℃孵育过夜,TBST洗涤后,加二抗室温孵育1 h,ECL显影。用ImageJ 图像分析软件分析吸光度值(A),蛋白相对表达水平=A目的蛋白/Aβ-actin。
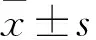
2 结果
2.1 Mdivi-1对大鼠行为活动的影响与模型组或DMSO组相比,Mdivi-1组大鼠癫痫发作潜伏期增加,差异有统计学意义(P<0.05);与模型组或DMSO组相比,大鼠癫痫发作频率下降,差异有统计学意义(P<0.05)。见图1。

图1 Mdivi-1对癫痫大鼠发作潜伏期及次数影响
A:癫痫发作潜伏期;B:癫痫发作次数;与模型组或DMSO组比较:*P<0.05
2.2 电镜观察癫痫大鼠海马区结构变化正常组大鼠海马CA1区结构完好,线粒体未发现损伤;癫痫组部分内外膜崩解,线粒体明显破坏、肿胀;Mdivi-1组线粒体基质密度下降、部分嵴分裂,肿胀程度下降。见图2。
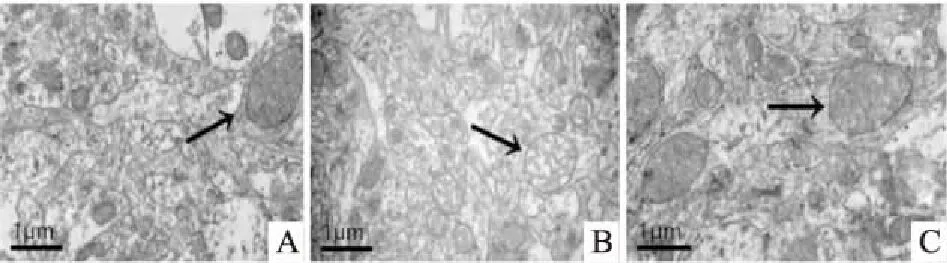
图2 电镜观察大鼠海马区超微结构变化 ×30 000
2.3 免疫组化检测癫痫大鼠海马区DRP1表达DRP1阳性细胞主要位于神经细胞膜上。与正常组相比,模型组大鼠脑组织海马CA1、CA3、DG区DRP1阳性细胞数增多,而Mdivi-1组阳性细胞数少于模型组(P<0.05)。见图3。
图3 免疫组化检测癫痫大鼠海马区DRP1表达 ×200与正常组比较:*P<0.05;与模型组比较:#P<0.05

图4 免疫荧光检测癫痫大鼠海马区DRP1表达 ×400
2.4 免疫荧光检测癫痫大鼠海马区DRP1表达DRP1与星形胶质细胞特异性标志物(glial fibrillary acidic protein,GFAP)不共表达,而与神经元树突特异性标志物(microtubule-associated protein 2,MAP2)共表达。见图4。
2.5 Western blot检测癫痫大鼠海马区DRP1及ENT1表达与正常组相比,DMSO和模型组中ENT1、DRP1蛋白表达升高,差异均有统计学意义(P<0.05)。而与模型组相比,Mdivi-1组中ENT1、DRP1蛋白表达下降,差异均有统计学意义(P<0.05)。见图5、6。

图5 ENT1蛋白相对表达
与正常组比较:*P<0.05;与模型组比较:#P<0.05

图6 DRP1蛋白相对表达
与正常组比较:*P<0.05;与模型组比较:#P<0.05
3 讨论
癫痫是由已知或未知原因引起的慢性脑部疾病,为神经内科最常见的疾病之一[6],其发作会引发海马区神经细胞凋亡或坏死,引起学习、记忆和认知损害。癫痫表型中线粒体功能障碍及染色体长序列基因突变可能是病因。线粒体是细胞内氧化磷酸化形成ATP的主要场所,对活性氧的产生与调节、神经元凋亡、钙稳态、神经递质的合成以及氧化还原反应起关键作用。
Mdivi-1是DRP1的选择性抑制剂,可以抑制酵母的Dnm1及GTP 酶活性,调节 DRP1功能,从而抑制线粒体的过度分裂[7]。本研究结果表明,与模型组或DMSO组相比,Mdivi-1组大鼠癫痫发作潜伏期延长,而癫痫发作频率下降(P<0.05)。说明 Mdivi-1可能下调 DRP1表达,减轻癫痫的发作。电镜观察结果显示,正常组大鼠海马CA1区结构完好,线粒体未发现损伤。癫痫大鼠海马区线粒体内外膜崩解,线粒体明显破坏、肿胀,而Mdivi-1组线粒体基质密度下降,肿胀程度下降,这与文献[8]报道基本相符,提示线粒体可能参与了癫痫的形成。
线粒体是一种高度动态变化的细胞器,频繁出现分裂和融合,其分裂融合的过程称线粒体动力学。正常状态下,线粒体的分裂融合处于动态平衡以维持线粒体的生物学功能,但在多种因素下,如氧化应激、缺血再灌注等,都会打破该平衡,使其分裂融合发生紊乱,这在许多神经系统变性疾病中已被证实[9]。线粒体的分裂、融合是在多种蛋白分子精细调控下发生的,其中线粒体分裂由动力蛋白家族成员DRP1和线粒体分裂蛋白1所介导。DRP1活性与翻译后修饰有关,它参与细胞许多生物反应过程,如细胞凋亡及能量代谢等[10]。本研究中Western blot检测结果显示,DMSO和模型组中DRP1蛋白表达高于正常组,而与模型组相比,Mdivi-1组DRP1蛋白表达下降(P<0.05);免疫组化检测结果表明,DRP1 主要在细胞膜上表达,模型组大鼠脑组织海马CA1、CA3、DG区DRP1阳性细胞数增多,而Mdivi-1组减少(P<0.05),同时免疫荧光检测结果也显示DRP1在海马神经元中有表达,这些均提示DRP1可能参与了癫痫的形成。文献[11]报道,癫痫大鼠被抑制后,海马区神经元损伤减轻,可能与 DRP1 介导的线粒体动力学有关,本研究结果与之基本一致。
腺苷(adenosine, AD)是大脑活动的重要平衡调节器,它是一种抑制性神经递质[12]。ENT1可以通过神经元和胶质细胞膜完成调节脑内细胞内外AD浓度的作用[13]。由于细胞内ATP浓度较高,当发生缺氧或代谢激活、受损等情况下,胞内ATP和AD能通过核苷转运释放至细胞外,造成局部水平升高,而AD还可以通过细胞分泌形式少量释放。朱会宇 等[14]报道,星形细胞将囊泡内ATP释放至胞外后,由核苷酸酶降解产生AD。吴艳芝 等[15]报道,癫痫发作后可引起大鼠脑组织中ATPase活性增强,AD及ATP含量增高。课题组通过免疫组化及Western blot检测显示,Mdivi-1组大鼠海马区ENT1 阳性细胞数及蛋白表达水平较模型组均下降,推测其可能机制为Mdivi-1阻断DRP1介导的线粒体动力学,从而使 ATP合成发生障碍,这导致细胞外AD水平下降,进而下调 ENT1 表达,但其具体机制还有待进一步研究。
综上所述,Mdivi-1能靶向阻断DRP1,调控线粒体动力学平衡,从而影响 ENT1表达。Mdivi-1有希望成为理想的神经保护剂,为抗癫痫治疗提供新的思路和方法。

