原发性干燥综合征合并肺动脉高压80例临床观察
谢茂盛,金颖昭,金 莉,马 艳,李向培,汪国生,赵 岩,厉小梅
原发性干燥综合征(primary Sjögren's syndrome,pSS)是一种慢性自身免疫性疾病,具有多种临床表现,特别是眼干、口干、疲劳和肌肉骨骼疼痛,肺动脉高压(pulmonary arterial hypertension,PAH)是pSS少见且严重的并发症之一[1]。PAH是肺血管床中肺动脉压的增加,最终可能导致右心负荷增加,甚至右心衰竭和死亡。既往关于pSS-PAH的研究较少、样本量不大,且无对初始症状研究的报道。现通过对80例pSS-PAH患者进行全面系统性回顾,探讨其发生率及相关危险因素。
1 材料与方法
1.1 病例资料收集2009年8月~2019年3月于安徽医科大学附属省立医院风湿免疫科住院,且完善心脏彩超检查的pSS患者共438例,所有患者均符合2002年pSS诊断标准[2]。排除其他结缔组织病、先天性心脏病、心肌梗死、慢性阻塞性肺疾病、肺栓塞、门静脉高压、肺静脉闭塞、风湿性心脏病等。
1.2 PAH的诊断标准在彩色多普勒引导下,通过简化伯努利方程估测肺动脉收缩压(pulmonary arterial systolic pressure,PASP)=4×V2+右心房压力,其中V代表三尖瓣反流峰速,PASP≥5.33 kPa为PAH[3]。
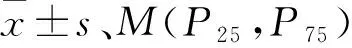
2 结果
2.1 病例资料438例pSS患者中80例有PAH,pSS-PAH发生率为18.3%,其中75例(93.8%)为女性,年龄22~77(59.9±13.8)岁。其中最常见的首发症状是干燥症状[口干和(或)眼干]37例(46.3%),其次是肺部症状[胸闷和(或)咳嗽]24例(30.0%),关节痛15例(18.8%),牙齿脱落5例(6.3%),皮疹4例(5.0%),雷诺现象4例(5.0%)。
2.2 两组首发症状与合并症pSS-PAH组与非PAH组首发症状与合并症的差异见图1。结果显示当患者以肺部症状(胸闷和/或咳嗽等)首发时,两组差异有统计学意义(P<0.001),余起始症状如干燥、关节痛、雷诺现象、皮疹、牙齿脱落等两组差异无统计学意义;对于临床合并症,研究结果显示PAH组更易合并有间质性肺炎、心包积液(P<0.001),对于原发性胆汁性肝硬化、甲状腺疾病,两组差异无统计学意义。
2.3 两组一般资料与实验室指标结果pSS-PAH组的年龄(59.9±13.8)岁高于非PAH组(52.5±13.9)岁,且血清白蛋白低、补体C3低,心脏左房内径大、左室收缩末内径大是发生PAH的危险因素(P<0.05)。见表1。

图1 pSS-PAH组与非PAH组首发症状及合并症的比较
A:首发症状;B:合并症;1:干燥;2:关节痛;3:肺部症状;4:雷诺现象;5:皮疹;6:牙齿脱落;a:间质性肺炎;b:心包积液;c:原发性胆汁性肝硬化;d:甲状腺疾病;与非PAH组比较:***P<0.001

表1 pSS-PAH组与非PAH组基本资料与实验室指标的比较[M(P25,P75)]
A:两独立样本t检验得出的t值;b:经χ2检验得出的卡方值;c:经秩和检验得出的Z值;ALT:丙氨酸氨基转移酶;AST:天冬氨酸氨基转移酶;CRP:C反应蛋白;ESR:红细胞沉降率;LVEF:左室射血分数
2.4 两组主要临床表现与免疫学指标结果pSS-PAH组Schirmer试验阳性率高于非PAH组(96.2%vs82.6%,P<0.05),口干和眼干症状、相关抗体指标差异无统计学意义。见表2。
2.5 多因素Logistic回归分析结果将所有可能导致pSS合并PAH的9个因素,包括以肺部表现为首发症状、间质性肺炎、心包积液、年龄、白蛋白、补体C3、左房内径、左室收缩末内径、Schirmer试验,纳入多因素Logistic回归分析,结果显示3个变量有统计学意义,间质性肺炎、年龄、以肺部表现为首发症状为pSS-PAH的独立危险因素。见表3。
3 讨论
自2009年8月~2019年3月共收治住院pSS患者1 068例,438例患者完善心脏彩超检查,其中80例合并有PAH,pSS患者并发PAH者约占18.3%,与Zhao et al[4]通过右心导管确诊报道的15.3%相近,较早些年国内发病率4.2%~5.2%已有明显上升。一方面可能是依据心脏彩超结果判断PAH标准宽松,以及收治的均是住院患者,病情偏重,导致发生率高于实际值,另一方面可能与临床医师对PAH认识的提高,以及心脏彩超在pSS中的广泛应用有关。Zhao et al[4]研究还显示pSS-PAH的1、3、5年生存率分别为78.5%、72.9%、64.8%,预后优于系统性硬化症合并肺动脉高压,而不如系统性红斑狼疮合并肺动脉高压,考虑与其症状不典型、诊断延迟有关。因此,早期诊断,积极调整治疗方案至关重要。

表2 两组pSS患者相关临床及免疫学指标比较[n(%)]
ANA:抗核抗体;RF为类风湿因子;a:PAH组RF样本总数为67例;b:非PAH组RF样本总数为285例;c: PAH组Schirmer试验样本总数为53例;d: 非PAH组Schirmer试验样本总数为224例

表3 pSS-PAH的独立危险因素
目前pSS合并PAH机制假设包括内皮损伤、免疫复合物积聚、坏死性血管炎、内皮血管活性分子的合成以及代谢不平衡[5]。免疫/炎症因素在SLE-PAH中也起重要作用,系统性红斑狼疮患者肺血管的血管炎或毛细血管炎可导致血管损伤、重塑,随之发生肺动脉压力升高[6]。该研究通过回顾性分析得出pSS并发PAH的独立危险因素包括间质性肺炎、年龄、以肺部表现为首发症状。
关于间质性肺炎在pSS相关PAH中的作用,目前有多种假设,包括PAH可能是间质性肺炎的直接后果,是广泛肺组织破坏情况下低氧血症引起的。然而有研究[7]指出与肺功能损害程度相比,pSS相关PAH患者通常具有非常高的平均肺动脉压,两者并不平行,可能是特定血管病变在其中起主要作用。这些假设解释了pSS相关PAH患者间质性肺炎发病率较高的原因,两者可能有相似的病理生理途径,并且有研究[8]指出,初始评估时较高的平均肺动脉压是结缔组织病相关间质性肺炎预后的重要独立预测因子,这也展示了两者的密切联系。
既往有回顾性研究[9]表明pSS-PAH组年龄较轻。该研究结果正好相反,提示年龄为pSS发生PAH独立危险因素(OR为1.040,P=0.005),结论的不同可能与前者样本量较小(纳入pSS患者总数47例,其中合并PAH仅11例)有关,需进一步研究加以探讨。近期一项中国最大pSS合并间质性肺炎的研究[10]中,年龄也同样为独立危险因素,这些均提示,对于高龄pSS患者,要对肺部受累情况进行积极全面筛查。
该研究还探讨起病时症状对于预后的影响,结果显示以肺部症状(咳嗽、呼吸困难等)为初始临床表现者,后来更易发展为pSS-PAH(OR为3.104,P=0.010)。呼吸困难同样为系统性红斑狼疮患者发生PAH的预测因子[11],提示患者以肺部症状就诊时,应注意进行PAH的筛查。需要关注的是,有研究[12]指出一部分pSS相关PAH可能被误诊为特发性PAH,临床医生在PAH初始诊断中应仔细评估pSS的可能性。

